- 5.84 MB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
3
讲 晶体结构与性质
【考纲点击】
(1)
了解晶体的类型,了解不同类型晶体中构成微粒及微粒间作用力的区别;
(2)
了解晶格能的概念,了解晶格能对离子晶体性质的影响;
(3)
了解分子晶体结构与性质的关系;
(4)
了解原子晶体的特征,能描述金刚石、二氧化硅等原子晶体的结构与性质的关系;
(5)
理解金属键的含义,能用金属键理论解释金属的一些物理性质,了解金属晶体常见的堆积方式;
(6)
了解晶胞的概念,能根据晶胞确定晶体的组成并进行相关的计算。
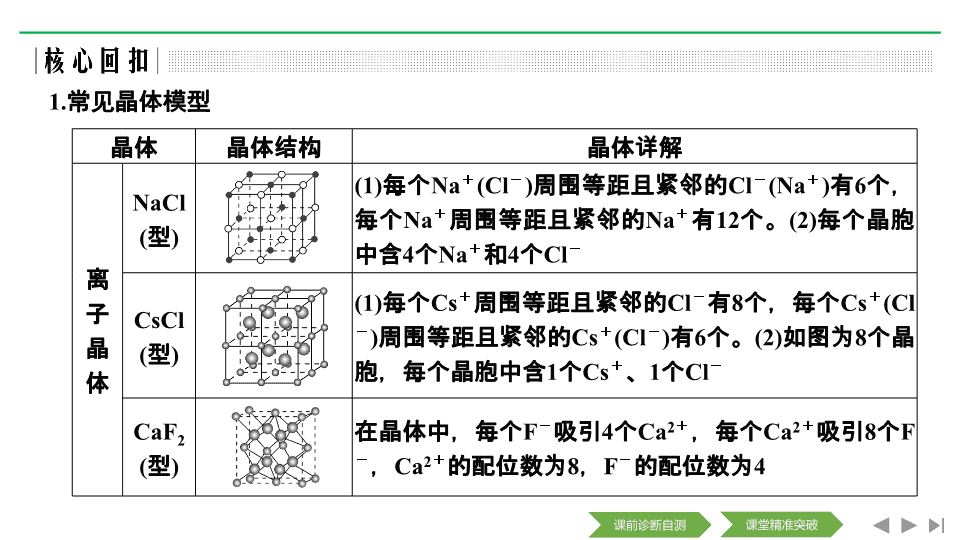
1.
常见晶体模型
晶体
晶体结构
晶体详解
离子晶体
NaCl
(
型
)
(1)
每个
Na
+
(
Cl
-
)
周围等距且紧邻的
Cl
-
(Na
+
)
有
6
个,每个
Na
+
周围等距且紧邻的
Na
+
有
12
个。
(2)
每个晶胞中含
4
个
Na
+
和
4
个
Cl
-
CsCl
(
型
)
(1)
每个
Cs
+
周围等距且紧邻的
Cl
-
有
8
个,每个
Cs
+
(
Cl
-
)
周围等距且紧邻的
Cs
+
(
Cl
-
)
有
6
个。
(2)
如图为
8
个晶胞,每个晶胞中含
1
个
Cs
+
、
1
个
Cl
-
CaF
2
(
型
)
在晶体中,每个
F
-
吸引
4
个
Ca
2
+
,每个
Ca
2
+
吸引
8
个
F
-
,
Ca
2
+
的配位数为
8
,
F
-
的配位数为
4
金属晶体
简单立
方堆积
典型代表
Po
,空间利用率
52%
,配位数为
6
体心立
方堆积
典型代表
Na
、
K
、
Fe
,空间利用率
68%
,配位数为
8
六方最
密堆积
典型代表
Mg
、
Zn
、
Ti
,空间利用率
74%
,配位数为
12
面心立
方最密
堆积
典型代表
Cu
、
Ag
、
Au
,空间利用率
74%
,配位数为
12
分子
晶体
干冰
(1)8
个
CO
2
分子构成立方体且在
6
个面心又各占据
1
个
CO
2
分子。
(2)
每个
CO
2
分子周围等距紧邻的
CO
2
分子有
12
个
混合型晶体
石墨
晶体
层与层之间的作用力是分子间作用力,平均每个正六边形拥有的碳原子个数是
2
,
C
采取的杂化方式是
sp
2
杂化
2.
物质熔沸点高低比较规律
(1)
不同类型晶体熔沸点高低的比较
一般情况下,不同类型晶体的熔沸点高低规律:原子晶体
>
离子晶体
>
分子晶体,如:金刚石
>
NaCl
>Cl
2
;金属晶体
>
分子晶体,如:
Na>Cl
2
(
金属晶体熔沸点有的很高,如钨、铂等,有的则很低,如汞等
)
。
(2)
同种类型晶体熔沸点高低的比较
①
原子晶体:
如:金刚石
>
石英
>
碳化硅
>
晶体硅。
②
离子晶体:
a.
衡量离子晶体稳定性的物理量是晶格能。晶格能越大,形成的离子晶体越稳定,熔点越高,硬度越大。
b.
一般地说,阴阳离子的电荷数越多,离子半径越小,离子键越强,晶格能越大,熔沸点就越高,如:
MgO
>MgCl
2
,
NaCl
>
CsCl
。
③
金属晶体:金属离子半径越小,离子所带电荷数越多,其形成的金属键越强,金属单质的熔沸点就越高,如
Al>Mg>Na
。
④
分子晶体
a.
分子间作用力越大,物质的熔沸点越高;具有分子间氢键的分子晶体熔沸点反常地高。如
H
2
O>H
2
Te>H
2
Se>H
2
S
。
b.
组成和结构相似的分子晶体,相对分子质量越大,熔沸点越高,如
SnH
4
>GeH
4
>SiH
4
>CH
4
。
c.
组成和结构不相似的物质
(
相对分子质量接近
)
,分子的极性越大,其熔沸点越高,如
CO>N
2
。
d.
在同分异构体中,一般支链越多,熔沸点越低,如正戊烷
>
异戊烷
>
新戊烷。
3.
晶胞求算
晶胞中微粒数目的计算方法
——
均摊法
1.(1)
[2019·
课标全国
Ⅰ
,
35(3)(4)]
①
一些氧化物的熔点如表所示:
解释表中氧化物之间熔点差异的原因
___________________________
_____________________________________________________
。
氧化物
Li
2
O
MgO
P
4
O
6
SO
2
熔点
/
℃
1 570
2 800
23.8
-
75.5
②
图
(a)
是
MgCu
2
的拉维斯结构,
Mg
以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的
Cu
。图
(b)
是沿立方格子对角面取得的截图。可见,
Cu
原子之间最短距离
x
=
________pm
,
Mg
原子之间最短距离
y
=
________pm
。设阿伏加德罗常数的值为
N
A
,则
MgCu
2
的密度是
________
g·cm
-
3
(
列出计算表达式
)
。
(2)
[2019·
课标全国
Ⅱ
,
35(3)(4)]
①
比较离子半径:
F
-
________O
2
-
(
填
“
大于
”“
等于
”
或
“
小于
”
)
。
②
一种四方结构的超导化合物的晶胞如图
1
所示。晶胞中
Sm
和
As
原子的投影位置如图
2
所示。
2.
[2018·
课标全国
Ⅰ
,
35(4)(5)]
(1)Li
2
O
是离子晶体,其晶格能可通过图
(a)
的
Born
-
Haber
循环计算得到。
可知,
Li
原子的第一电离能为
________
kJ·mol
-
1
,
O===O
键键能为
________
kJ·mol
-
1
,
Li
2
O
晶格能为
________
kJ·mol
-
1
。
(2)Li
2
O
具有反萤石结构,晶胞如图
(b)
所示。已知晶胞参数为
0.466 5 nm
,阿伏加德罗常数的值为
N
A
,则
Li
2
O
的密度为
________
g·cm
-
3
(
列出计算式
)
。
3.
[2018·
课标全国
Ⅱ
,
35
节选
]
硫及其化合物有许多用途,相关物质的物理常数如下表所示:
①
图
(a)
为
S
8
的结构,其熔点和沸点要比二氧化硫的熔点和沸点高
很多,主要原因为
________________________________________
_____________________________________________________
。
H
2
S
S
8
FeS
2
SO
2
SO
3
H
2
SO
4
熔点
/
℃
-
85.5
115.2
>
600
(
分解
)
-
75.5
16.8
10.3
沸点
/
℃
-
60.3
444.6
-
10.0
45.0
337.0
4.
[2017·
课标全国
Ⅰ
,
35(2)(4)(5)]
(1)K
和
Cr
属于同一周期,且核外最外层电子构型相同,但金属
K
的熔点、沸点等都比金属
Cr
低,原因是
_____________________________________________________
_____________________________________________________
。
(2)KIO
3
晶体是一种性能良好的非线性光学材料,具有钙钛
矿型的立体结构,边长为
a
=
0.446 nm
,晶胞中
K
、
I
、
O
分
别处于顶角、体心、面心位置,如图所示。
K
与
O
间的最短
距离为
________ nm
,与
K
紧邻的
O
个数为
________
。
(3)
在
KIO
3
晶胞结构的另一种表示中,
I
处于各顶角位置,则
K
处于
________
位置,
O
处于
________
位置。
5.
[2016·
课标全国
Ⅲ
,
37(4)(5)]
(1)GaF
3
的熔点高于
1 000
℃
,
GaCl
3
的熔点为
77.9
℃
,其原因是
_____________________________________________
。
(2)GaAs
的熔点为
1 238
℃
,密度为
ρ
g·cm
-
3
,其晶胞结构如图所示。该晶体的类型为
________
,
Ga
与
As
以
________
键键合。
Ga
和
As
的摩尔质量分别为
M
Ga
g·mol
-
1
和
M
As
g·mol
-
1
,原子半径分别为
r
Ga
pm
和
r
As
pm
,阿伏加德罗常数值为
N
A
,则
GaAs
晶胞中原子的体积占晶胞体积的百分率为
___________________________
。
6.
[2017·
江苏化学,
21(A)—5]
某
Fe
x
N
y
的晶胞如图
1
所示,
Cu
可以完全替代该晶体中
a
位置
Fe
或者
b
位置
Fe
,形成
Cu
替代型产物
Fe
(
x
-
n
)
Cu
n
N
y
。
Fe
x
N
y
转化为两种
Cu
替代型产物的能量变化如图
2
所示,其中更稳定的
Cu
替代型产物的化学式为
________
。
答案
Fe
3
CuN
题组一 晶体类型与物理性质
1.
下列排序不正确的是
(
)
A.
晶体熔点:对羟基苯甲醛
>
邻羟基苯甲醛
B.
硬度:金刚石
>
碳化硅
>
晶体硅
C.
熔点:
Na>Mg>Al
D.
晶格能:
NaF
>
NaCl
>
NaBr
>
NaI
解析
A
项,能形成分子间氢键的对羟基苯甲醛的熔、沸点大于能形成分子内氢键的邻羟基苯甲醛的熔、沸点;
B
项,对于原子晶体,原子半径越小,键长越短,共价键越牢固,硬度越大,键长:
C—C
键
碳化硅
>
晶体硅;
C
项,金属晶体的熔点取决于原子半径以及价电子数,其规律是原子半径越小,价电子数越多,熔点越高,则熔点:
Al>Mg>Na
;
D
项,离子所带电荷相同时,离子键的强弱与离子半径有关,离子半径越小,离子键越强,晶格能越大。
答案
C
2.
据某科学杂志报道,国外有一研究发现了一种新的球形分子,它的分子式为
C
60
Si
60
,其分子结构好似中国传统工艺品
“
镂雕
”
,经测定,其中包含
C
60
,也有
Si
60
结构。下列叙述正确的是
(
)
A.
该物质有很高的熔点、很大的硬度
B.
该物质形成的晶体属于分子晶体
C.
该物质分子中
Si
60
被包裹在
C
60
里面
D.
该物质的相对分子质量为
1 200
解析
A
项,由分子式及信息可知该物质为分子晶体,分子晶体熔、沸点低;
B
项,该物质是分子晶体;
C
项,
Si
的原子半径大于
C
,该物质分子中应为
C
60
被包裹在
Si
60
里面;
D
项,相对分子质量为
(12
+
28)
×
60
=
2 400
。
答案
B
3.(1)
钛比钢轻,比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是
_____________________________________________________
。
(2)
已知
MgO
与
NiO
的晶体结构相同,其中
Mg
2
+
和
Ni
2
+
的离子半径分别为
66 pm
和
69 pm
。则熔点:
MgO________NiO
(
填
“>”“<”
或
“
=
”
)
,理由是
_____________________________________________________
。
(3)
砷化镓以第三代半导体著称,熔点为
1 230
℃
,具有空间网状结构。已知氮化硼与砷化镓属于同种晶体类型。则两种晶体熔点较高的是
________(
填化学式
)
,其理由是
_____________________________________________________
_____________________________________________________
。
答案
(1)Ti
原子的价电子数比
Al
多,
Ti
4
+
比
Al
3
+
半径小,金属键强
(2)
>
Mg
2
+
半径比
Ni
2
+
小,
MgO
的晶格能比
NiO
大
(3)BN
两种晶体均为原子晶体,
N
与
B
原子半径较小,键能较大,熔点更高
4.(1)
①
ScCl
3
易溶于水,熔点为
960
℃
,熔融状态下能够导电,据此可判断
ScCl
3
晶体属于
________(
填晶体类型
)
。
②
元素
Ce
与
Sc
同族,其与
O
形成的化合物晶体的晶胞结构如图所示,该化合物的化学式为
_____________________________________________________
_____________________________________________________
。
(2)
①
C
60
和金刚石都是碳的同素异形体,二者相比较熔点高的是
________
。
②
超高导热绝缘耐高温纳米氮化铝在绝缘材料中应用广泛,氮化铝晶体与金刚石类似,每个
Al
原子与
________
个
N
原子相连,与同一个
N
原子相连的
Al
原子构成的空间构型为
________
。
③
金属镍粉在
CO
气流中轻微加热,生成无色挥发性液态
Ni(CO)
4
,呈正四面体构型。试推测
Ni(CO)
4
的晶体类型是
________
,
Ni(CO)
4
易溶于下列
________(
填字母
)
。
A.
水
B.
四氯化碳
C.
苯
D.
硫酸镍溶液
④
AlCl
3
在
177.8
℃
时升华,蒸气或熔融状态以
Al
2
Cl
6
形式存在。下列关于
AlCl
3
的推断错误的是
________(
填字母
)
。
A.
氯化铝为共价化合物
B.
氯化铝为离子化合物
C.
氯化铝难溶于有机溶剂
D.Al
2
Cl
6
中存在配位键
答案
(1)
①
离子晶体
②
CeO
2
(2)
①
金刚石
②
4
正四面体形
③
分子晶体
BC
④
BC
题组二 晶体结构
5.(1)
某钙钛矿型复合氧化物如图甲所示,以
A
原子为晶胞的顶点,
A
位可以是
Ca
、
Sr
、
Ba
或
Pb
,当
B
位是
V
、
Cr
、
Mn
、
Fe
等时,这种化合物具有
CMR
效应。
①
用
A
、
B
、
O
表示这类特殊晶体的化学式:
________
。
②
已知
La
为+
3
价,当被钙等二价元素
A
替代时,可形成复合钙钛化合物
La
1
-
x
A
x
MnO
3
(
x
<0.1)
,此时一部分锰转变为+
4
价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁及金属-半导体的转变,则
La
1
-
x
A
x
MnO
3
中三价锰与四价锰的物质的量之比为
________(
用
x
表示
)
。
(2)
用
CuSO
4
和
NaOH
制备的
Cu(OH)
2
检验醛基时,生成红色的
Cu
2
O
,其晶胞结构如图乙所示。
(3)
磷化铝熔点为
2 000
℃
,它与晶体硅互为等电子体,磷化铝晶胞结构如图丙所示:
①
图中
A
点和
B
点的原子坐标参数如图丙所示,则
C
点的原子坐标参数为
________
。
②
磷化铝晶体的密度为
ρ
g·cm
-
3
,用
N
A
表示阿伏加德罗常数的值,则该晶胞中距离最近的两个铝原子之间的距离为
________cm
。
6.(1)
钙钛矿
(CaTiO
3
)
型的结构可看作氧化物超导相结构的基本单元:
①
图
A
为立方钙钛矿
(CaTiO
3
)
结构的晶胞,晶胞边长为
a
nm
。
Ca
处于晶胞的顶点,则
Ti
处于
________
位置,
O
处于
________
位置;与
Ca
紧邻的
O
个数为
________
,
Ti
与
O
间的最短距离为
________nm
。
②
在图
B
中画出立方钙钛矿晶胞结构的另一种表示
(
要求:
Ti
处于晶胞的顶点;
△
、
●
、
○
所代表的原子种类与图
A
中相同
)
。
(2)GaAs
是一种重要的半导体材料,按图示掺杂锰后可得稀磁性半导体材料
(
晶体结构不变
)
,则该材料晶体中
n
(Ga)
∶
n
(Mn)
∶
n
(As
)
=
________
。
(3)
硒化锌的晶胞结构如图所示,图中
X
和
Y
点所堆积的原子均为
________(
填元素符号
)
;该晶胞中硒原子所处空隙类型为
________(
填
“
立方体
”“
正四面体
”
或
“
正八面体
”
)
;若该晶胞密度为
ρ
g·cm
-
3
,硒化锌的摩尔质量为
M
g·mol
-
1
。用
N
A
代表阿伏加德罗常数的数值,则晶胞参数
a
为
________nm
。