- 161.50 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化 学 试 题
满分:100分 时间:90分钟
原子量:C:12 O:12 N:14
一、单选选择题 (每题4分,共64分)
1.下列叙述正确的是( )
A.水能是二次能源 B. 电能是二次能源
C.天然气是可再生能源 D. 水煤气是可再生能源
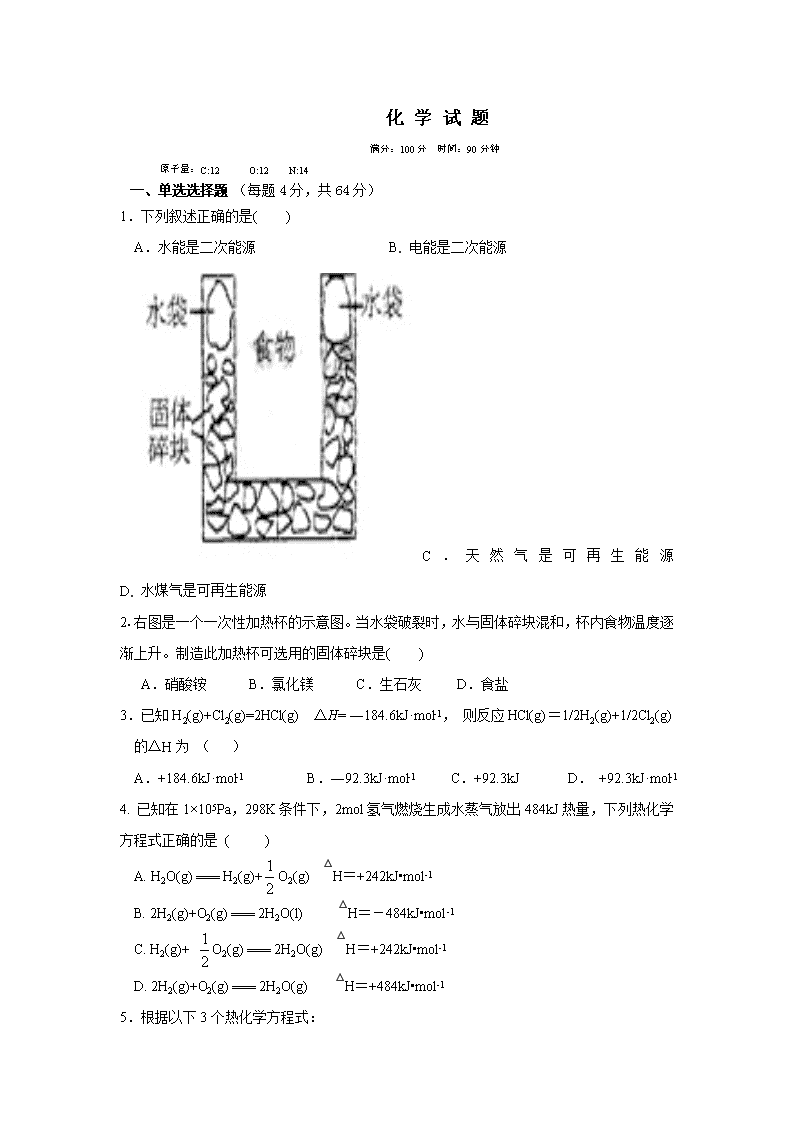
2.右图是一个一次性加热杯的示意图。当水袋破裂时,水与固体碎块混和,杯内食物温度逐渐上升。制造此加热杯可选用的固体碎块是( )
A.硝酸铵 B.氯化镁 C.生石灰 D.食盐
3.已知H2(g)+Cl2(g)=2HCl(g) △H= ―184.6kJ·mol-1, 则反应HCl(g)=1/2H2(g)+1/2Cl2(g)的△H为 ( )
A.+184.6kJ·mol-1 B.―92.3kJ·mol-1 C.+92.3kJ D. +92.3kJ·mol-1
4. 已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是 ( )
A. H2O(g) === H2(g)+O2(g) △H=+242kJ•mol-1
B. 2H2(g)+O2(g) === 2H2O(l) △H=-484kJ•mol-1
C. H2(g)+ O2(g) === 2H2O(g) △H=+242kJ•mol-1
D. 2H2(g)+O2(g) === 2H2O(g) △H=+484kJ•mol-1
5.根据以下3个热化学方程式:
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=―Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l) △H=―Q2 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g) △H=―Q3 kJ/mol
判断Q1、Q2、Q3三者关系正确的是( )
A. Q1>Q2>Q3 B. Q1>Q3>Q2 C. Q3>Q2>Q1 D. Q2>Q1>Q3
6. 已知:(1)Zn(s)+O2(g)=== ZnO(s),ΔH= -348.3 kJ·mol-1,
(2)2Ag(s)+ O2(g)=== Ag2O(s),ΔH= -31.0 kJ·mol-1,
则Zn(s)+ Ag2O(s) === ZnO(s)+ 2Ag(s)的ΔH等于( )
A.-379.3 kJ·mol-1 B.-317.3 kJ·mol-1 C.-332.8 kJ·mol-1 D.317.3 kJ·mol-1
7、反应C(s)+H2O(g)CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半
③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大.
A.①④ B.②③ C.①③ D.②④
8、把 0.6molX气体和0.4molY气体混合于2L的密闭容器中,使它们发生如下反应 3X(g)+Y(g)nZ(g)+2W(g),5min末已生成 0.2molW,若测知以 Z 表示的平均反应速率为 0.01mol·L﹣1·min﹣1,则 n是( )
A.2 B.4 C.1 D.3
9. 已知25℃、101kPa条件下:4Al (s) + 3O2 (g) = 2Al2O3 (s) △H = -2834.9 kJ/mol
4Al (s) + 2O3 (g) = 2Al2O3 (s) △H = -3119.91kJ/mol。由此得出的结论正确的是
A.O2比O3稳定,由O2变O3 为放热反应
B.O3比O2稳定,由O2变O3 为吸热反应
C.等质量的O2比O3能量低,由O2变O3 为放热反应
D.等质量的O2比O3能量低,由O2变O3 为吸热反应
10.下列各组热化学方程式中,△H1>△H2的是
①C(s)+O2(g)===CO2(g) △H1 C(s)+O2(g)===CO(g) △H2
②S(s)+O2(g)===SO2(g) △H1 S(g)+O2(g)===SO2(g) △H2
③H2(g)+O2(g)===H2O(l) △H1 2H2(g)+O2(g)===2H2O(l) △H2
④CaCO3(s)===CaO(s)+CO2(g) △H1 CaO(s)+H2O(l)===Ca(OH)2(s) △H2
A.① B.④ C.②③④ D.①②③
11.下列说法正确的是
A.物质发生化学变化都伴随着能量变化
B.任何反应中的能量变化都表现为热量变化
C.伴有能量变化的物质变化都是化学变化
D.即使没有物质的变化,也可能有能量的变化
12. 已知25℃、101kPa条件下:4Al (s) + 3O2 (g) = 2Al2O3 (s) △H = -2834.9 kJ/mol
4Al (s) + 2O3 (g) = 2Al2O3 (s) △H = -3119.91kJ/mol。由此得出的结论正确的是
A.O2比O3稳定,由O2变O3 为放热反应
B.O3比O2稳定,由O2变O3 为吸热反应
C.等质量的O2比O3能量低,由O2变O3 为放热反应
D.等质量的O2比O3能量低,由O2变O3 为吸热反应
13.一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+B(g)2C(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量 ④B物质的量浓度.
A.①②④ B.②③ C.②③④ D.全部
14.已知反应X+Y===M+N为放热反应,下列对该反应的说法中正确的是()
A.X的能量一定高于M
B.Y的能量一定高于N
C.X和Y的总能量一定高于M和N的总能量
D.因该反应为放热反应,故不必加热就可发生
15.已知:C(s)+H2O(g)===CO(g)+H2(g) ΔH=a kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH=-220 kJ·mol-1,H—H、O=O和O—H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为( )
A.-118 B.+130 C.-332 D.+350
16.已知:N2(g)+O2(g)===2NO(g) ΔH1=+180.5 kJ·mol-1 ①
2C(s)+O2(g)===2CO(g) ΔH2=-221.0 kJ·mol-1 ②
C(s)+O2(g)===CO2(g) ΔH3=-393.5 kJ·mol-1 ③
则能表示汽车尾气转化的热化学方程式为( )
A.2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=-746.5 kJ·mol-1
B.2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=+746.5 kJ·mol-1
C.2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=-1 493 kJ·mol-1
D.2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=+1 493 kJ·mol-1
第二卷(非选择题每空2分,共36分)
17.(10分)依据事实,写出下列反应的热化学方程式。
(1) 在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___________________________________________
(2)若适量的N2和O2完全反应,每生成23克NO2需要吸收16.95kJ热量。_____________________________________________
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________
(4)根据图1-1和图1-2,写出反应的热化学方程式。
图1-1 图1-2
①
②
18.(10分)某研究小组将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:
(1)研究小组做该实验时环境温度 (填“高于”、“低于”或“等于”)22 ℃,判断的依据是
(2)由题干及图形可知,V1/V2= : 时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为 mol/L。
(3)若通过实验测定及有关计算知此反应共放出Q KJ的热量,请写出此反应的热化学方程式:
19.(10分)将等物质的量的A.B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)xC(g)+2D(g),经5min后达平衡状态,此时测得D的浓度为0.5mol/L,混合气体的总体积为134.4L(标准状况),C的平均反应速率为0.1mol/(L·min).试求:
(1)此时C的浓度c(C)= mol/L,x的值为 ;
(2)反应开始前容器中的A.B的物质的量:n(A)=n(B)= mol;
(3)A的平均反应速率为
20.(8分) ①CaCO3(s) == CaO + CO2(g);ΔH= 177.7kJ/mol
②C(s) + H2O(g)== CO(g) + H2(g);ΔH= -131.3kJ/mol
③0.5H2SO4(l) + NaOH(l) == 0.5Na2SO4(l) + H2O(l);ΔH= -57.3kJ/mol
④C(s) + O2(g) == CO2(g);ΔH=-393.5kJ/mol
⑤CO(g) + 1/2 O2(g) == CO2(g);ΔH=-283kJ/mol
⑥HNO3 (aq) + NaOH(aq) == NaNO3(aq) + H2O(l);ΔH= -57.3kJ/mol
⑦2H2(g) + O2(g) == 2H2O(l);ΔH= -517.6kJ/mol
(1)上述热化学方程式中,不正确的有__________
(2)根据上述信息,写出C转化为CO的热化学方程式_____________________________。
(3)上述反应中,表示燃烧热的热化学方程式有__________;表示中和热的热化学方程式有__________。