- 1.37 MB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020年全国统一高考化学试卷(全国Ⅱ卷)
一、选择题
1.北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾,烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”。下列有关叙述错误的是()
A.胆矾的化学式为CuSO4
B.胆矾可作为湿法冶铜的原料
C.“熬之则成胆矾”是浓缩结晶过程
D.“熬胆矾铁釜,久之亦化为铜”是发生了置换反应
2.某白色固体混合物由NaCl、KCl、MgSO4、CaCO3中的两种组成,进行如下实验:①混合物溶于水,得到澄清透明溶液;②做焰色反应,通过钴玻璃可观察到紫色;③向溶液中加碱,产生白色沉淀。根据实验现象可判断其组成为()
A.KCl、NaCl B.KCl、MgSO4 C.KCl、CaCO3 D.MgSO4、NaCl
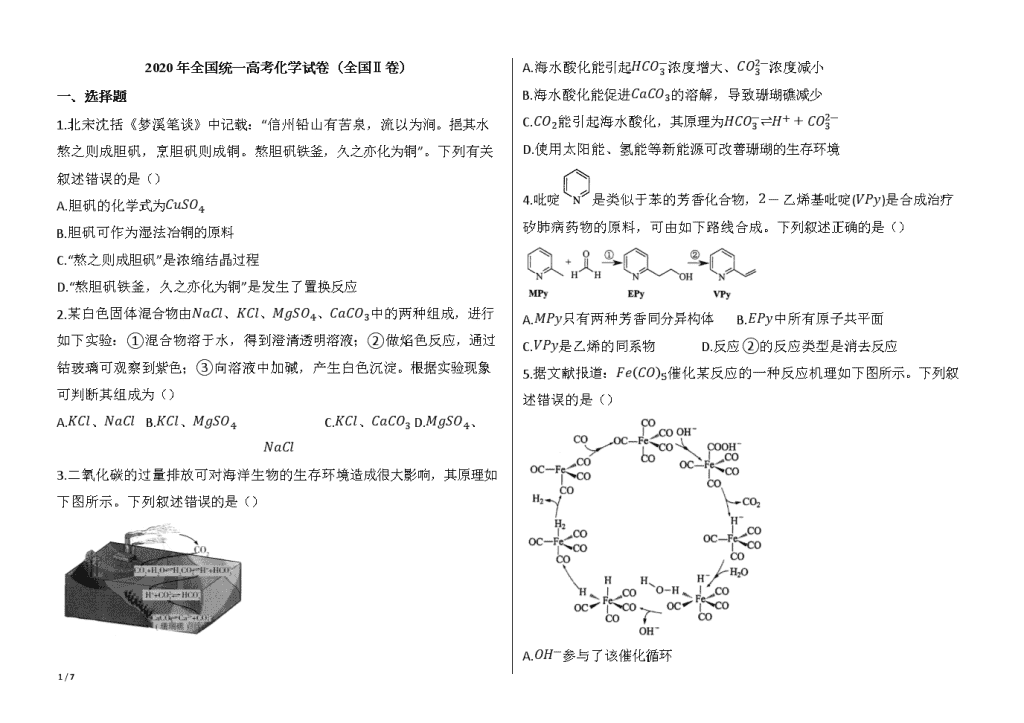
3.二氧化碳的过量排放可对海洋生物的生存环境造成很大影响,其原理如下图所示。下列叙述错误的是()
A.海水酸化能引起HCO3-浓度增大、CO32-浓度减小
B.海水酸化能促进CaCO3的溶解,导致珊瑚礁减少
C.CO2能引起海水酸化,其原理为HCO3-⇌H++CO32-
D.使用太阳能、氢能等新能源可改善珊瑚的生存环境
4.吡啶是类似于苯的芳香化合物,2-乙烯基吡啶(VPy)是合成治疗矽肺病药物的原料,可由如下路线合成。下列叙述正确的是()
A.MPy只有两种芳香同分异构体 B.EPy中所有原子共平面
C.VPy是乙烯的同系物 D.反应②的反应类型是消去反应
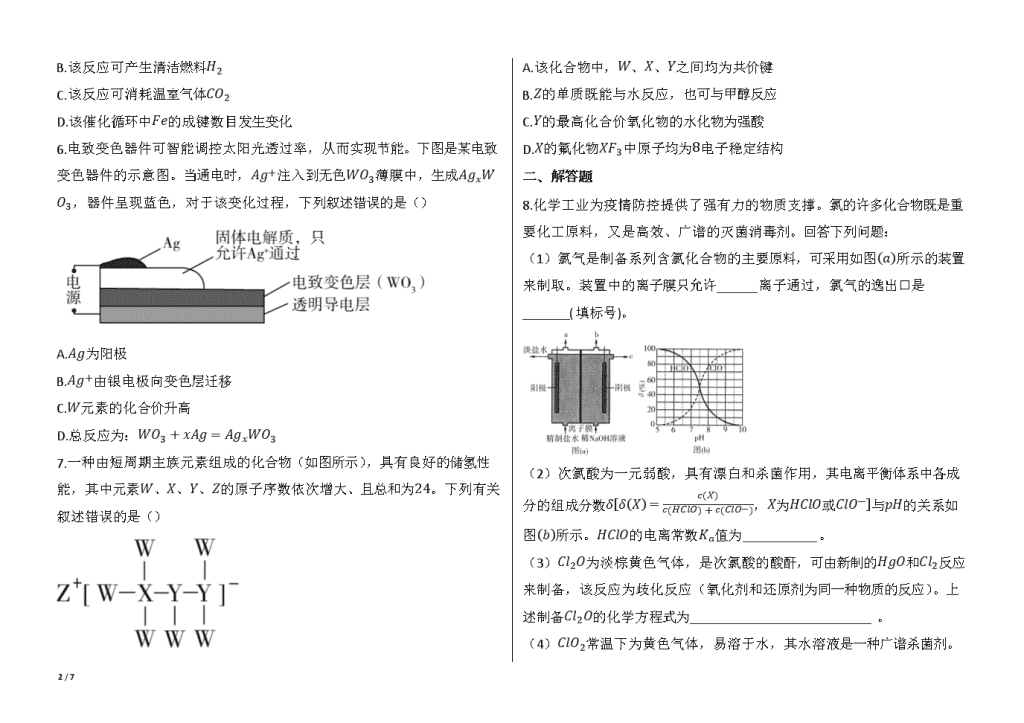
5.据文献报道:Fe(CO)5催化某反应的一种反应机理如下图所示。下列叙述错误的是()
7 / 7
A.OH-参与了该催化循环
B.该反应可产生清洁燃料H2
C.该反应可消耗温室气体CO2
D.该催化循环中Fe的成键数目发生变化
6.电致变色器件可智能调控太阳光透过率,从而实现节能。下图是某电致变色器件的示意图。当通电时,Ag+注入到无色WO3薄膜中,生成AgxWO3,器件呈现蓝色,对于该变化过程,下列叙述错误的是()
A.Ag为阳极
B.Ag+由银电极向变色层迁移
C.W元素的化合价升高
D.总反应为:WO3+xAg=AgxWO3
7.一种由短周期主族元素组成的化合物(如图所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是()
A.该化合物中,W、X、Y之间均为共价键
B.Z的单质既能与水反应,也可与甲醇反应
C.Y的最高化合价氧化物的水化物为强酸
D.X的氟化物XF3中原子均为8电子稳定结构
二、解答题
8.化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许______离子通过,氯气的逸出口是_______(填标号)。
(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)=c(X)c(HClO)+c(ClO-),X为HClO或ClO-]与pH的关系如图(b)所示。HClO
7 / 7
的电离常数Ka值为___________。
(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为___________________________。
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1molClO2消耗NaClO2的量为________mol;产生“气泡”的化学方程式为________________________________________________。
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是_____________________________(用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000kg该溶液需消耗氯气的质量为________kg(保留整数)。
9.苯甲酸可用作食品防腐剂。实验室可通过甲苯氧化制苯甲酸,其反应原理简示如下:
+KMnO4→+MnO2→+HCl→+KCl
名称
相对分
子质量
熔点/℃
沸点/℃
密度/(g⋅mL-1)
溶解性
甲苯
92
-95
110.6
0.867
不溶于水,易溶于乙醇
苯甲酸
122
122.4(100∘C左右开始升华)
248
____________
微溶于冷水,易溶于乙醇、热水
实验步骤:
(1)在装有温度计、冷凝管和搅拌器的三颈烧瓶中加入1.5mL甲苯、100mL水和4.8g(约0.03moL)高锰酸钾,慢慢开启搅拌器,并加热回流至回流液不再出现油珠。
(2)停止加热,继续搅拌,冷却片刻后,从冷凝管上口慢慢加入适量饱和亚硫酸氢钠溶液,并将反应混合物趁热过滤,用少量热水洗涤滤渣。合并滤液和洗涤液,于冰水浴中冷却,然后用浓盐酸酸化至苯甲酸析出完全。将析出的苯甲酸过滤,用少量冷水洗涤,放在沸水浴上干燥。称量,粗产品为1.0g。
(3)纯度测定:称取0.122g粗产品,配成乙醇溶液,于100mL容量瓶中定容。每次移取25.00moL溶液,用0.01000moL-1的KOH标准溶液滴定,三次滴定平均消耗21.50mL的KOH标准溶液。
回答下列问题:
(1)根据上述实验药品的用量,三颈烧瓶的最适宜规格为______(
7 / 7
填标号)。
A.100mLB.250mLC.500mLD.1000mL
(2)在反应装置中应选用______冷凝管(填“直形”或“球形”),当回流液不再出现油珠即可判断反应已完成,其判断理由是_________________________________________。
(3)加入适量饱和亚硫酸氢钠溶液的目的是____________________________________;该步骤亦可用草酸在酸性条件下处理,请用反应的离子方程式表达其原理________________________________________。
(4)“用少量热水洗涤滤渣”一步中滤渣的主要成分是_______。
(5)干燥苯甲酸晶体时,若温度过高,可能出现的结果是_____________________________________。
(6)本实验制备的苯甲酸的纯度为_______;据此估算本实验中苯甲酸的产率最接近于_______(填标号)。
A.70%B.60%C.50%D.40%
(7)若要得到纯度更高的苯甲酸,可通过在水中__________的方法提纯。
10.天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料。
(1)乙烷在一定条件可发生如下反应:C2H6(g)=C2H4(g)+H2(g)ΔH,相关物质的燃烧热数据如下表所示:
物质
C2H6(g)
C2H4(g)
H2(g)
燃烧热ΔH(kJmol-1)
-1560
-1411
-286
①ΔH=___________kJ⋅mol-1。
②提高该反应平衡转化率的方法有________、__________。
③容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)高温下,甲烷生成乙烷的反应如下:2CH4→高温C2H6+H2。反应在初期阶段的速率方程为:r=k×cCH4,其中k为反应速率常数。
①设反应开始时的反应速率为r1,甲烷的转化率为α时的反应速率为r2,则r2=________r1。
②对于处于初期阶段的该反应,下列说法正确的是________。
A.增加甲烷浓度,r增大B.增加H2浓度,r增大
C.乙烷的生成速率逐渐增大D.降低反应温度,k减小
(3)CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如下图所示:
①阴极上的反应式为_________________________________________。
②若生成的乙烯和乙烷的体积比为2:1,则消耗的CH4和CO2体积比为
7 / 7
________。
11.钙钛矿(CaTO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为___________________________。
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI熔点依次升高,原因是______________________________________________________________。
化合物
TiF4
TiCl4
TiBr4
TiI4
熔点/℃
377
-24.12
38.3
155
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是___________________________;金属离子与氧离子间的作用力为________;Ca2+的配位数是________。
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I-和有机碱离子CH3NH3+,其晶胞如图(b)所示。其中Pb2+与图(a)中________的空间位置相同,有机碱CH3NH3+中,N原子的杂化轨道类型是________;若晶胞参数为anm,则晶体密度为______________g⋅cm3(列出计算式)。
(5)用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土镇(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图(c)所示,用离子方程式表示该原理________________________、_________________________________________。
12.维生素E是一种人体必需的脂溶性维生素,现已广泛应用于医药、营养品、化妆品等。天然的维生素E由多种生育酚组成,其中α-生育酚(化合物E)含量最高,生理活性也最高。下面是化合物E的一种合成路线,其中部分反应略去。
7 / 7
已知以下信息:a)
b)
c)
回答下列问题:
(1)A的化学名称为________。
(2)B的结构简式为__________________。
(3)反应物C含有三个甲基,其结构简式为__________________。
(4)反应⑤的反应类型为__________________。
(5)反应⑥的化学方程式为________________________________。
(6)化合物C的同分异构体中能同时满足以下三个条件的有________个(不考虑立体异构体,填标号)。
(ⅰ)含有两个甲基;(ⅱ)含有酮羰基(但不含C=C=O);(ⅲ)不含有环状结构。
(a)4(b)6(c)8(d)10
其中,含有手性碳(注:连有四个不同的原子或基团的碳)的化合物的结构简式为________________________。
7 / 7
参考答案与试题解析
2020年全国统一高考化学试卷(全国Ⅱ卷)
一、选择题
1.A 2.B 3.C 4.A 5.C 6.C 7.D
二、解答题
8.(1)Na+,a
(2)10-7.5
(3)2Cl2+HgO=HgCl2+Cl2O
(4)1.25,NaHCO3+NaHSO4=CO2↑+Na2SO4+H2O
(5)ClO-+Cl-+2H+=Cl2↑+H2O,203
9.(1)B
(2)球形,没有油珠说明不溶于水的甲苯已经被完全氧化
(3)除去过量的高锰酸钾,避免在用盐酸酸化时,产生氯气,2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(4)MnO2
(5)苯甲酸升华而损失
(6)86.0%,C
(7)重结晶
10.(1)①137,②升高温度、减小压强(增大体积),③α(1+α)(2+α)(1-α)×p
(2)①1-α,②AD
(3)①CO2+2e-=CO+O2-,②6:5
11.(1)1s22s22p63s23p63d24s2
(2)TiF4为离子化合物,熔点高,其他三种均为共价化合物,随相对分子质量的增大分子间作用力增大,熔点逐渐升高
(3)O>Ti>Ca,离子键,12
(4)Ti4+,sp3,620a3×NA×1021
(5)2Eu3++Pb=2Eu2++Pb2+,2Eu2++I2=2Eu3++2I-
12.(1)3-甲基苯酚(或间甲基苯酚)
(2)
(3)
(4)加成反应
(5)
(6)c,CH2=CHCH(CH3)COCH3()
7 / 7
相关文档
- 2020版高中化学 第3章 重要的有机2021-08-066页
- 2020版高考化学复习课时规范练 (222021-08-067页
- 高中化学人教版选修5课后训练:3_1_22021-08-0611页
- 高中化学人教版选修一(学业分层测评2021-08-064页
- 2020届高考化学二轮复习水溶液中的2021-08-068页
- 高中化学课件必修二《第四章 第二2021-08-0657页
- 2020届高考化学一轮复习基本营养物2021-08-0624页
- 2020版高中化学 第四章 非金属及其2021-08-067页
- 2020年高中化学 第04章 电化学基础2021-08-069页
- 新教材高中化学第三章自然界中的元2021-08-0626页