- 1.13 MB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
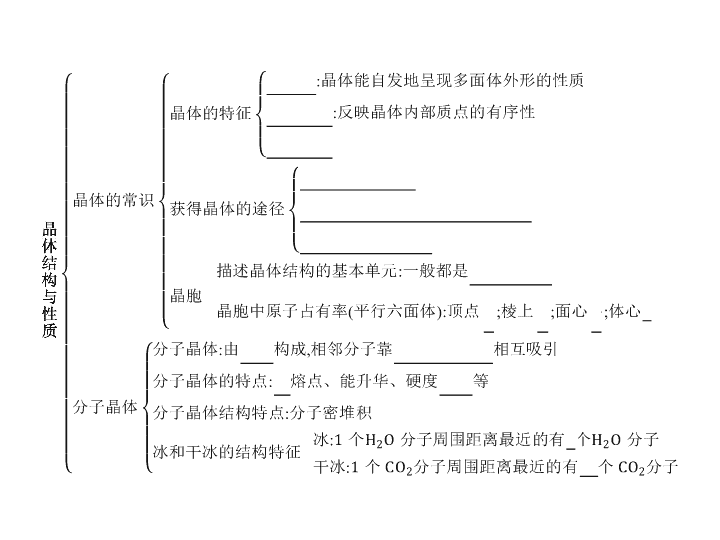
专题一
专题二
专题三
专题一
判断晶体类型的方法
1
.
依据组成晶体的微粒和微粒间的相互作用判断
(1)
离子晶体的构成微粒是阴、阳离子
,
微粒间的作用力是离子键。
(2)
原子晶体的构成微粒是原子
,
微粒间的作用力是共价键。
(3)
分子晶体的构成微粒是分子
,
微粒间的作用力为分子间作用力。
(4)
金属晶体的构成微粒是金属阳离子和自由电子
,
微粒间的作用力是金属键。
专题一
专题二
专题三
2
.
依据物质的分类判断
(1)
金属氧化物
(
如
K
2
O
、
Na
2
O
2
等
)
、强碱
(
如
NaOH
、
KOH
等
)
和绝大多数的盐类是离子晶体。
(2)
大多数非金属单质
(
除金刚石、石墨、晶体硅、晶体硼外
)
、气态氢化物、非金属氧化物
(
除
SiO
2
外
)
、酸、绝大多数有机物
(
除有机盐外
)
是分子晶体。
(3)
常见的原子晶体单质有金刚石、晶体硅、晶体硼等
,
常见的原子晶体化合物有碳化硅、二氧化硅等。
(4)
金属单质
(
除液态汞外
)
与合金是金属晶体。
专题一
专题二
专题三
3
.
依据晶体的熔点判断
(1)
离子晶体的熔点较高
,
常在数百至一千摄氏度。
(2)
原子晶体熔点高
,
常在一千至几千摄氏度。
(3)
分子晶体熔点低
,
常在数百摄氏度以下至很低温度。
(4)
金属晶体多数熔点高
,
但也有相当低的。
4
.
依据导电性判断
(1)
离子晶体的水溶液及熔融时能导电。
(2)
原子晶体一般为非导体。
(3)
分子晶体为非导体
,
但有些分子晶体溶于水
,
使分子内的化学键断裂
,
形成自由离子而导电。
(4)
金属晶体是电的良导体。
专题一
专题二
专题三
5
.
依据硬度和机械性能判断
(1)
离子晶体硬度较大或较硬、脆。
(2)
原子晶体硬度大。
(3)
分子晶体硬度小且较脆。
(4)
金属晶体多数硬度大
,
但也有较小的
,
且具有延展性。
6
.
判断晶体类型
,
既可以从结构入手
,
也可以从物理性质入手
(1)
由非金属元素组成的二元化合物不是离子晶体
(
二元以上未必正确
,
如
NH
4
Cl
、
NH
4
NO
3
)
。
(2)
熔点在一千摄氏度以下无原子晶体。
(3)
固态不导电
,
熔融态导电的是离子晶体。
(4)
熔点低
,
能溶于有机溶剂的晶体是分子晶体。
(5)
金属元素与非金属元素组成的化合物未必都是离子晶体
,
一般用元素电负性差来判断。组成元素电负性差大于
1.7
的一般是离子晶体
,
但不全符合
,
还与元素化合价有关。
专题一
专题二
专题三
【例
1
】
有
A
、
B
、
C
三种晶体
,
分别由
H
、
C
、
Na
、
Cl
四种元素中的一种或几种形成
,
对这三种晶体进行实验
,
结果如下表
: (
导学号
52700051)
(1)
晶体的化学式分别为
:A
,B
,C
。
(2)
晶体的类型分别为
:A
,B
,C
。
(3)
晶体中构成粒子间的作用分别为
:A
,B
,C
。
专题一
专题二
专题三
解析
:
由
A
在熔融时导电
,
可知
A
为离子晶体
,
即为
NaCl,
其中含离子键
;B
的硬度很大
,
不溶于水
,
又不导电
,
则知
B
为原子晶体
,
即为金刚石
,
含有共价键
;C
的熔点很低
,
可知为分子晶体
,
即为
HCl,HCl
是靠分子间作用力形成的晶体。
答案
:
(1)NaCl
C
HCl
(2)
离子晶体 原子晶体 分子晶体
(3)
离子键 共价键 分子间作用力
专题一
专题二
专题三
迁移训练
1
下表给出几种氯化物的熔点和沸点
:
据表中所列数据判断下列叙述与表中相吻合的是
(
)
A.AlCl
3
在加热条件下能升华
B.SiCl
4
晶体属于原子晶体
C.AlCl
3
晶体是典型的离子晶体
D.MgCl
2
在晶体中有分子存在
专题一
专题二
专题三
解析
:
观察
AlCl
3
的熔点和沸点可看出其沸点要低于熔点
,AlCl
3
在加热条件下可以升华
,A
项正确
;
从表中知
SiCl
4
的熔点是
-70
℃
,
由此看出其熔点低
,
属于分子晶体
,B
项错
;C
项
,AlCl
3
的熔、沸点不高
,
不属于离子晶体
,C
项错
;D
项
,MgCl
2
的熔、沸点均很高
,
不可能是分子晶体
,
故晶体中不存在单个分子
,D
项错。
答案
:
A
专题一
专题二
专题三
专题二
晶体熔、沸点的比较
1
.
不同类型晶体的熔、沸点
(
一般情况
)
原子晶体
>
离子晶体
>
分子晶体
;
金属晶体
(
除少数外
)>
分子晶体
;
金属晶体的熔、沸点有的很高
,
如钨
,
有的很低
,
如汞
(
常温下是液体
)
。
2
.
同类型晶体的熔、沸点
(1)
原子晶体
:
结构相似
,
原子半径越小
,
键长越短
,
键能越大
,
熔、沸点越高。如熔点
:
金刚石
>
碳化硅
>
晶体硅。
(2)
分子晶体
:
分子间作用力越强
,
熔、沸点越高。
①
组成和结构相似的分子晶体
:
一般相对分子质量越大
,
分子间作用力越强
,
熔、沸点越高。如熔点
:I
2
>Br
2
>Cl
2
>F
2
。
②
相对分子质量相同或相近的物质
:
分子的极性越大
,
熔、沸点越高。如沸点
:CO>N
2
。
专题一
专题二
专题三
③
同分异构体之间
:
一般是支链越多
,
熔、沸点越低。如沸点
:
正戊烷
>
异戊烷
>
新戊烷。
④
若分子间有氢键
,
则分子间作用力比结构相似的同类晶体大
,
故熔、沸点较高
,
如沸点
:HF>HI>HBr>HCl
。
(3)
金属晶体
:
所带电荷越多
,
金属阳离子半径越小
,
则金属键越强
,
熔、沸点越高。如熔点
:Al>Mg>Na>K
。
(4)
离子晶体
:
离子所带电荷越多
,
离子半径越小
,
离子键越强
,
熔、沸点越高。如熔点
:KF>KCl>KBr>KI
。
综上所述
,
比较物质熔、沸点高低的一般方法步骤是先看晶体类型
,
再比较分子间作用力的强弱。
专题一
专题二
专题三
【例
2
】
下列物质的熔、沸点高低顺序排列正确的是
(
)
A.
金刚石
>
晶体硅
>
二氧化硅
>
碳化硅
B.CI
4
>CBr
4
>CCl
4
>CF
4
C.MgO>H
2
O>N
2
>O
2
D.
金刚石
>
生铁
>
钠
>
纯铁
专题一
专题二
专题三
解析
:
A
项中物质全部为原子晶体
,
判断其熔、沸点高低可比较其原子半径
,
它们的原子半径由大到小的顺序为
Si>C>O,
键长关系为
Si—Si>Si—C>Si—O>C—C,
故熔、沸点
:
金刚石
>
二氧化硅
>
碳化硅
>
晶体硅
,A
项错误
;B
项为同种类型的分子晶体
,
可比较其相对分子质量大小
,
相对分子质量越大
,
熔、沸点越高
,B
项正确
;C
项中
N
2
与
O
2
为分子晶体
,O
2
的熔、沸点比
N
2
的高
,
故
C
项错误
;D
项
,
熔、沸点关系为金刚石
>
纯铁
>
生铁
>
钠
,
合金的熔、沸点一般比组成它的纯金属的熔、沸点低。
答案
:
B
专题一
专题二
专题三
迁移训练
2
下列关于晶体的说法正确的是
(
)(
导学号
52700052)
①
分子晶体中都存在共价键
②
在晶体中只要有阳离子就一定有阴离子
③
金刚石、
SiC
、
NaF
、
NaCl
、
H
2
O
、
H
2
S
晶体的熔点依次降低
④
离子晶体中只有离子键没有共价键
,
分子晶体中肯定没有离子键
⑤
CaTiO
3
晶体中
(
晶胞结构如图所示
)
每个
Ti
4+
和
12
个
O
2-
相紧邻
⑥
SiO
2
晶体中每个硅原子与两个氧原子以共价键相结合
⑦
晶体中分子间作用力越大
,
分子越稳定
⑧
氯化钠熔化时离子键被破坏
CaTiO
3
的晶体结构模型
A.
①②③⑥
B.
①②④
C.
③⑤⑦
D.
③⑤⑧
专题一
专题二
专题三
解析
:
稀有气体的晶体内不含化学键
;
金属晶体中含阳离子和自由电子
,
无阴离子
;
离子晶体内可能有共价键
;SiO
2
晶体中每个硅原子与四个氧原子以共价键相结合
;
分子的稳定性由共价键的键能决定
,
与分子间作用力无关。
答案
:
D
专题一
专题二
专题三
专题三
常见的晶体结构模型
专题一
专题二
专题三
专题一
专题二
专题三
专题一
专题二
专题三
专题一
专题二
专题三
专题一
专题二
专题三
【例
3
】
下图表示一个晶胞
,
该晶胞为正方体
,
原子
(
或分子、离子
)
位于正方体的顶点和面心。
试回答下列问题
(
只需回答一种代表物即可
):
(
导学号
52700053)
(1)
若这是一个分子晶体的晶胞
,
其代表物质是
;
(2)
若这是一个金属晶体的晶胞
,
其代表物质是
;
(3)
若这是一个不完整的金刚石晶胞
,
则晶胞中其他碳原子的数目和位置是
;
(4)
若这是一个不完整的
NaCl
晶胞
,
且顶点和面心的实心球表示
Na
+
,
则晶胞中
Cl
-
位置是
;
(5)
若这是一个不完整的
CaF
2
晶胞
,
且已知
CaF
2
中
Ca
2+
的
F
-
配位数为
8,
则图中实心球表示
Ca
2+
还是
F
-
?
答
:
。
专题一
专题二
专题三
解析
:
(1)
这是一个面心立方结构
,
如果是一个分子晶体
,
典型物质就是
CO
2
。
(2)
如果是金属晶胞
,
则为面心立方晶胞
,
金属中的
Cu
、
Ca
、
Au
、
Al
、
Pb
、
Pt
、
Ag
都是此类。
(3)
金刚石完整的图示为
,
由此可以看出
,
其他
4
个碳原子位于
4
个互不相邻小立方体的中心。
(4)
在氯化钠晶体中
,
每个
Na
+
的周围与之相邻的
Cl
-
有
6
个
,
当实心球代表
Na
+
时
,Cl
-
在体心和
12
条棱的中心。
(5)CaF
2
晶体模型
,
是立方面心晶胞
,
钙离子占据立方体的
8
个顶点和
4
个面心
,
而
F
-
占据
8
个小立方体的体心
,
故图中的实心球是代表
Ca
2+
。
专题一
专题二
专题三
答案
:
(1)
干冰、碘等
(2)
铜
(3)4,
其他
4
个碳原子位于
4
个互不相邻的小立方体的中心
(4)
体心和
12
条棱边的中心
(5)Ca
2+
专题一
专题二
专题三
迁移训练
3
下列各物质的晶体中
,
晶体类型相同的是
(
)
A.
金刚砂
(SiC)
、金刚石和金
B.Si
、
SiO
2
和
Na
2
SiO
3
C.
冰、干冰和冰醋酸
D.NaCl
、
MgCl
2
和
AlCl
3
解析
:
金刚砂
(SiC)
、金刚石、晶体硅和
SiO
2
属于原子晶体
,
金属于金属晶体
,Na
2
SiO
3
、
NaCl
和
MgCl
2
属于离子晶体
,AlCl
3
、冰、干冰和冰醋酸均属于分子晶体。
答案
:
C