- 452.00 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
规范演练17
一、选择题
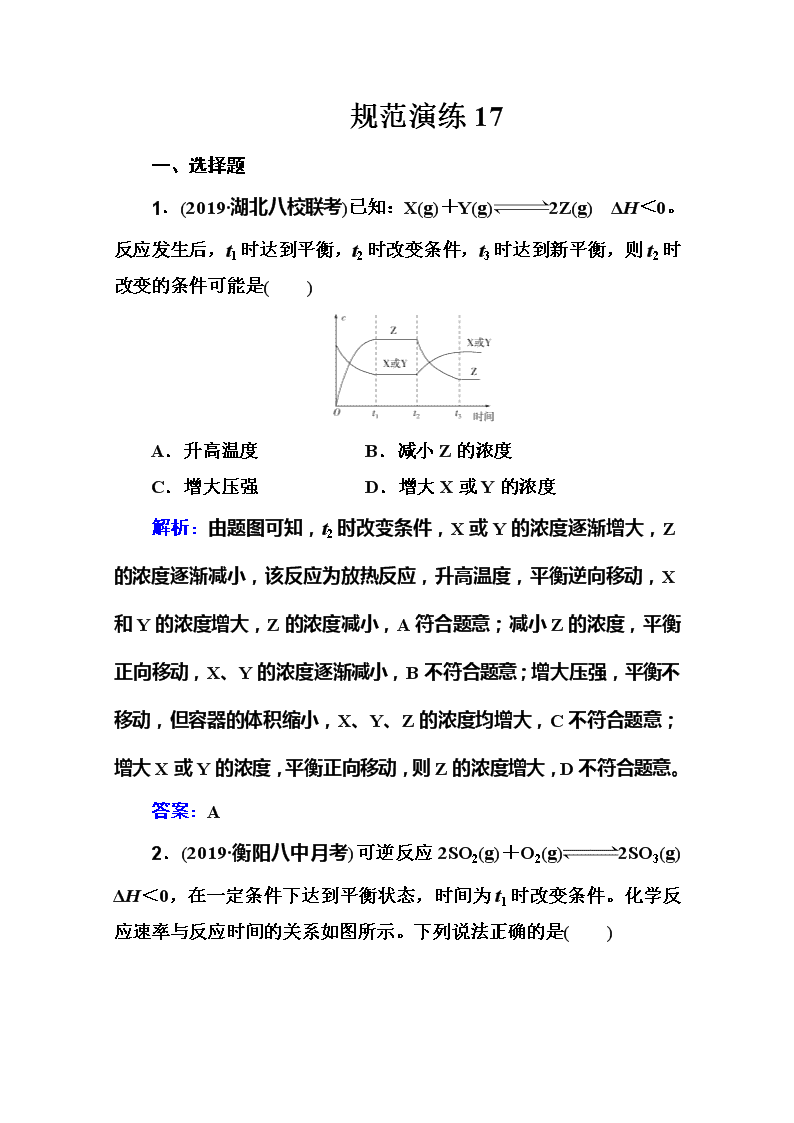
1.(2019·湖北八校联考)已知:X(g)+Y(g)2Z(g) ΔH<0。反应发生后,t1时达到平衡,t2时改变条件,t3时达到新平衡,则t2时改变的条件可能是( )
A.升高温度 B.减小Z的浓度
C.增大压强 D.增大X或Y的浓度
解析:由题图可知,t2时改变条件,X或Y的浓度逐渐增大,Z的浓度逐渐减小,该反应为放热反应,升高温度,平衡逆向移动,X和Y的浓度增大,Z的浓度减小,A符合题意;减小Z的浓度,平衡正向移动,X、Y的浓度逐渐减小,B不符合题意;增大压强,平衡不移动,但容器的体积缩小,X、Y、Z的浓度均增大,C不符合题意;增大X或Y的浓度,平衡正向移动,则Z的浓度增大,D不符合题意。
答案:A
2.(2019·衡阳八中月考)可逆反应2SO2(g)+O2(g)2SO3(g) ΔH<0,在一定条件下达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如图所示。下列说法正确的是( )
A.维持温度、容积不变,t1时充入SO3(g)
B.维持压强不变,t1时升高反应体系温度
C.维持温度、容积不变,t1时充入一定量Ar
D.维持温度、压强不变,t1时充入SO3(g)
解析:维持温度、容积不变,t1时充入SO3(g),此时正、逆反应速率均增大,A项错误;维持压强不变,t1时升高反应体系温度,正、逆反应速率都增大,平衡逆向移动,B项错误;维持温度、容积不变,t1时充入一定量Ar,正、逆反应速率都不变,C项错误;维持温度、压强不变,t1时充入SO3(g),该时刻反应物的浓度均减小,生成物的浓度增大,则逆反应速率增大,正反应速率减小,D项正确。
答案:D
3.(2019·北京市海淀区调考)已知:2SO2(g)+O2(g)2SO3(g) ΔH<0,向某体积恒定的密闭容器中按体积比2∶1充入SO2和O2,在一定条件下发生反应。如图是某物理量(Y)随时间(t)变化的示意图(图中T表示温度),Y可以是( )
A.O2的体积分数 B.混合气体的密度
C.密闭容器内的压强 D.SO2的转化率
解析:由题图可知,温度T2达到平衡所用时间短,反应速率较大,所以温度T2>T1,温度升高,Y表示的物理量降低,该反应正反应为放热反应,升高温度平衡向逆反应方向移动,氧气的体积分数增大,A错误;升温平衡向逆反应方向移动,但混合气体的总质量不变,容器的体积不变,混合气体的密度不变,B错误;升温平衡向逆反应方向移动,混合气体的总的物质的量增大,容器的体积不变,容器的压强增大,C错误;升温平衡向逆反应方向移动,SO2的转化率降低,D
正确。
答案:D
4.(2019·佛山南海中学月考)在密闭容器中进行反应:A(g)+3B(g)2C(g),下列有关图象的说法不正确的是( )
A.依据图a可判断正反应为放热反应
B.在图b中,虚线可表示使用了催化剂时的变化情况
C.若ΔH<0,图c可表示升高温度使平衡向逆反应方向移动
D.由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应吸热
解析:根据图a曲线可知,温度越高,逆反应速率越大,故升高温度平衡逆向移动,正反应为放热反应,A项正确;催化剂能加快反应速率,缩短达到平衡所用的时间,但不能使平衡发生移动,B项正确;升高温度,平衡向吸热方向移动,C项正确;根据图象曲线可知,温度越高,混合气体的平均相对分子质量减小,故升高温度平衡逆向移动,因此可判断正反应为放热反应,D项错误。
答案:D
5.已知某密闭容器中存在下列平衡:CO(g)+H2O(g)CO2(g)+H2(g),CO2的平衡物质的量浓度c(CO2)与温度T的关系如图所示。下列说法错误的是( )
A.平衡状态a点与c点相比,平衡状态a点的c(CO)较小
B.在T2时,d点的反应速率:v逆>v正
C.反应CO(g)+H2O(g)CO2(g)+H2(g)的ΔH>0
D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2
解析:平衡状态a点与c点相比,c点温度高,升高温度,平衡向正反应方向移动,CO浓度减小,所以a点c(CO)较大,故A错误;T2时反应进行到d点,c(CO2)高于平衡浓度,故反应向逆反应方向进行,则一定有v逆>v正,故B正确;由题图可知,温度越高平衡时c(CO2)越大,说明升高温度,平衡向正反应方向移动,即ΔH>0,故C正确;该反应正反应是吸热反应,升高温度平衡向正反应方向移动,化学平衡常数增大,则K1v逆,若A
的物质的量减少0.03 mol时,容器与外界的热交换总量为a kJ,写出反应的热化学方程式:_______________________________________________
____________________________________________________。
(3)图乙中t3时改变的某一反应条件可能是__________(填字母)。
a.使用催化剂 b.增大压强 c.增大反应物浓度
(4)在恒温恒压下通入惰性气体,v正________v逆(填“>”“=”或“<”)。
解析:(1)t4时,减小压强v正、v逆以同等倍数下降,说明反应前后气体体积不变,由A、C浓度变化曲线知,到t1时,A、C的浓度变化量分别为Δc(A)=0.15 mol·L-1-0.06 mol·L-1=0.09 mol·L-1,Δc(C)=0.11 mol·L-1-0.05 mol·L-1=0.06 mol·L-1,即A、C的化学计量数之比为0.09∶0.06=3∶2,故反应方程式为3A(g)
2C(g)+B(g),则B的起始浓度为0.05 mol·L-1-0.03 mol·L-1=0.02 mol·L-1。
(2)因升温,v正>v逆,平衡正向移动,故此反应为吸热反应,其热化学方程式为3A(g)2C(g)+B(g) ΔH=+100a kJ·mol-1。
(3)图乙中t3时刻v正、v逆以同等倍数增大,故改变的条件应是增大压强或加入催化剂。
(4)在恒温恒压下充入惰性气体,各组分浓度同倍数减小,相当于减压,因题给反应为等气体体积反应,平衡不移动,故v正=v逆。
答案:(1)0.02 (2)3A(g)2C(g)+B(g) ΔH=+100a kJ·mol-1 (3)ab (4)=
10.(2019·东莞松山湖学校等八校联考)工业合成氨反应为
N2(g)+3H2(g)2NH3(g),对其研究如下:
(1)已知H—H键的键能为436 kJ·mol-1,N—H键的键能为391
kJ·mol-1,N≡N键的键能是945.6 kJ·mol-1,则上述反应的ΔH=____________________。
(2)上述反应的平衡常数K的表达式为___________________
____________________________________________________。
若反应方程式改写为N2(g)+H2(g)NH3(g),在该温度下的平衡常数K1=____________________(用含K的代数式表示)。
(3)在773 K时,分别将2 mol N2和6 mol H2充入一个固定容积为1 L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
t/min
0
5
10
15
20
25
30
n(H2)/mol
6.00
4.50
3.60
3.30
3.03
3.00
3.00
n(NH3)/mol
0
1.00
1.60
1.80
1.98
2.00
2.00
①该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,则此时v正______v逆(填“大于”“小于”或“等于”)。
②由上表中的实验数据计算得到“浓度-时间”的关系可用下图中的曲线表示,表示c(N2)t的曲线是________(填“甲”“乙”或“丙”)。
在此温度下,若起始充入4 mol N2和12 mol H2,则反应刚达到平衡时,表示c(H2)t的曲线上相应的点为________。
解析:(1)根据ΔH=E(反应物的总键能)-E(生成物的总键能),知ΔH=945.6 kJ·mol-1+436 kJ·mol-1×3-391 kJ·mol-1×6=-92.4 kJ·mol-1。
(2)反应:N2(g)+3H2(g)2NH3(g)的平衡常数K=,K1===K。
(3)①该温度下,25 min时反应处于平衡状态,平衡时c(N2)=1 mol·L-1、c(H2)=3 mol·L-1、c(NH3)=2 mol·L-1,则K==。在该温度下,若向同容积的另一容器中投入的N2、H2和NH3的浓度均为3 mol·L-1,则Q===<K,反应向正反应方向进行,故v正大于v逆;②起始充入4 mol N2和12 mol H2,相当于将充入2 mol N2和6 mol H2的两个容器“压缩”为一个容器,假设平衡不移动,则平衡时c(H2)=6 mol·L-1,而“压缩”后压强增大,反应速率加快,平衡正向移动,故平衡时3 mol·L-1<c(H2)<6 mol·L-1,且达到平衡的时间缩短,故对应的点为B。
答案:(1)-92.4 kJ·mol-1 (2)K= K(或) (3)①大于 ②乙 B
11.(2019·河南信阳一中检测)氨是一种重要的化工原料,在工农业生产中有广泛的应用。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:
N2(g)+3H2(g)2NH3(g)。该可逆反应达到平衡的标志是________(填字母)。
A.3v正(H2)=2v逆(NH3)
B.单位时间生成m mol N2的同时生成3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
(2)工业上可用天然气为原料来制取合成氨的原料气氢气。某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,体积为2 L的恒容密闭容器中测得如下表所示数据。请回答下列问题:
时间/min
CH4/mol
H2O/mol
CO/mol
H2/mol
0
0.40
1.00
0
0
5
a
0.80
c
0.60
7
0.20
b
0.20
d
10
0.21
0.81
0.19
0.64
①分析表中数据,判断5 min时反应是否处于平衡状态?____(填“是”或“否”),前5 min反应的平均反应速率v(CH4)=______________。
②反应在7~10 min内,CO的物质的量减少的原因可能是________(填字母)。
A.减少CH4的物质的量 B.降低温度
C.升高温度 D.充入H2
(3)氨的催化氧化:4NH3+5O2(g)4NO(g)+6H2O(g)是工业制硝酸的重要反应。在1 L密闭容器中充入4 mol NH3(g)和5 mol O2(g),保持其他条件不变,测得c(NO)与温度的关系如图所示。该反应的ΔH________0(填“>”“<”或“=”);T0 ℃下,NH3的转化率为________。
解析:(1)3v逆(NH3)=2v正(H2)时反应达到平衡,A项错误;生成m mol N2,必生成3m mol H2,但反应不一定达到平衡,B项错误;此反应为反应前后气体分子数不相等的反应,压强不变可以说明反应达到平衡状态,C项正确;混合气体总质量不变,容器体积不变,所以混合气体的密度始终不变,故混合气体的密度不变不能说明反应达到平衡状态,D项错误。(2)①根据反应CH4(g)+H2O(g)CO(g)+3H2(g),结合表中数据5 min时H2为0.60 mol,可知CO为0.20 mol,即c=0.20,则a=0.20,7 min时,各物质的物质的量与5 min时相同,所以5 min时反应达到平衡;v(CH4)==0.02 mol·
L-1·min-1。②10 min时,只有CO的物质的量减少,其他物质的物质的量都增加,所以原因只能是充入氢气,使平衡逆向移动,选D。(3)由图象可知,NO的浓度达到最大值后,随温度升高,NO的浓度又逐渐减小,所以该反应的ΔH<0;T0 ℃时,c(NO)=3.0 mol·L-1,则反应消耗的n(NH3)=3.0 mol,NH3的转化率为×100%=75%。
答案:(1)C (2)①是 0.02 mol·L-1·min-1 ②D (3)< 75%
12.(2019·湖北仙桃一中月考)肼(N2H4)与N2O4是火箭发射中最常用的燃料与助燃剂。
(1)800 ℃时,某密闭容器中存在如下反应:2NO2(g)2NO(g)+O2(g) ΔH>0,若开始向容器中加入1 mol·L-1的NO2,反应过程中NO的产率随时间的变化如图中曲线Ⅰ所示。
①反应Ⅱ相对于反应Ⅰ而言,改变的条件可能是_____________
_____________________________________________________。
②请在图中绘制出在其他条件与反应Ⅰ相同,反应在820 ℃时进行,NO的产率随时间的变化曲线。
(2)已知N2O4(g)2NO2(g) ΔH=+57.20 kJ·mol-1,开始时,将一定量的NO2、N2O4充入一个容器为2 L的恒容密闭容器中,浓度随时间变化关系如下表所示:
时间/min
0
5
10
15
20
25
30
c(X)/(mol·L-1)
0.2
c
0.6
0.6
1.0
c1
c1
c(Y)/(mol·L-1)
0.6
c
0.4
0.4
0.4
c2
c2
①c(X)代表________(填化学式)的浓度。
②前10 min内用NO2表示的反应速率为__________;20 min时改变的条件是__________________________;重新达到平衡时,NO2的百分含量________(填字母)。
a.增大 b.减小 c.不变 d.无法判断
解析:(1)①由于Ⅱ达到平衡时产率与Ⅰ
相同但所用时间减少,故改变的条件是使用催化剂;②温度升高,反应速率增大且有利于平衡正向移动,因此达到平衡所用时间比Ⅰ少但比Ⅱ多,NO的产率高于0.6。(2)①由表中数据知,X代表的物质浓度增加值是Y代表的物质浓度减小值的二倍,故X代表NO2,Y代表N2O4;②0~10 min内,NO2浓度增加了0.4 mol·L-1,故v(NO2)=0.04 mol·L-1·min-1;20 min时,NO2浓度增大而N2O4浓度不变,故改变的条件是向容器中加入0.8 mol NO2;由于温度保持不变,故K是定值,将平衡常数表达式变换为=,由于c(NO2)肯定增大,故减小,故减小,所以混合物中NO2百分含量减小。
答案:(1)①使用催化剂
②
(2)①NO2 ②0.04 mol·L-1·min-1 向容器中加入0.8 mol NO2(其他合理答案也可) b