- 230.50 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时作业8 化学反应速率
基础巩固
1.在2A+B3C+4D中,表示该反应速率最快的是( )
A.v(A)=0.5 mol·L-1·s-1
B.v(B)=0.3 mol·L-1·s-1
C.v(C)=0.8 mol·L-1·s-1
D.v(D)=1 mol·L-1·s-1
解析:==0.25 mol·L-1·s-1,=0.3 mol·L-1·s-1,=mol·L-1·s-1,==0.25 mol·L-1·s-1,可知v(B)=0.3 mol·L-1·s-1反应速率最大,选B项。
答案:B
2.已知某反应aA(g)+bB(g)cC(g)的各物质浓度数据如下:
A
B
C
起始浓度(mol/L)
3.0
1.0
0
2 s末浓度(mol/L)
1.8
0.6
0.8
据此可推算出上述方程式中各物质的化学计量数之比是( )
A.9∶3∶4 B.3∶1∶2
C.2∶1∶3 D.3∶2∶1
解析:v(A)==0.6 mol/(L·s),v(B)==0.2 mol/(L·s),v(C)==0.4 mol/(L·s),则可知方程式中A、B、C各物质的化学计量数之比为3∶1∶2,故选B项。
答案:B
3.反应3Fe(s)+4H2O(g)Fe3O4(s)+4H2(g)在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.保持容积不变,增加H2O(g)的物质的量
B.将容器的容积缩小一半
10
C.保持容积不变,充入Ar使压强增大
D.保持压强不变,充入Ar使容积增大
解析:A项,增加H2O(g)的量,反应物浓度越大,化学反应速率越快,错误;B项,将容器的容积缩小一半,反应物的浓度增大,化学反应速率加快,错误;C项,保持容积不变,充入Ar,Ar不参与反应,反应体系中各物质的浓度不变,反应速率不变,正确;D项,保持压强不变,充入Ar,容器的容积变大,反应物的浓度减小,反应速率减小,错误。
答案:C
4.(2019年双鸭山市一中月考)对于反应COCl2(g)CO(g)+Cl2(g)。改变下列条件:①升温;②恒容下通入惰性气体;③增加COCl2浓度;④减压;⑤加催化剂;⑥恒压下通入惰性气体,能加快反应速率的是( )
A.①②⑤ B.①③⑤
C.②④⑥ D.③⑤⑥
解析:①升温,③增加COCl2浓度,⑤加催化剂均能加快反应速率;②恒容下通入惰性气体,各物质浓度不变,反应速率不变;④减压,反应速率减慢;⑥恒压下通入惰性气体,反应物浓度减小,速率减慢,故选B项。
答案:B
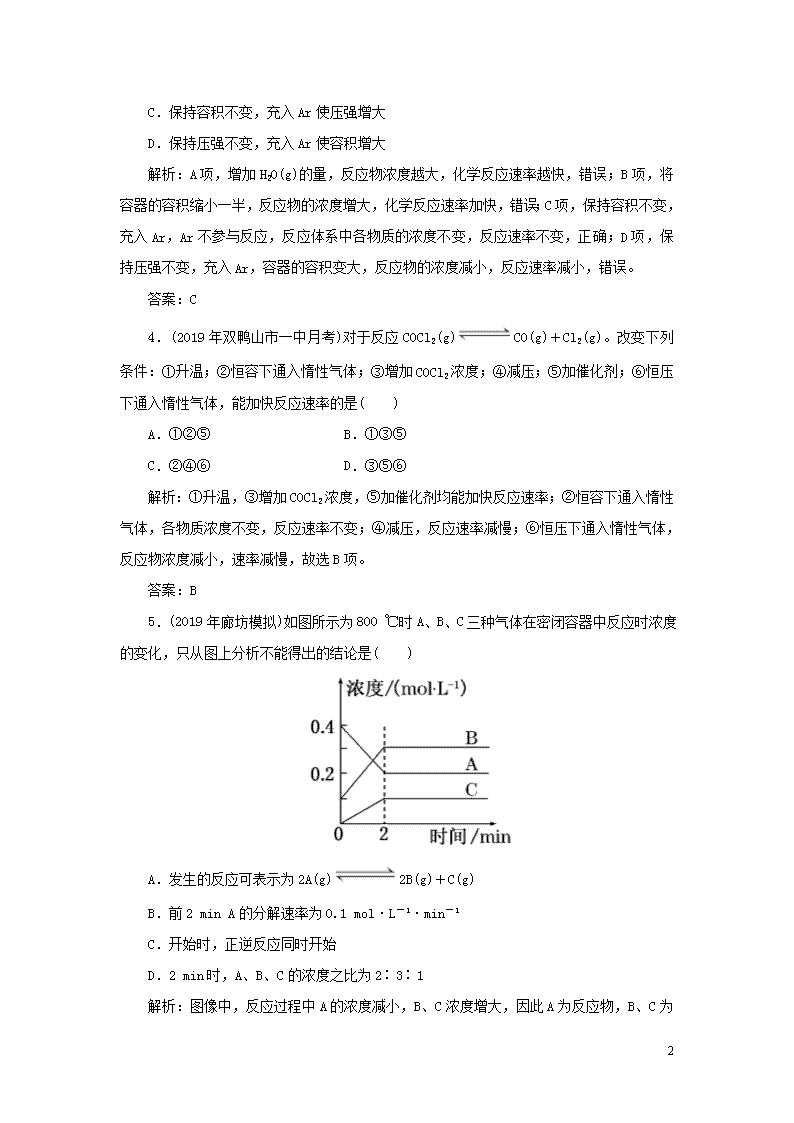
5.(2019年廊坊模拟)如图所示为800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
A.发生的反应可表示为2A(g)2B(g)+C(g)
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C.开始时,正逆反应同时开始
D.2 min时,A、B、C的浓度之比为2∶3∶1
解析:图像中,反应过程中A的浓度减小,B、C浓度增大,因此A为反应物,B
10
、C为生成物,根据浓度的变化量可以确定反应为2A(g)2B(g)+C(g),A正确;前2 min,v(A)==0.1 mol·L-1·min-1,B正确;开始时加入的物质为A和B,没有C,逆反应不能发生,C错误;根据图像,2 min时,A、B、C的浓度分别为0.2 mol·L-1、0.3 mol·L-1、0.1 mol·L-1,D正确。
答案:C
6.下列说法正确的是( )
A.Na与水反应时增大水的用量可加快反应速率
B.Fe与硫酸反应制取H2时,选用浓硫酸可加快反应速率
C.两支试管中分别加入相同浓度的H2O2溶液,其中一支试管中加少量MnO2,两支试管中产生氧气的快慢相同
D.Al在氧气中燃烧生成Al2O3,将铝片改成铝粉燃烧更剧烈
解析:Na与水反应,增加水的用量不能加快反应速率,A项错误;铁遇浓H2SO4发生钝化,B项错误;加入MnO2的试管中,产生O2的速率快,C项错误;铝片改成铝粉,与O2接触面积增大,反应更剧烈,D项正确。
答案:D
7.对于化学反应3W(g)+2X(g)===4Y(g)+3Z(g),下列反应速率关系中,正确的是( )
A.v(W)=3v(Z) B.2v(X)=3v(Z)
C.2v(X)=v(Y) D.3v(W)=2v(X)
解析: 对于同一化学反应用不同物质表示的化学反应速率,反应速率之比等于方程式中相应物质的化学计量数之比。A项,v(W)∶v(Z)=3∶3=1∶1,所以v(W)=v(Z),A项错误;B项,v(X)∶v(Z)=2∶3,所以3v(X)=2v(Z),B项错误;C项,v(X)∶v(Y)=2∶4=1∶2,所以2v(X)=v(Y),C项正确;D项,v(W)∶v(X)=3∶2,所以2v(W)=3v(X),D项错误。
答案:C
8.将4 mol A气体和2 mol B气体在2 L密闭容器中混合并在一定条件下发生反应:2A(g)+B(g)2C(g)。
若经2 s后测得C的浓度为0.6 mol·L-1,则:
(1)用物质A表示的反应速率为________。
(2)2 s时物质B的浓度为______________。
10
(3)2 s时物质A的转化率为____________。
解析:利用三段式法计算:起始A的浓度为
=2 mol/L,
B的浓度为=1 mol/L
2A(g) + B(g)2C(g),
起始浓度:2 mol/L 1 mol/L 0
转化浓度:0.6 mol/L 0.3 mol/L 0.6 mol/L
2s时浓度:1.4 mol/L 0.7 mol/L 0.6 mol/L
v(A)==0.3 mol·L-1·s-1;
c(B)=0.7 mol·L-1;
A的转化率为×100%=30%。
答案:(1)0.3 mol·L-1·s-1 (2)0.7 mol·L-1
(3)30%
能力提升
9.把下列四种X溶液分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,均加水稀释到50 mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A.20 ℃ 30 mL 2 mol·L-1的X溶液
B.10 ℃ 20 mL 3 mol·L-1的X溶液
C.20 ℃ 10 mL 4 mol·L-1的X溶液
D.10 ℃ 10 mL 2 mol·L-1的X溶液
解析:加水稀释到50 mL后,A、B浓度相同,但A比B温度高,A、C温度相同但C的浓度小,D温度低、浓度小,故反应最快的是A。要注意开始时的溶液体积不同,加水均稀释到50 mL,浓度的变化很大。
答案:A
10.(2019年肇庆模拟)某学习小组用铁与稀硫酸反应探究“影响化学反应速率因素”,数据如下表:
10
实验
序号
铁的质
量/g
铁的
形态
V(H2SO4)/
mL
c(H2SO4)/
mol·L-1
反应前溶
液的温度
/℃
金属完全
消失的时
间/s
①
0.10
片状
50
0.8
20
200
②
0.10
粉状
50
0.8
20
25
③
0.10
片状
50
1.0
20
125
④
0.10
片状
50
1.0
35
50
请分析上表信息,下列说法错误的是( )
A.实验①和②表明固体反应物的表面积越大,反应速率越大
B.仅表明反应物浓度对反应速率产生影响的实验有①和③
C.实验③和④表明反应物温度越高,反应速率越小
D.实验③将稀硫酸改为同体积、c(H+)相同的盐酸(其他条件不变),发现放出气泡的速率盐酸明显比硫酸快,其可能的原因是Cl-起催化作用
解析:A项,实验①和②中,其他条件相同,只有铁的状态不同,因此固体反应物的表面积越大,反应速率越大,正确;B项,实验①和③中,其他条件相同,只有c(H2SO4)不同,正确;C项,根据数据,温度越高,金属完全消失的时间越短,反应速率越快,错误;D项,因为其他条件都相同,不同的是SO42-和Cl-,盐酸反应速率快,应是Cl-的催化作用,正确。
答案:C
11.(2019年泉州市永春一中联考)在体积为2 L的密闭容器中充有2 mol SO2和一定量的O2,发生反应2SO2+O22SO3。当反应进行到4 min时,测得此时SO2为0.4 mol,那么反应进行到2 min时,密闭容器中SO2物质的量是( )
A.小于1.2 mol B.1.2 mol
C.大于1.6 mol D.1.6 mol
解析:当反应进行到4 min时,二氧化硫的平均反应速率为v===0.2 mol/(L·min),按照此反应速率,2 min时消耗的二氧化硫的物质的量为n(SO2)=2 min×2 L×0.2 mol/(L·min)=0.8 mol,由于浓度越大,反应速率越快,2 min
10
内二氧化硫的浓度大于4 min内的浓度,所以2 min时消耗的二氧化硫的物质的量大于0.8 mol,反应进行到2 min时,密闭容器中SO2物质的量小于(2 mol-0.8 mol)=1.2 mol,故选A项。
答案:A
12.下列表格中的各种情况,可以用下面对应选项中的图像曲线表示的是( )
选项
反应
甲
乙
A
外形、大小相近的金属和水反应
Na
K
B
4 mL 0.01 mol·L-1的KMnO4溶液,分别和不同浓度的H2C2O4(草酸)溶液2 mL反应
0.1 mol·L-1
的H2C2O4溶液
0.2 mol·L-1
的H2C2O4溶液
C
5 mL 0.1 mol·L-1 Na2S2O3溶液和5 mL 0.1 mol·L-1 H2SO4溶液反应
热水
冷水
D
5 mL 4%的过氧化氢溶液分解放出O2
无MnO2粉末
加MnO2粉末
10
解析:由于K比Na活泼,故相同大小的金属K和Na与水反应,K的反应速率快,故A图像错误;由于起始时乙中H2C2O4浓度大,故其反应速率比甲中快,B图像错误;由于甲反应是在热水中反应,温度高,故甲的反应速率高于乙的,随反应进行,反应物浓度逐渐减小,故甲、乙中反应速率逐渐减小,C图像正确;MnO2在H2O2分解过程中起催化作用,故乙中反应速率大于甲中,D图像错误。
答案:C
13.把除去氧化膜的镁条投入到盛有少量稀盐酸的试管中,发现氢气发生的速率变化情况如图所示。其中t1~t2速率变化的主要原因是__________________________;t2~t3速率变化的主要原因是____________________________________________。
解析:Mg与HCl溶液的反应是放热反应,该反应中并存两个影响化学反应速率的外因:一是反应放出的热能使反应体系温度升高,化学反应速率增大;二是反应使HCl物质的量浓度减小,化学反应速率减小。由图像可知,在t1~t2的时间内温度变化是影响化学反应速率的主要外因,在t2~t3的时间内,HCl物质的量浓度的变化是影响化学反应速率的主要外因。
答案:反应是放热反应,温度升高使化学反应速率升高 HCl物质的量浓度变小使化学反应速率降低
14.在25℃时,向100 mL含氯化氢14.6 g的盐酸溶液里放入5.60 g纯铁粉(不考虑反应前后溶液的体积变化),反应开始至2 min末,收集到1.12 L(标准状况)H2,在此之后,又经过4 min铁粉完全溶解。则:
(1)在前2 min内,用FeCl2表示的平均反应速率是______________。
(2)在后4 min内,用HCl表示的平均反应速率是______________。
(3)前2min与后4min相比,反应速率________较快,其原因是______________。
10
解析:(1)n(Fe)==0.100 mol,n(H2)==0.050 0 mol, n(HCl)==0.400 mol,反应开始至2 min末,铁粉没有反应完全,由方程式Fe+2HCl===FeCl2+H2↑可知,n(Fe)=n(FeCl2)=n(H2)=0.050 0 mol,反应剩余的铁的物质的量为n′(Fe)=0.100 mol-0.050 0 mol=0.050 0 mol,v(FeCl2)==0.250 mol·L-1·min-1。
(2) (3)后4 min内,铁粉完全溶解,反应的HCl的物质的量为:
n(HCl)=2n′(Fe)=2×0.050 0 mol=0.100 mol,
v(HCl)==0.250 mol·L-1·min-1,
此时v′(FeCl2)=v(HCl)
=×0.250 mol·L-1·min-1
=0.125 mol·L-1·min-1,
因为0.125 mol·L-1·min-1<0.250 mol·L-1·min-1,所以前2 min的反应速率更快。(或因为随着反应的进行,盐酸的浓度越来越小,所以反应速率越来越幔,即前2 min的反应速率更快。)
答案:(1)0.250 mol/(L·min) (2)0.250 mol/(L·min)
(3)前2 min 随着反应的进行,盐酸的浓度逐渐减小,故反应速率在后4 min较慢
探究创新
15.下列说法中正确的是( )
A.0.1 mol·L-1HCl和0.1 mol·L-1H2SO4跟2 mol·L-1NaOH溶液反应的速率相同
B.对反应C(s)+O2(g)===CO2(g),增加C的量,对反应速率没有影响
C.Na、Al在相同条件下分别与0.1 mol·L-1盐酸反应,其反应速率相同
D.0.1 mol·L-1盐酸和0.1 mol·L-1硝酸跟Zn反应,生成H2的反应速率相同
解析:A选项H2SO4中的c(H+)是HCl中的c(H+)的2倍,反应速率H2SO4更快;B选项增减固体的量对反应速率没有影响;C选项因为Na比Al活泼,Na与盐酸比Al与盐酸的反应速率快;D选项中HNO3与Zn反应不生成H2。
答案:B
16.在密闭容器中发生下列反应:I2(g)+H2(g)2HI
10
(g)(正反应为吸热反应)。起始时,n(H2)=a mol, n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变填入相应的表格(填“增大”“减小”或“不变”)。
编号
反应条件
对反应速率的影响
(1)
升高温度
(2)
加入催化剂
(3)
再充入a mol H2
(4)
将容器的容积扩大为原来的2倍
(5)
保持容积不变,通入b mol Ne
答案:(1)增大 (2)增大 (3)增大 (4)减小 (5)不变
17.某实验小组以H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响。按照如下方案完成实验。
反应物
催化剂
温度
①
10 mL 10% H2O2溶
无
25 ℃
②
10 mL 20% H2O2溶液
无
25 ℃
③
10 mL 20% H2O2溶
无
40 ℃
④
10 mL 20% H2O2溶液
1~2滴
0.1 mol·L-1
FeCl3溶液
40 ℃
通过实验得到氧气的体积与时间的关系如图所示。
回答下列问题:
(1) 代表实验①的图示是
________________________________________________________________________。
10
(1) 对比实验③和④的目的是
________________________________________________________________________。
(2) 通过上面对比实验,所得出的实验结论是
________________________________________________________________________。
解析:(1)反应温度越高,使用合适的催化剂,反应物浓度越大,反应速率越快,实验①中双氧水浓度最小,没有使用催化剂,温度为25 ℃,则在实验①~④中反应速率最小,图中斜率越大,反应速率越快,则代表实验①的为Ⅳ。
(2)实验③、④中,反应物浓度、反应温度相同,而实验④中使用了催化剂,所以对比实验③和④的目的是研究催化剂对反应速率的影响。
(3)根据实验①、②可知,增大反应物浓度,反应速率加快;根据实验②、③可知,升高反应温度,反应速率加快;根据实验③、④可知,使用合适的催化剂,反应速率加快,通过对比实验,得出的实验结论是其他条件不变,增大反应物浓度或升高温度或加入合适的催化剂,化学反应速率加快。
答案:(1)Ⅳ
(2)研究催化剂对反应速率的影响
(3)其他条件不变,增大反应物浓度或升高温度或加入合适的催化剂,化学反应速率加快
10
相关文档
- 高中化学人教版选修四(课件)第二章 2021-08-066页
- 2018届二轮复习化学反应速率和化学2021-08-0635页
- 2019届高考化学二轮复习第7讲 化2021-08-0667页
- 2020届高考化学二轮复习化学反应速2021-08-0640页
- 2020高中化学 化学反应速率(基础)巩2021-08-064页
- 高中化学 第二章 第二节 第1课时 2021-08-065页
- 2019届一轮复习人教版第七章专题讲2021-08-0613页
- 【推荐】第06周 影响化学反应速率2021-08-0612页
- 2019届二轮复习化学反应速率与化学2021-08-0615页
- 高三化学一轮单元卷:第十单元 化学2021-08-0620页