- 3.22 MB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题七 原子结构 化学键 元素周期律和元素周期表
第
1
课时 原子结构与核外电子排布
[
考试标准
]
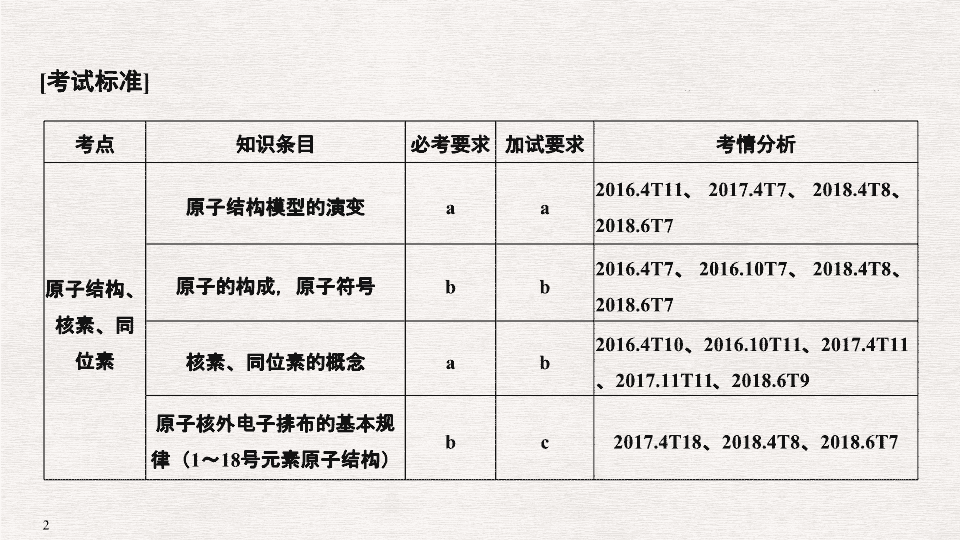
考点
知识条目
必考要求
加试要求
考情分析
原子结构、核素、同位素
原子结构模型的演变
a
a
2016.4T11
、
2017.4T7
、
2018.4T8
、
2018.6T7
原子的构成,原子符号
b
b
2016.4T7
、
2016.10T7
、
2018.4T8
、
2018.6T7
核素、同位素的概念
a
b
2016.4T10
、
2016.10T11
、
2017.4T11
、
2017.11T11
、
2018.6T9
原子核外电子排布的基本规律(
1
~
18
号元素原子结构)
b
c
2017.4T18
、
2018.4T8
、
2018.6T7
考点一:同位素
1.
(
2018·
浙江温州十五校联体)
下列说法正确的是( )
答案
C
考点二:原子结构
2.
(
2017·
浙江湖州高一下)
科学家于
2000
年合成了第
116
号元素(元素符号
Lv
)。有关质量数为
293
的
Lv
原子的描述错误的是( )
答案
D
A.
质子数相等、电子数和原子数不相等:
①
B.
质子数和电子数相等、原子数不相等:
②
C.
电子数相等、质子数和原子数不相等:
③
D.
原子数和电子数相等、质子数不相等:
④
答案
D
考点四:质量数与质子数、中子数的关系
4.
(
2018·
浙江温州十五校联合体)
下列说法中,正确的是( )
解析
A
项为
Pu
元素核内中子数不同的核素,错误;
B
项两种
Bi
的同位素中子数分别为
126
和
127
,错误;
C
项正确;都为硒元素,互为同位素;
D
项水分子质子数为
10
,而铵根离子质子数为
11
,两者电子数均为
10
,错误。
答案
C
考点五:核外电子排布
5.
(
2017·
绍兴诸暨中学)
已知
A
、
B
、
C
、
D
的原子序数都不超过
18
,它们的离子
a
A
(
n
+
1
)+
、
b
B
n
+
、
c
C
(
n
+
1
)-
、
d
D
n
-
具有相同的电子层结构,则下列说法正确的是( )
A.
原子序数:
a
>
b
>
c
>
d
B.
离子半径:
A
(
n
+
1
)+
>
B
n
+
>
C
(
n
+
1
)-
>
D
n
-
C.
离子氧化性:
A
(
n
+
1
)+
>
B
n
+
离子还原性:
C
(
n
+
1
)-
>
D
n
-
D.C
最高价氧化物对应的水化物的酸性比
D
的强
解析
A.
a
A
(
n
+
1
)+
、
b
B
n
+
、
c
C
(
n
+
1
)-
、
d
D
n
-
均具有相同的电子层结构,则有:
a
-
n
-
1
=
b
-
n
=
c
+
n
+
1
=
d
+
n
,则有
A
、
B
在周期表中
C
、
D
的下一周期,并且原子序数:
a
>
b
>
d
>
c
,故
A
错误;
B.
具有相同电子层结构的离子,原子序数大的离子半径小,则离子半径大小为:
C
(
n
+
1
)-
>
D
n
-
>
B
n
+
>
A
(
n
+
1
)+
,故
B
错误;
C.
金属性越强,对应离子的氧化性越弱,非金属性越强,对应离子的还原性越弱,则离子还原性为:
C
(
n
+
1
)-
>
D
n
-
,离子氧化性为
B
n
+
<
A
(
n
+
1
)+
,故
C
正确;
D.
非金属性
D
>
C
,
D
最高价氧化物的水化物对应的酸性比
C
的强,故
D
错误。
答案
C
易错点一 对核素和同位素概念认识不清
1.
同种元素,可以有若干种不同的核素,即核素种类远大于元素种类。
2.
元素有多少种核素,就有多少种原子。
3.
同位素是同一元素不同原子的互相称谓,不指具体原子。
4.
同一元素的不同原子,其质量数不同,核外电子层结构相同,其原子、单质及构成的化合物的化学性质几乎完全相同,只是某些物理性质略有差异。
[
易错训练
1]
(
2018·
浙江金华十校联合体)
下列说法正确的是( )
A.
金刚石、石墨、
C
60
互为同素异形体,它们都是分子晶体
B.
二氧化碳分子和水分子中所有原子在同一条直线上
C.
正丁烷和异丁烷的分子式都为
C
4
H
10
,它们互为同分异构体
D.
14
C
与
14
N
互为同位素
解析
A.
金刚石、石墨、
C
60
互为同素异形体,金刚石为原子晶体,石墨为混合晶体,
C
60
为分子晶体,
A
错误;
B.
二氧化碳分子为直线型分子,水分子为
“
V
”
型分子,原子不在一条直线,
B
错误;
C.
正丁烷和异丁烷的分子式都为
C
4
H
10
,它们互为同分异构体,
C
正确;
D.
14
C
与
14
N
不是同种元素,不属于同位素,
D
错误。正确答案为
C
。
答案
C
易错点二 不能正确理解核外电子排布规律之间关系
1.
核外电子排布的几种规律是相互联系的,不能孤立地理解,必须同时满足各项要求。如
M
层不是最外层时,其最多容纳
18
个电子;当
M
层为最外层时,其最多只能容纳
8
个电子。
2.
每个电子层最多容纳
2
n
2
个电子,但实际容纳的电子数一般小于
2
n
2
。
3.
核外电子排布决定元素的性质,如钠、钾原子最外层电子数相同,处于同主族,在反应中都易失电子,但钾原子的电子层数更多,原子半径更大,失去电子的能力更强,金属性更强。
[
易错训练
2]
(
2018·
浙江省绍兴诸暨中学)
若
a
A
n
+
与
b
B
2
-
两种离子的核外电子层结构相同,则
a
等于( )
A.
b
+
n
-
2 B.
b
+
n
+
2
C.
b
-
n
-
2 D.
b
-
n
+
2
解析
若
a
A
n
+
与
b
B
2
-
两种离子的核外电子层结构相同,则
a
-
n
=
b
+
2
,所以
a
=
n
+
b
+
2
,答案选
B
。
答案
B
易错点三 对原子结构和性质之间的关系掌握不准确
1.
得失电子能力:最外层电子数小于
4
时,一般易失去电子,不易得到电子;最外层电子数大于
4
时,一般易得到电子,不易失去电子。
2.
还原性与氧化性:最外层电子数小于
4
时,一般具有较强的还原性;最外层电子数大于
4
时,一般具有较强的氧化性。
3.
稳定性:最外层如果不是
8
电子结构,一般稳定性较弱;最外层为
8
电子结构,一般稳定性较强。
4.
误认为失电子难的元素原子得电子的能力一定强。忽视了稀有气体元素原子失电子难、得电子也难。
5.
误认为得电子的数目越多,元素的非金属性越强。元素原子得失电子的数目与元素的非金属性、金属性强弱没有必然联系。
[
易错训练
3]
(
2017·
绍兴诸暨中学)
部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是( )
A.
离子半径的大小顺序:
e
>
f
>
g
>
h
B.
与
x
形成简单化合物的沸点:
y
>
z
>
d
C.x
、
z
、
d
三种元素形成的化合物可能含有离子键
D.e
、
f
、
g
、
h
四种元素对应最高价氧化物的水化物相互之间均能发生反应
解析
从图中的化合价、原子半径的大小及原子序数,可知
x
是
H
元素,
y
是
C
元素,
z
是
N
元素,
d
是
O
元素,
e
是
Na
元素,
f
是
Al
元素,
g
是
S
元素,
h
是
Cl
元素。
A.
电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故离子半径:
S
2
-
>
Cl
-
>
Na
+
>
Al
3
+
,故
A
错误;
B.
常温下,水为液体,甲烷、氨气为气体,水的沸点最高,氨气分子之间存在氢键,沸点高于甲烷的,故
B
错误;
C.x
、
z
、
d
三种元素可以形成硝酸铵,属于离子化合物,故
C
正确;
D.e
、
f
、
g
、
h
四种元素对应的最高价氧化物的水化物分别为
NaOH
、
Al
(
OH
)
3
、硫酸、高氯酸,氢氧化铝属于两性氢氧化物,能与强酸、强碱反应,氢氧化钠能与酸反应,但硫酸与高氯酸之间不反应,故
D
错误。
答案
C
易错点四:不能正确地运用核外电子排布推断元素
[
易错训练
4]
(
2016·
浙江理综,
9
)
短周期主族元素
X
、
Y
、
Z
、
W
的原子序数依次增大,
X
原子核外最外层电子数是其电子层数的
2
倍,
X
、
Y
的核电荷数之比为
3
∶
4
。
W
-
的最外层为
8
电子结构。金属单质
Z
在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是( )
A.X
与
Y
能形成多种化合物,一般条件下都能与
Z
的最高价氧化物的水化物发生反应
B.
原子半径大小:
X
<
Y
,
Z
>
W
C.
化合物
Z
2
Y
和
ZWY
3
都只存在离子键
D.Y
、
W
的某些单质或两元素之间形成的某些化合物可作水的消毒剂
解析
据题意得,
X
原子核外最外层电子数是其电子层数的
2
倍,可知
X
为碳元素;
X
、
Y
的核电荷数之比为
3
∶
4
,则
Y
为
8
号元素,应为氧元素;金属单质
Z
在空气中燃烧生成的化合物可与水发生氧化还原反应,则
Z
为钠元素;又
W
-
的最外层为
8
电子结构,结合四种元素原子序数依次增大,故
W
为氯元素。
A
项,碳和氧形成的化合物主要为
CO
、
CO
2
,其中
CO
不能与氢氧化钠反应,错误;
B
项,原子半径:
C
>
O
,
Na
>
Cl
,错误;
C
项,化合物
Na
2
O
中只存在离子键,而
NaClO
3
存在离子键和共价键,错误;
D
项,
O
3
、
Cl
2
、
ClO
2
等可用作水的消毒剂,正确。
答案
D
第
2
课时 化学键 分子间作用力
[
考试标准
]
考点
知识条目
必考要求
加试要求
考情分析
化学键
化学键的含义
a
a
2015.10T15
、
2016.4T20
、
2017.4T20
、
2018.6T19
、
21
离子键、共价键的概念和成因
b
b
2016.4T20
离子化合物、共价化合物的概念
a
a
2016.4T10
、
2016.10T20
、
2017.4T11
、
2018.4T12
简单离子化合物、共价分子的电子式
b
b
2016.4T7
、
2016.10T7
、
2017.4T7
、
2017.11T20
简单共价分子的结构模型、结构式
a
a
2015.10T7
、
2016.10T7
、
2017.4T7
常见离子化合物的形成过程
b
2016.4T20
、
2016.10T20
、
2017.4T20
、
2018.4T19
分子间作用力、氢键
分子间作用力的含义,分子间作用力对由分子构成的物质的某些物理性质的影响
a
b
2016.4T20
、
2016.10T20
、
2017.4T20
、
2018.4
、
6T19
、
2017.11T13
、
20
简单共价分子的空间结构和键能
a
2016.4T20
、
2016.10T20
、
2018.6T20
氢键的概念、形成条件和原因,氢键对物质性质的影响
b
2016.4T20
NaCl
、金刚石、足球烯、干冰、石英中微粒的空间排列方式及相互间作用力
a
a
2015.10T9
、
2016.4T20
、
2016.10T20
、
2017.4T20
、
2018.6T19
离子晶体、分子晶体、原子晶体、金属晶体的形成方式
a
a
2016.10T20
、
2017.4T20
、、
2017.11T20
离子晶体、分子晶体、原子晶体、金属晶体的主要特性
a
2015.10T15
、
2016.4T20
、
2016.10T20
、
2017.4T20
考点一:化学键
1.
(
2017·
浙江嘉兴一中)
下列说法正确的是( )
A.
分子内共价键越强,分子热稳定性越强,其晶体熔沸点越高
B.
干冰和石英晶体中化学键类型相同,熔化需克服的微粒间作用力也相同
C.CO
2
和
PCl
3
分子中每个原子的最外层都具有
8
电子稳定结构
D.
在
Na
2
O
、
NaHSO
4
晶体中,阳离子与阴离子个数比均为
2
∶
1
答案
C
考点二:化学键的变化
2.
判断正误(正确的打
“√”
,错误的打
“×”
)
(
1
)根据电离方程式
HCl===H
+
+
Cl
-
,判断
HCl
分子里存在离子键( )
(
2
)
H
2
分子和
Cl
2
分子的反应过程是
H
2
、
Cl
2
分子里共价键发生断裂生成
H
原子、
Cl
原子,而后
H
原子、
Cl
原子形成共价键的过程( )
(
3
)化学键断裂时一定吸收能量( )
(
4
)化学反应过程中一定有能量变化,自发进行的反应一定释放能量( )
答案
(
1
)
×
(
2
)
√
(
3
)
√
(
4
)
×
考点三:考查如何判断离子化合物、共价化合物
3.
(
2018·
浙江省金华十校联合体)
下列说法正确的是( )
答案
D
考点四:化学键与物质类别的关系
4.
(
2017·
浙江省暨阳联合)
下列说法正确的是( )
A.
碘单质的升华过程中,只需克服分子间作用力
B.NH
4
Cl
属于离子化合物,该物质中只存在离子键
C.
在
N
2
、
CO
2
和
SiO
2
物质中,都存在共价键,它们都是由分子构成
D.
金刚石和足球烯(
C
60
)均为原子晶体
解析
A.
分子晶体的三态变化时只克服分子间作用力,所以碘单质的升华过程中,只需克服分子间作用力,故
A
正确;
B.NH
4
Cl
属于离子化合物,该物质中存在铵根离子与氯离子之间的离子键,又存在氮原子与氢原子之间的共价键,所以不是单一存在离子键,故
B
错误;
C.
二氧化硅是原子晶体,由硅原子和氧原子构成,故
C
错误;
D.
金刚石是原子晶体,而足球烯(
C
60
)是由分子构成的,属于分子晶体,故
D
错误。
答案
A
考点五:物质变化与化学键的关系
5.
(
2018·
浙江温州十五校联合体)
现有
①
BaCl
2
②
金刚石
③
NH
4
Cl
④
Na
2
SO
4
⑤
干冰
⑥
碘等六种物质,按下列要求回答:
(
1
)熔化时不需要破坏化学键的是
,熔点最高的是
。
(
2
)只含有离子键的物质是
,晶体以分子间作用力结合的是
。(以上各空均填写数字编号)
(
3
)
③
的电子式是
。
考点六:粒子间的相互作用力
6.
(
2018·
舟山中学期末)
离子键、共价键和分子间作用力是微粒之间的不同作用力。下列物质中只含有上述一种作用力的是( )
A.
冰
B.
碘单质
C.
氢氧化钠
D.
氯化钠
解析
A.
冰中含共价键、范德华力、氢键三种作用力,故
A
不选;
B.
碘中含共价键、范德华力两种作用力,故
B
不选;
C.NaOH
中含离子键、共价键两种作用力,故
C
不选;
D.
氯化钠中只含离子键一种作用力,故
D
选;故选
D
。
答案
D
考点七:电子式
7.
(
2018·
舟山中学期末)
下列电子式正确的是( )
答案
B
易错点一 不会区分离子键和共价键
离子键
共价键
成键粒子
阴阳离子
原子
成键方式
得失电子形成阴、阳离子
形成共用电子对
成键条件
活泼金属元素与活泼非金属元素
一般在非金属元素原子之间
存在举例
存在于离子化合物中,如
NaCl
、
KCl
、
MgCl
2
、
CaCl
2
、
ZnSO
4
、
NaOH
等
(
1
)非金属单质,如
H
2
、
O
2
等;
(
2
)共价化合物,如
HCl
、
CO
2
、
CH
4
等;
(
3
)某些离子化合物,如
NaOH
、
Na
2
O
2
等
[
易错训练
1]
(
2017·
浙江
“
七彩阳光
”
联盟)
下列说法正确的是( )
A.
氢氧化钠是离子化合物,该物质中只存在离子键
B.
干冰在升华的过程中,只需要克服分子间作用力
C.
12
C
与
13
C
由于核外电子排布不同,所以属于同位素
D.
在
N
2
、
CO
2
和
SiO
2
三种物质中,都存在共价键,它们都是由分子构成的物质
解析
A.
氢氧化钠是离子化合物,该物质中既存在离子键,又存在共价键,故
A
错误;
B.
干冰在升华的过程中,只需要克服分子间作用力,故
B
正确;
C.
12
C
与
13
C
的质子数相同,电子排布相同,但中子数不同,二者属于同位素,故
C
错误;
D.
在
N
2
、
CO
2
和
SiO
2
三种物质中,都存在共价键,
N
2
和
CO
2
是由分子构成的物质,而
SiO
2
是原子构成的物质,故
D
错误;答案为
B
。
答案
B
易错点二 判断物质中化学键类型的常见易错问题
1.
误认为离子化合物中只有离子键,实际上可能还有共价键,如(
NH
4
)
2
SO
4
、
Na
2
O
2
等。
2.
误认为共价化合物中有共价键,也可能有离子键,如
CH
4
、
CO
2
、
H
2
SO
4
等。
3.
误认为单质中只有共价键,如金属单质中没有共价键,稀有气体中没有化学键。
4.
误认为分子中一定都有化学键,如稀有气体是单原子分子。
5.
误认为只有非金属元素形成的化合物一定都是共价化合物,如
NH
4
Cl
中存在离子键。
6.
误认为活泼金属与活泼非金属形成的化合物一定含离子键,如
AlCl
3
为共价化合物。
7.
误认为离子化合物熔融时可以导电,共价化合物熔融时也可能导电。
8.
误认为化学键被破坏的变化一定是化学变化。如
HCl
溶于水、
NaCl
熔化属于物理变化。
[
易错训练
2]
(
2018·
浙江金华十校期末调研)
下列说法不正确的是( )
A.
沸点:
H
2
O>HF
B.
热稳定性
:
HF>H
2
O
C.NCl
3
、
SiCl
4
分子中每个原子最外层均满足
8
电子结构
D.
仅由
N
、
H
、
O
三种元素形成的化合物中不可能含离子键
解析
A.
常温下,水为液体,
HF
为气体,所以沸点:
H
2
O>HF
,
A
正确;
B.F
的非金属性大于
O
的,所以热稳定性:
HF>H
2
O
,
B
正确;
C.NCl
3
中
N
原子最外层有
5
个电子,
3
个
Cl
原子提供
3
个电子,使
N
原子最外层达到
8
电子稳定结构,
N
原子也提供
3
个电子给
3
个
Cl
原子,使每个
Cl
原子最外层达到
8
电子的稳定结构,同样的道理,
SiCl
4
分子中每个原子最外层均满足
8
电子结构,
C
正确;
D.NH
4
NO
3
中既含有离子键又含有共价键,
D
错误。正确答案为
D
。
答案
D
易错点三 不会分析物质变化时引起的作用力的变化
[
易错训练
3]
(
2018·
舟山中学高一期末)
现有下列物质:
①
BaCl
2
②
干冰
③
SiO
2
④
Na
2
O
2
⑤
H
2
O
2
⑥
金刚石
⑦
白磷
⑧
NaOH
,按要求完成下列各题:
(
1
)只由共价键形成的化合物是(填编号,下同)
。
(
2
)属于离子晶体的是
。
(
3
)属于原子晶体的是
。
(
4
)熔化时不需要破坏化学键的是
。
解析
①
氯化钡由阴阳离子构成,是离子化合物,属于离子晶体;
②
干冰由分子构成,是共价化合物,属于分子晶体;
③
二氧化硅由原子构成,是共价化合物,属于原子晶体;
④
过氧化钠由阴阳离子构成,是离子化合物,属于离子晶体;
⑤
双氧水由分子构成,是共价化合物,属于分子晶体;
⑥
金刚石由原子构成,是单质,属于原子晶体;
⑦
白磷由分子构成,是单质,属于分子晶体;
⑧
NaOH
由阴阳离子构成,是离子化合物,属于离子晶体。(
1
)只由共价键形成的化合物是共价化合物,有
②③⑤
;(
2
)属于离子晶体的有
①④⑧
;(
3
)属于原子晶体的有
③⑥
;(
4
)分子晶体熔化时不需要破坏化学键,有
②⑤⑦
。
答案
(
1
)
②③⑤
(
2
)
①④⑧
(
3
)
③⑥
(
4
)
②⑤⑦
易错点四 不能区分氢键、分子间作用力和化学键
化学键、氢键与范德华力的比较(见下表)
化学键
氢键
范德华力
概念
相邻的两个或多个原子间强烈的相互作用
已经与电负性很强的原子形成共价键的氢原子与另一个分子中电负性很强的原子之间的作用力
物质的分子间存在的微弱的相互作用,没有方向性和饱和性
存在
分子内或某些晶体内
分子间(分子内)
分子间
能量
化学键
>
氢键
>
范德华力
对性质的影响
主要影响物质的化学性质
主要影响物质的物理性质(熔点、沸点、密度等)
主要影响物质的物理性质
[
易错训练
4]
(
2018·
杭州高级中学
3
月模拟改编)
下列说法中正确的是( )
A.
氢键是一种较弱的化学键
B.NH
3
的稳定性很强,是因为其分子间能形成氢键
C.
常温下
Cl
2
、
Br
2
、
I
2
的状态从气态、液态到固态,主要原因是分子间作用力逐渐增大
D.
最外层能达到稳定结构的微粒只是稀有气体的原子
解析
本题主要考查化学键和分子间作用力的知识。
A
项,氢键属于分子间的作用力,不属于化学键,错误;
B
项,
NH
3
的稳定性很强的原因是
NH
3
中含有
N—H
共价键的键能大,分子间氢键只影响物质的物理性质,错误;
C
项,同主族元素单质相对分子质量越大,分子间作用力越大,正确;
D
项,阴、阳离子的最外层也能达到稳定结构,错误。
答案
C
易错点五 不能正确书写电子式
电子式书写中的
“
四大误区
”
[
易错训练
5]
(
2017·
浙江金华外国语学校高一期中)
判断正误,并把错误的改正过来。
(
5
)
N
2
的电子式:
N
⋮⋮
N
___________________________________________________________
第
3
课时 元素周期律和元素周期表
[
考试标准
]
考点
知识条目
必考要求
加试要求
考情分析
元素
周期律
元素周期律(核外电子排布、原子半径、元素主要化合价、元素的金属性和非金属性的周期性变化)
b
b
2016.4T14
、
2017.4T14
、
2017.11T13
、
2018.4T11
、
2018.6T12
元素周期表的结构,同主族、同周期元素原子核外电子排布、元素化学性质的递变规律
b
b
2015.10T23
、
2017.4T14
、
2018.4T11
、
2018.6T12
元素
周期表
主族元素在周期表中位置、原子结构、元素性质三者的关系
c
c
2015.10T6
、
2016.4T14
、
2016.10T14
、
2017.4T14
、
2018.4T11
、
2018.6T12
元素周期表的发展史、意义与作用
a
b
2016.4T14
考点一:元素性质的递变规律
1.
(
2017·
浙江绍兴诸暨中学)
短周期元素
A
、
B
、
C
、
D
的原子序数依次递增,它们的原子序数之和为
36
,原子最外层电子数之和为
14
。其中
A
与
C
同主族,
B
与
D
同主族,
A
、
C
原子的最外层电子数之和等于
B
原子的次外层电子数,下列叙述正确的是( )
A.
一定条件下,
B
单质能置换出
D
单质,
C
单质能置换出
A
单质
B.D
元素处于元素周期表中第
3
周期第
Ⅳ
A
族
C.A
、
C
的最高价氧化物均为离子化合物
D.D
的氢化物比
B
的氢化物稳定
解析
由上述分析可知,
A
为
H
,
B
为
O
,
C
为
Na
、
D
为
S
,
A.
因
2H
2
S
+
O
2
===2S
+
2H
2
O
、
2Na
+
2H
2
O===2NaOH
+
H
2
↑
,则一定条件下,
B
单质能置换出
D
单质,
C
单质能置换出
A
单质,故
A
正确;
B.D
为硫元素,处于元素周期表中第
3
周期第
Ⅵ
A
族,故
B
错误;
C.A
为氢元素,对应的最高价氧化物为共价化合物,故
C
错误;
D.
非金属性:
B
>
D
,则
B
的氢化物比
D
的氢化物稳定,故
D
错误。
答案
A
考点二:元素金属性和非金属性的比较
2.
不能作为判断硫、氯两种元素非金属性强弱的依据是( )
A.
单质氧化性的强弱
B.
单质沸点的高低
C.
单质与氢气化合的难易
D.
最高价氧化物对应的水化物酸性的强弱
解析
元素的非金属性越强,其单质获得电子的能力就越强,因此单质氧化性就越强。故可以通过比较单质氧化性的强弱,判断元素的非金属性的强弱,
A
正确。
S
单质,
Cl
2
都是分子晶体,分子之间通过分子间作用力结合,分子间作用力越大,物质的熔、沸点就越高,这与元素的非金属性强弱无关,
B
错误。元素的非金属性越强,其单质与氢气化合形成氢化物就越容易,形成的氢化物的稳定性就越强,因此,可以比较元素的非金属性的强弱,
C
正确。元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强,因此可以通过比较硫、氯两种元素最高价氧化物对应的水化物酸性的强弱比较元素的非金属性的强弱,
D
正确。
答案
B
考点三:微粒半径大小比较
3.
(
2016·
浙江余姚中学高二下期中)
下列各组粒子中粒子半径由大到小的是( )
A.O
、
Cl
、
S
、
P B.Al
3
+
、
Mg
2
+
、
Ca
2
+
、
Ba
2
+
C.K
+
、
Mg
2
+
、
Al
3
+
、
H
+
D.Li
、
Na
、
K
、
Cs
解析
比较粒子半径有以下原则:
①
同周期元素原子半径从左到右逐渐减小,
A
为
P
>
S
>
Cl
>
O
,
②
同主族元素原子半径从上到下逐渐增大,
D
错误;
③
核外电子排布相同时,核电荷数越大,微粒半径越小,
Mg
2
+
>
Al
3
+
,
④
各层排布都饱和,一般电子层数越多,微粒半径越大。故只有
C
正确。
答案
C
考点四:利用
“
元素周期表片断
”
推断
4.
(
2017·
浙江温州十校联合体)
A
、
B
、
C
、
D
、
E
均为短周期主族元素,
B
、
C
、
D
在周期表中的位置关系如图所示。
A
元素的某种同位素原子没有中子,
D
元素的原子序数是
C
的
2
倍,
E
是短周期主族元素中半径最大的元素。下列说法不正确的是( )
A.
简单离子的半径大小关系:
B
>
C
>
E
B.D
、
E
两种元素形成的化合物,可能含有离子键和共价键
C.A
、
B
、
C
三种元素形成的化合物,晶体类型一定相同
D.B
、
D
分别和
C
形成的化合物,都有可能使溴水或品红溶液褪色
B
C
D
解析
A
元素的某种同位素原子没有中子,则
A
为
H
元素,
D
元素的原子序数是
C
的
2
倍,则
C
为
O
元素,
D
为
S
元素,
B
为
N
元素,
E
是短周期主族元素中半径最大的元素,则
E
为
Na
元素。
A.N
3
-
、
O
2
-
、
Na
+
具有相同的电子层结构,质子数越大,离子半径越小,则离子半径:
N
3
-
>
O
2
-
>
Na
+
,即
B
>
C
>
E
,
A
项正确;
B.D
、
E
能形成
Na
2
S
,
Na
2
S
2
等化合物,
Na
2
S
2
含有离子键和共价键,
B
项正确;
C.A
、
B
、
C
三种元素形成的化合物有硝酸、硝酸铵等,硝酸是分子晶体,硝酸铵是离子晶体,晶体类型不相同,
C
项错误;
D.B
、
D
分别和
C
形成的化合物是
NO
2
、
SO
2
,都有可能使溴水或品红溶液褪色,
D
项正确;答案选
C
。
答案
C
考点五:根据结构推断位置、性质
5.
(
2018·
浙江金华十校联合体)
甲~庚等元素在周期表中的相对位置如表,己的最高价氧化物的水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
A.
丙与戊的原子序数相差
25
B.
气态氢化物的稳定性:庚
<
己
<
戊
C.
丁的最高价氧化物可用于制造光导纤维
D.
常温下,甲和乙的单质能与水剧烈反应
解析
己的最高价氧化物的水化物有强脱水性,推出己为
S
,甲原子最外层与最内层具有相同的电子数,即甲为
Mg
,乙为
Ca
,丙为
B
,丁为
Si
,戊为
As
,庚为
F
,
A.B
和
As
原子序数相差
28
,故
A
错误;
B.
非金属性越强,其氢化物越稳定,非金属性强弱顺序是
F
>
S
>
As
,则氢化物的稳定性:
HF
>
H
2
S
>
AsH
3
,故
B
错误;
C.
丁的最高价氧化物为
SiO
2
,
SiO
2
用于制造光导纤维,故
C
正确;
D.
甲为
Mg
,乙为
Ca
,
Mg
与冷水反应缓慢,
Ca
与水反应剧烈,故
D
错误。
答案
C
考点六:利用
“
柱状图
”
推断结构、性质
6.
(
2016·9
月浙江绍兴市适应性试卷,
14
)
如图是部分短周期元素主要化合价与原子序数的关系图,下列说法不正确的是( )
A.X
和
W
位于同一主族
B.
原子半径:
Y
>
Z
>
X
C.
盐
YRX
与化合物
WX
2
的漂白原理相同
D.Y
和
R
两者的最高价氧化物对应的水化物能相互反应
解析
由图可知,原子序数由大到小的元素为
R
、
W
、
Z
、
Y
、
X
;再根据元素的主要化合价可推断
X
为
O
,
Y
为
Na
,
Z
为
Al
,
W
为
S
,
R
为
Cl
。
A
项,
X
(
O
)与
W
(
S
)位于同一主族,正确;
B
项原子半径:
Y
(
Na
)>
Z
(
Al
)>
X
(
O
),正确;
C
项盐
YRX
为
NaClO
,其漂白原理是因为漂白过程中产生具有强氧化性的
HClO
,而
WX
2
(
SO
2
)的漂白性是由于与有颜色的物质发生化合反应生成无色的不稳定的化合物,错误。
答案
C
易错点一 元素性质比较的常见误区
1.
对于主族元素而言,元素的最高正化合价和主族序数相同,但是氟没有正价,氧无最高正价,一般为零价或负价。
2.
误认为最高正价和最低负价绝对值相等的元素只有第
Ⅳ
A
族的某些元素(第
Ⅰ
A
族的
H
的最高正价为+
1
价,最低负价为-
1
价)。
3.
根据元素氧化物对应的水化物的酸碱性的强弱判断元素非金属性或金属性的强弱时,必须是其最高价氧化物对应的水化物。
4.
金属离子的氧化性越强相应金属的金属性越弱。同理非金属离子的还原性越强,相应非金属的非金属性越弱。
[
易错训练
1]
(
2018·
浙江杭州十四中)
右表为元素周期表的一部分,其中
X
、
Y
、
Z
、
W
为短周期元素,
W
元素的核电荷数为
X
元素的
2
倍。下列说法正确的是( )
A.X
、
W
、
Z
元素的原子半径及它们的最简单气态氢化物的热稳定性均依次递增
B.Y
、
Z
、
W
元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C.YX
2
晶体熔化、液态
WX
3
气化均需克服分子间作用力
D.
根据元素周期律,可推测
T
元素的单质具有半导体特性,
T
2
X
3
具有氧化性和还原性
解析
W
元素的核电荷数为
X
元素的
2
倍,所以
X
为氧元素,
W
为硫元素,
Z
为磷元素,
Y
为硅元素,
T
为砷元素。
A.
非金属性越强,其最简单气态氢化物越稳定,
X
、
W
、
Z
的非金属性依次减弱,所以对应最简单气态氢化物热稳定性依次减弱,错误;
B.
硫在自然界中有游离态形式
,错误;
C.
二氧化硅是原子晶体,晶体熔化不需要克服分子间作用力,三氧化硫分子间存在分子间作用力,从液态变成气态,需要克服分子间作用力,错误;
D.
因为砷处于金属和非金属的交界处,所以砷有半导体特性,三氧化二砷中砷是+
3
价,处于中间价有氧化性和还原性,正确。
答案
D
易错点二 不能准确判断元素的化合价
1.
主族元素的最高正价等于主族序数,等于主族元素原子的最外层电子数(
O
、
F
除外)。非金属元素除氢外,均不能形成简单阳离子,金属元素不能形成简单阴离子。
2.
最高正价与最低负价的绝对值之和为
8
,绝对值之差为
0
、
2
、
4
、
6
的主族元素依次位于第
Ⅳ
A
、
Ⅴ
A
、
Ⅵ
A
、
Ⅶ
A
族。
3.
非金属元素的正价一般相差
2
,如氯元素;某些金属元素也符合此规律,如锡、铅元素化合价+
4
,+
2
。
4.
副族元素多数存在变价。
[
易错训练
2]
(
2017·
安吉上墅私立高中)
短周期元素
X
、
Y
、
Z
、
W
在元素周期表中的相对位置如图所示,其中
W
原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
A.
原子半径:
W
>
Z
>
Y
>
X
B.
最高价氧化物对应水化物的酸性:
X
>
W
>
Z
C.
最简单气态氢化物的热稳定性:
Y
>
X
>
W
>
Z
D.
元素
X
、
Z
、
W
的最高化合价分别与其主族序数相等
解析
利用
W
原子的质子数是其最外层电子数的三倍,可以推知
W
为磷元素,则
X
、
Y
、
Z
分别为氮、氧、硅三种元素,
A
项原子半径应为硅>磷>氮>氧,错误;
B
项最高价氧化物对应水化物的酸性:硝酸>磷酸>硅酸,正确;
C
项最简单气态氢化物的热稳定性:水>氨气>磷化氢>硅烷,正确;
D
项氧无最高正价,磷、氮和硅最高化合价分别与其主族序数相等,正确。
答案
A
易错点三 对元素周期表的结构不能烂熟于心
[
易错训练
3]
(
2018·
浙江嘉兴一中)
X
、
Y
、
Z
、
M
、
N
、
W
六种元素在周期表中的位置如图所示,下列说法不正确的是( )
A.
原子半径:
r
(
Z
)>
r
(
M
)>
r
(
Y
)
B.
最高价氧化物对应水化物酸性:
M
>
N
C.N
的单质能与
Z
和
W
形成的化合物发生置换反应
D.X
能与另五种元素形成化合物,且
X
的化合价不完全相同
解析
根据六种元素在周期表中的位置可知,
X
为
H
元素、
Y
为
O
元素、
Z
为
Mg
元素、
M
为
Si
元素、
N
为
Cl
元素、
W
为
Br
元素。
A.
同一周期自左而右,原子半径逐渐减小,同一主族自上而下,原子半径逐渐增大,原子半径:
r
(
Z
)>
r
(
M
)>
r
(
Y
),故
A
正确;
B.
非金属性越弱,则对应的最高价含氧酸的酸性越弱;最高价氧化物对应水化物酸性:
M
<
N
,故
B
错误;
C.
氯气能够与溴化镁发生置换反应生成溴单质,故
C
正确;
D.H
与非金属元素形成的化合物中,
H
一般为+
1
价,而与镁形成的化合物中
H
为-
1
价,故
D
正确;故选
B
。
答案
B
易错点四 不能充分利用元素原子结构、性质等特征推断元素在周期表中的位置
1.
利用元素的原子结构特征确定元素在周期表中的位置
(
1
)周期的确定
①
电子层数=周期序数(
Pd
除外)
②
次外层电子数是
2
的元素在第
2
周期;次外层电子数是
8
的元素在第
3
周期或第
4
周期的
Ⅰ
A
、
Ⅱ
A
族;最外层电子数比次外层电子数多的元素一定位于第
2
周期。
③
某元素阴离子的最外层电子数与次外层电子数相同,该元素位于第
3
周期;若为阳离子,则对应元素位于第
4
周期。
(
2
)主族的确定
①
最外层电子数等于或大于
3
的一定是主族元素。
②
最外层有
1
个或
2
个电子,则可能是
Ⅰ
A
或
Ⅱ
A
族元素,还有可能是副族、
Ⅷ
族或零族元素氦。
③
电子层结构相同的微粒:阴离子对应的元素在具有相同电子层结构的稀有气体的前面,阳离子对应的元素在具有相同电子层结构的稀有气体元素的下一周期的左边位置,简称
“
阴前阳下
”
。
2.
根据元素化合价的特征关系推断位置
(
1
)根据等式确定元素在周期表中的位置:
最高正化合价=最外层电子数=主族序数(
O
、
F
例外)
(
2
)如果已知最低负化合价(或阴离子的符号),则须用等式先求出最高正化合价:
最高正化合价=
8
-
|
最低负化合价
|
,再确定元素在周期表中的位置。
3.
利用元素的特征来推断元素的位置
4.
根据稀有气体的原子序数推断位置
如根据
“
形成化合物最多的元素
”
、
“
空气中含量最多的元素
”
、
“
地壳中含量最多的元素
”
等特征来推断。
各周期最后的元素都是稀有气体元素,熟记这些原子序数,用来推断元素在周期表中的位置。
[
易错训练
4]
(
2018·
嘉兴一中)
1869
年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学发展史上重要里程碑之一。下列有关元素周期表的说法正确的是( )
解析
A.
元素周期表中的
Ⅷ
族包含
8
、
9
、
10
共
3
个纵行,共
18
个纵行,共
16
个族,故
A
错误;
B.
第
7
周期
0
族元素为
118
号,则
116
号元素位于元素周期表中第
7
周期
Ⅵ
A
族,故
B
正确;
C.
第
Ⅱ
A
族元素的原子最外层有
2
个电子,
0
族元素
He
的核外最外层也是
2
个电子,部分副族元素的原子最外层也是
2
个电子,故
C
错误;
D.IA
族的元素包括
H
和碱金属元素,碱金属元素全部是金属元素,
H
是非金属元素,故
D
错误;故选
B
。
答案
B