- 264.50 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
绝密 ★ 启用前 试卷类型A
山东师大附中2016级第七次学分认定考试
化 学 试 卷(理科倾向)
命题人:刘晓华 审核人:杜明成 宋德洋
本试卷分第Ⅰ卷和第Ⅱ卷两部分,共7页,满分为100分,考试用时90分钟。
注意事项:
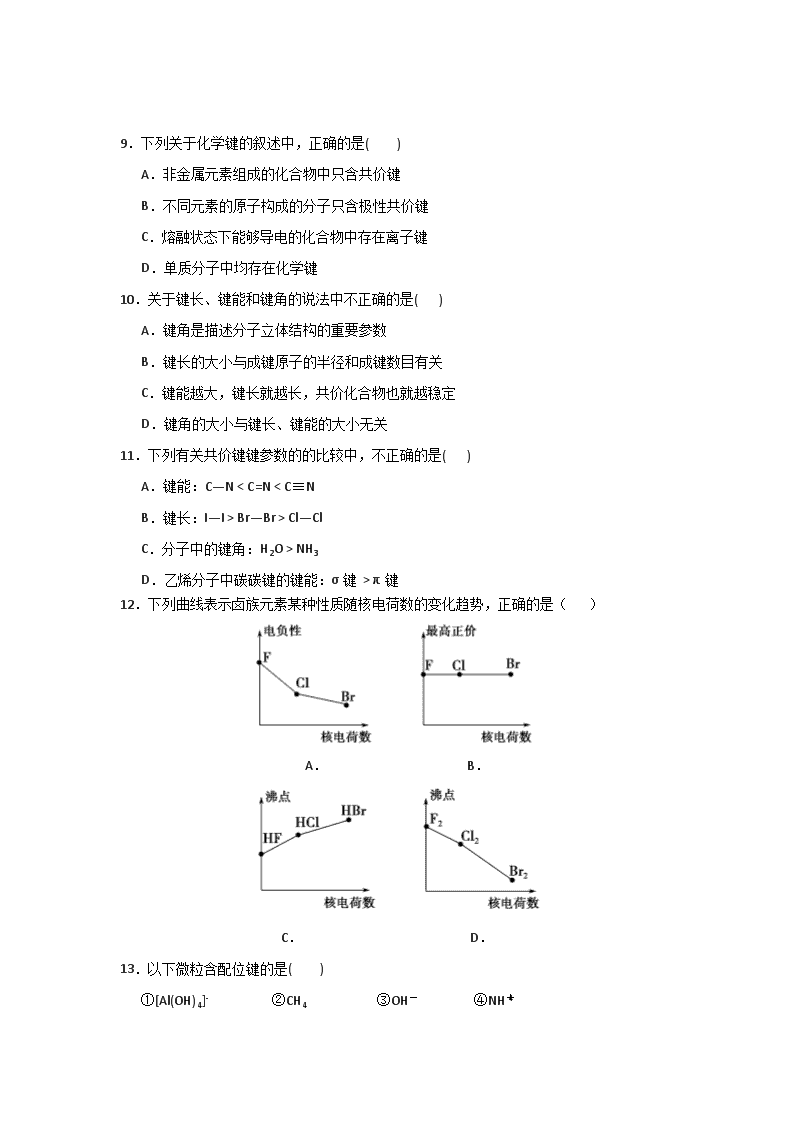
1.答卷前,考生务必用0.5毫米黑色签字笔将自己的姓名、准考证号、考试科目填写在规定的位置上。
2.第Ⅰ卷每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。
3.第Ⅱ卷必须用0.5毫米黑色签字笔作答,答案必须写在答题卡各题目指定区域内相应的位置;如需改动,先划掉原来的答案,然后再写上新的答案,不得使用涂改液,胶带纸、修正带和其他笔。
相对原子质量:H 1 C 12 O 16 Na 23 Mg 24 S 32 Cl 35.5 Fe 56 Cu 64
第Ⅰ卷(必做 共 54 分)
一、选择题(共18小题,每小题3分,共54分。每小题只有一个选项符合题意)
1.下列关于电子层与能级的说法中不正确的是( )
A.各电子层最多可容纳的电子数为2n2
B.任一电子层的能级总是先从s能级开始,且该电子层的能级数等于该电子层序数
C.同是s能级,在不同的电子层中所能容纳的最多电子数是相同的
D.1个原子轨道里最多只能容纳2个电子,且自旋方向相同
2.具有下列电子排布式的原子中,半径最大的是( )
A.1s22s22p63s23p1 B.1s22s22p5
C.1s22s22p63s23p4 D.1s22s22p1
3.某元素原子价电子构型3d54s2,其在周期表中的位置是( )
A.第四周期ⅦA族 B.第四周期ⅡB族
C.第四周期ⅤB族 D.第四周期ⅦB族
4.下表列出了某短周期元素R的各级电离能数据(单位为kJ·mol-1)。下列关于元素R的判断中一定正确的是( )
I1
I2
I3
I4
……
R
577.5
1816.7
2744.8
11577
①R的主要化合价中最高正价为+3价 ②R元素位于元素周期表中第ⅡA族
③R元素第一电离能小于同周期相邻元素 ④R元素基态原子的电子排布式为1s22s22p1
A.①② B.②③ C.③④ D.①③
5.下列有关说法正确的是( )
A.最外层都只有2个电子的X、Y原子,化学性质一定相似
B.在所有的元素中,氟的电负性最大
C.前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有4种
D.次氯酸分子的电子式:
6.下列有关物质性质的变化可以用元素周期律解释的是( )
A.酸性:HCl>H2S>H2O B.密度:Na>K>Li
C.沸点:NH3>AsH3>PH3 D.稳定性:HF>HCl>HBr
7.下图是第3周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )
A.y轴表示的可能是第一电离能
B.y轴表示的可能是电负性
C.y轴表示的可能是原子半径
D.y轴表示的可能是原子形成简单离子转移的电子数
8.X、Y、Z均为第三周期元素,X的第一电离能在同周期中最小,Y的电负性在同周期中最大,Z的离子半径在同周期中最小,下列关于X、Y、Z的叙述不正确的是( )
A.元素Y形成的气态氢化物极易溶于水,水溶液呈强酸性
B.元素Z与元素Y能形成离子化合物
C.元素Z最高价氧化物对应的水化物既能与强酸反应,又能与强碱反应
D.X的简单离子半径小于Y的简单离子半径
9.下列关于化学键的叙述中,正确的是( )
A.非金属元素组成的化合物中只含共价键
B.不同元素的原子构成的分子只含极性共价键
C.熔融状态下能够导电的化合物中存在离子键
D.单质分子中均存在化学键
10.关于键长、键能和键角的说法中不正确的是( )
A.键角是描述分子立体结构的重要参数
B.键长的大小与成键原子的半径和成键数目有关
C.键能越大,键长就越长,共价化合物也就越稳定
D.键角的大小与键长、键能的大小无关
11.下列有关共价键键参数的的比较中,不正确的是( )
A.键能:C—N < C=N < C≡N
B.键长:I—I > Br—Br > Cl—Cl
C.分子中的键角:H2O > NH3
D.乙烯分子中碳碳键的键能:σ键 > π键
12.下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是( )
A. B.
C. D.
13.以下微粒含配位键的是( )
①[Al(OH)4]- ②CH4 ③OH- ④NH
⑤[Cu(NH3)4]2+ ⑥Fe(SCN)3 ⑦H3O+ ⑧[Ag(NH3)2]OH
A.①②④⑦⑧ B.③④⑤⑥⑦ C.①④⑤⑥⑦⑧ D.全部
14.研究表明:H2O2具有立体结构,两个氢原子像在一本半展开的书的两页纸上,两页纸面的夹角为94°,氧原子在书的夹缝上,O—H键与O—O键之间的夹角为97°。下列说法不正确的是( )
A.H2O2分子中既含极性键,又含非极性键
B.H2O2为极性分子
C.H2O2分子中的两个O原子均是sp3杂化
D.H2O2分子中既有σ键,又有π键
15.氨气溶于水时,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2O分子。根据氨水的性质可推知NH3·H2O的结构式为( )
A. B.
C. D.
16.下列描述正确的是( )
A.一个苯分子含3个π键和6个σ键
B.金属的导电性、导热性、延展性都与自由电子有关
C.C2H2分子中σ键与π键的数目比为1∶1
D.水加热到很高温度都难分解是因水分子间存在氢键
17.下列说法中,不正确的是( )
A.X射线衍射实验是区别晶体与非晶体的最科学的方法
B.金属键无方向性,金属晶体中原子尽可能采取紧密堆积
C.凡AB3型的共价化合物,其中心原子A均采用sp2杂化轨道成键
D.乙醇与水互溶可以用“相似相溶”原理和氢键来解释
18.胆矾CuSO4·5H2O可写[Cu(H2O)4]SO4·H2O,其结构示意图如下:
下列有关胆矾的说法正确的是( )
A.所有氧原子都采取sp3杂化 B.氧原子参与形成配位键和氢键两种化学键
C.Cu2+的价电子排布式为3d84s1 D.胆矾中的水在不同温度下会分步失去
第Ⅱ卷(必做 共46分)
二、填空题(共4小题,共46分)
19.(12分)X、Y、Z、W是元素周期表中前36号元素,且原子序数依次增大。其相关信息如下表:
元素编号
元素性质或原子结构
X
X原子的最外层电子数是其内层电子总数的2倍
Y
Y的基态原子价电子排布式为nsnnpn+2
Z
最外层中只有两对成对电子
W
前四周期基态原子中,W元素的未成对电子数最多
(1)元素X最高价氧化物分子的空间构型是 ,是 (填“极性”或“非极性”)分子。
(2)Y的最简单氢化物的沸点比Z的最简单氢化物的沸点高,原因是
(3)基态Z原子中,电子占据的最高电子层符号为 ,该电子层具有的原子轨道数为
(4)元素W位于元素周期表的第________族。
20.(10分) 科学家正在研究温室气体CH4和CO2的转化和利用。请回答下列问题:
(1)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。在基态14C原子中,核外存在 对自旋相反的电子。
(2)CH4和CO2所含的三种元素电负性从小到大的顺序为 。
(3)一定条件下,CH4和CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物俗称“可燃冰”。
参数
分子
分子直径/nm
分子与H2O的结合能E/kJ·mol-1
CH4
0.436
16.40
CO2
0.512
29.91
①下列关于CH4和CO2的说法正确的是________(填序号)。
a.CO2分子中含有2个σ键和2个π键
b.CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d.CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0. 586 nm,根据上述图表所提供的数据分析,提出该设想的依据是
。
21.(12分)硼及其化合物应用广泛。回答下列问题:
(1)基态B原子的价电子轨道表达式为 ,其第一电离能比Be (填“大”或“小”)
(2)氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,分子中存在配位键,提供孤电子对的成键原子是 。
(3)常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如图。
①B原子的杂化方式为 。从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大: 。
② 路易斯酸碱理论认为,任何可接受电子对的分子或离子叫路易斯酸,任何可给出电子对的分子或离子叫路易斯碱。从结构角度分析硼酸是路易斯酸的原因是
。
22.(12分)金属铁及其化合物在合金材料以及催化剂等方面应用广泛。
(1)Fe3+的电子排布式为 。已知,Fe3+的化学性质比Fe2+稳定,请从原子结构的角度进行解释 。
(2)Fe能与CO形成配合物Fe(CO)5,1 mol Fe(CO)5中含有________ mol σ键
(3)与CO互为等电子体的分子和离子分别为_______和_______(各举一种即可,填化学式)
(4)已知某铁晶体的晶胞结构如图所示。
①该晶胞中含有铁原子的数目为 。
②若晶胞的边长为a cm,则晶体铁的密度为 g·cm-3(用代数式表示,阿伏加德罗常数为NA)。
山东师大附中2016级第七次学分认定考试
化 学 试 卷(理科倾向)参考答案
一、选择题(共18小题,每小题3分,共54分。每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
9
10
答案
D
A
D
D
B
D
B
B
C
C
题号
11
12
13
14
15
16
17
18
答案
C
A
C
D
B
B
C
D
二、填空题(共4小题,共46分)
19.(12分)
(1)直线型 非极性 (2)H2O分子间能形成氢键(3)M 9 (4)ⅥB
20.(10分)
(1)电子云 2
(2)H、C、O
(3)①ad ②CO2的分子直径小于笼状空腔直径,且与H2O的结合力大于CH4
21.(12分)
(1) 小
(2)N
(3)①sp2 硼酸分子间通过氢键缔合,加热时,部分氢键被破坏
②硼酸分子中B原子有一个2p空轨道
22.(12分)
(1)1s22s22p63s23p63d5或[Ar]3d5 Fe3+的3d轨道填充了5个电子,为半充满状态
(2)10
(3)N2 CN-(各1份)
(4)①2 ②