- 689.50 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高二上学期期中测试(化学)试题
2017.11
可能用到的原子量:H 1 C12 O 16 Na 23 Cl 35.5
一、选择题(每小题3分,共48分。每小题只有一个选项符合题意)
1. 下列措施不符合节能减排的是 ( )
A.大力发展火力发电,解决电力紧张问题
B.在屋顶安装太阳能热水器为居民提供生活用热水
C.用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D.用杂草、生活垃圾等有机废弃物在沼气中发酵产生沼气,作家庭燃气
2. 判断一个化学反应的自发性常用焓判据和熵判据,则在下列情况下,可以判定反应一定能自发进行的是 ( )
A.ΔH>0,ΔS>0 B.ΔH<0,ΔS<0 C.ΔH>0,ΔS<0 D.ΔH<0,ΔS>0
3. 下列说法正确的是 ( )
A.需要加热的化学反应都是吸热反应
B.中和反应都是放热反应
C.原电池是将电能转化为化学能的一种装置
D、把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速率减慢
4. 下列事实不能用勒夏特列原理解释的是( )
A.溴水中有下列平衡Br2+H2O═HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.合成氨反应(正反应为放热反应),为提高氨的产率,理论上应采取降低温度的措施
C.反应CO(g)+NO2(g)═CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D.对于2HI(g)═H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
5.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )【来源:全,品…中&高*考+网】
A.氢氧燃料电池的负极反应:O2+2H2O+4e-4OH-
B.惰性材料做电极电解饱和食盐水时,阳极的电极反应为:2Cl--2e-Cl2↑
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应为:Cu-2e-Cu2+
D.钢铁发生电化学腐蚀的正极反应:Fe-2e-Fe2
6. 下列关于电解池的叙述中,不正确的是 ( )
A、在电解池的阳极发生氧化反应
B、溶液中的阳离子在阴极上得电子被氧化
C、电子从电源的负极沿导线流向电解池的阴极
D、与电源正极相接的是电解池的阴极
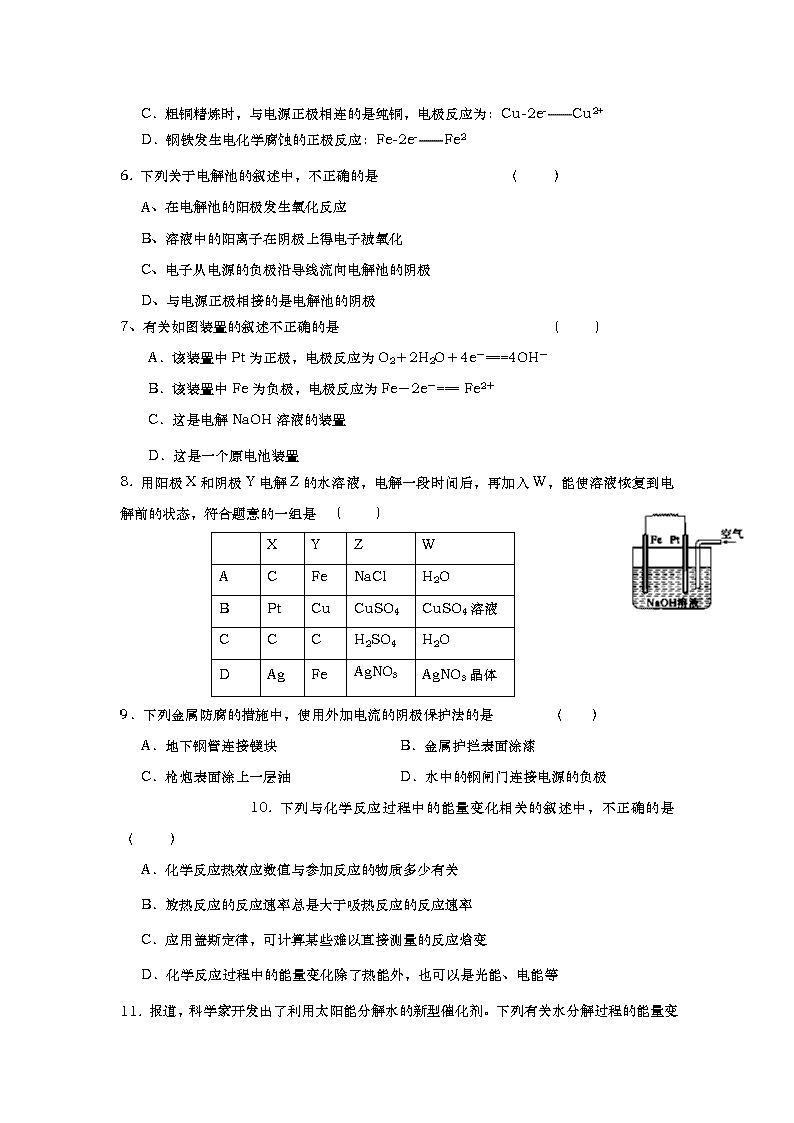
7、有关如图装置的叙述不正确的是 ( )
A.该装置中Pt为正极,电极反应为O2+2H2O+4e-===4OH-
B.该装置中Fe为负极,电极反应为Fe-2e-=== Fe2+
C.这是电解NaOH溶液的装置
D.这是一个原电池装置
8. 用阳极X和阴极Y电解Z的水溶液,电解一段时间后,再加入W,能使溶液恢复到电解前的状态,符合题意的一组是 ( )
X
Y
Z
W
A
C
Fe
NaCl
H2O
B
Pt
Cu
CuSO4
CuSO4溶液
C
C
C
H2SO4
H2O
D
Ag
Fe
AgNO3【来源:全,品…中&高*考+网】
AgNO3晶体
9.下列金属防腐的措施中,使用外加电流的阴极保护法的是 ( )
A.地下钢管连接镁块 B.金属护拦表面涂漆
C.枪炮表面涂上一层油 D.水中的钢闸门连接电源的负极【来源:全,品…中&高*考+网】10. 下列与化学反应过程中的能量变化相关的叙述中,不正确的是 ( )
A.化学反应热效应数值与参加反应的物质多少有关
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.化学反应过程中的能量变化除了热能外,也可以是光能、电能等
11.
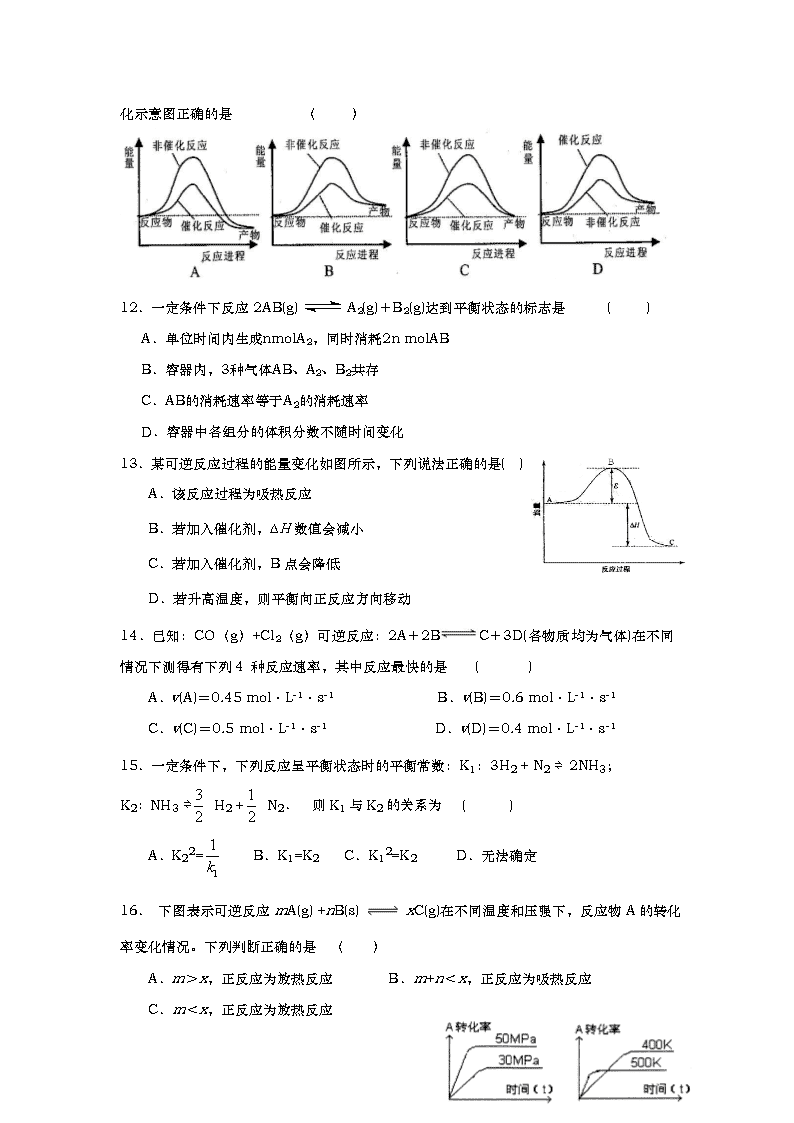
报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是 ( )
12.一定条件下反应2AB(g) A2(g)+B2(g)达到平衡状态的标志是 ( )
A.单位时间内生成nmolA2,同时消耗2n molAB
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
13.某可逆反应过程的能量变化如图所示,下列说法正确的是( )
A.该反应过程为吸热反应
B.若加入催化剂,ΔH数值会减小
C.若加入催化剂,B点会降低
D.若升高温度,则平衡向正反应方向移动
14.已知:CO(g)+Cl2(g)可逆反应:2A+2BC+3D(各物质均为气体)在不同情况下测得有下列4 种反应速率,其中反应最快的是 ( )
A.v(A)=0.45 mol·L-1·s-1 B.v(B)=0.6 mol·L-1·s-1
C.v(C)=0.5 mol·L-1·s-1 D.v(D)=0.4 mol·L-1·s-1
15.一定条件下,下列反应呈平衡状态时的平衡常数:K1:3H2 + N2 ⇌ 2NH3;
K2:NH3 ⇌ H2 + N2. 则K1与K2的关系为 ( )
A.K22= B.K1=K2 C.K12=K2 D.无法确定
16. 下图表示可逆反应mA(g) +nB(s) xC(g)在不同温度和压强下,反应物A的转化率变化情况。下列判断正确的是 ( )
A.m>x,正反应为放热反应 B.m+n<x,正反应为吸热反应
C.m<x,正反应为放热反应【来源:全,品…中&高*考+网】
D.m>x,正反应为吸热反应
二、非选择题(每空2分,共计52分)
17.(10分)
(1)若5.2g乙炔(C2H2气态)完全燃烧生成液态水和CO2(g)时放热260kJ.该反应的热化学方程式为 ;
(2)研究CO2的利用对促进低碳社会的构建具有重要的意义。
(I) 将CO2与焦炭作用生成CO,CO可用于炼铁等。
①已知:Fe2O3(s) + 3C(石墨) =2Fe(s) + 3CO(g) △H 1 =+489 kJ·mol-1
C(石墨) +CO2 (g) =2CO(g) △H 2 = +172 kJ·mol-1
则Fe2O3(s) + 3CO(g) = 2Fe (s) + 3CO2(g) △H= 。
②利用燃烧反应可设计成CO/O2燃料电池(以H2SO4溶液为电解质溶液),写出该电池正极的电极反应式 。
(II)如右图所示,烧杯中都盛有稀硫酸。
(1)中反应的离子方程式为 ; 比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是 (用序号表示) 。
18. (20分) (I) 某学生设计了如图所示的装置(框内部分未画出),在装置内起初发生的反应为Cu+H2SO4=H2↑+CuSO4,试回答:
(1)该装置的名称是 (填“电解池”或“原电池”),是将 能转化为 能的装置。
(2)A、B中至少有一种是金属 (填名称),接电源的 (填“正极”或“负极”)。
(3)写出该装置中发生还原反应的电极反应方程式为 。
(4)若C溶液为100ml饱和食盐水,A 和B电极均为碳棒,该学生利用图示装置进行电解,写出该电解过程中的总反应的离子方程式 ,当放出标况下112ml氢气时,该溶液中C(OH-)= 。(电解过程中溶液体积不变)
(II)利用右图装置,可以模拟铁的电化学防护。
若X为铜,为减缓铁的腐蚀,开关K应置于________ 处。
若X为锌棒,开关K置于M处,该电化学防护法称
为 。
19.(12分)一定条件下,在体积为3 L的密闭容器中反应CO(g)+ 2H2(g) CH3OH(g)达到化学平衡状态。
(1)①该反应的平衡常数表达式为K= 。
②图中曲线对应的平衡常数大小关系为K300 K500(填“大于”、“等于”或“小于”)。
③其它条件不变时,下列措施能提高H2转化率的是 (填字母)。
A.减小CO的浓度 B.降低温度 C.增加H2的浓度 D.增大压强
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__________(用含图中字母的代数式表示)。
(3)判断该可逆反应达到化学平衡状态的标志是__________(填字母)。
A.v消耗(CH3OH)= 2 v消耗(H2) B.CO、H2、CH3OH的浓度均不再变化
C.混合气体的平均相对分子质量不再改变 D.混合气体的密度不再改变
(4)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是__________(填字母)。
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加 D.重新平衡时c(H2)/ c(CH3OH)减小【来源:全,品…中&高*考+网】20.(10分)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
N2(g)+3H2(g)2NH3(g);ΔH=-92.4 kJ/mol
(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
图中t1时引起平衡移动的条件可能是 ,
其中表示平衡混合物中NH3的含量最高的一段时间是 ,
【来源:全,品…中&高*考+网】
(2)若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“ 向右”或“不”);使用催化剂,反应的ΔH (填“增大”、“减小”或“不改变”)。
(3)温度为T ℃时,将2a mol H2和 a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为____________。
高二化学答案
一、选择题(单选题,16×3 = 48分)
1-5 A D B D B 6-10 D C C D B
11-15 B D C C A 16 A
二、非选择题(每空2分,共计52分)
17.(10分)
(1)2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H=﹣2600.0kJ•mol﹣1;
(2)(I) ①-27KJ/mol (不写单位得0分)
② O2 + 4H+ + 4e- = 2H2O
(II)(1) Fe + 2H+= Fe2+ + H2 ↑ ;(气体符号不写不扣分)
(2)>(1)>(3)
18.(20分) (1) 电解池 电 化学
(2) 铜 正极
(3) 2H+ + 2e- = H2↑ (气体符号不写不扣分)
通电
(4) 2Cl- + 2H2O = H2 ↑+ Cl2↑ +2OH- (条件不写扣1分) 0.1mol/L
(II) N 牺牲阳极阴极保护法 (或牺牲阳极保护法)
19. (12分)
(1)① ﹝CH3OH﹞/﹝CO﹞·﹝H2﹞2 ② 大于
③ BD (漏选一个得1分,错选不得分)
(2) 2nB/3tB mol/(L﹒min) (不写单位扣1分)
(3) BC (漏选一个得1分,错选不得分) (4)CD
20.(10分) (1) 增大压强 t2-t3 (2) 向左 不改变 (3) 4/a2