- 923.50 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2018-2019学年度第一学期阶段性检测
高二化学 试题(2018.10)
可能用到的相对原子质量: Ag 108 Cu 64 H 1 Cl 35.5 S 32 O 16
Ⅰ卷 选择题(共48分)
1.电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是( )
A.锌锰干电池工作一段时间后碳棒变细
B.氢氧燃料电池可将热能直接转化为电能
C.氢氧燃料电池工作时氢气在负极被氧化
D.太阳能电池的主要材料是高纯度的二氧化硅
2.1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为( )
A.C + H2O == CO + H2 ; ΔH== +131.3KJ·mol—
B. C(s)+ H2O(g) == CO(g) + H2(g) ; ΔH== +10.94KJ·mol—
C. C(s)+ H2O(l) == CO(g) + H2(g) ; ΔH== +131.3KJ·mol—
D. C(s)+ H2O(g) == CO(g) + H2(g) ; ΔH== +131.3KJ·mol—
3.下列说法错误的是( )
A.需要加热方能发生的反应一定是吸热反应
B.放热的反应在常温下不一定很容易发生
C.反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小
D.吸热反应在一定的条件下也能发生
4.用惰性电极实现电解,下列说法正确的是( )
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1
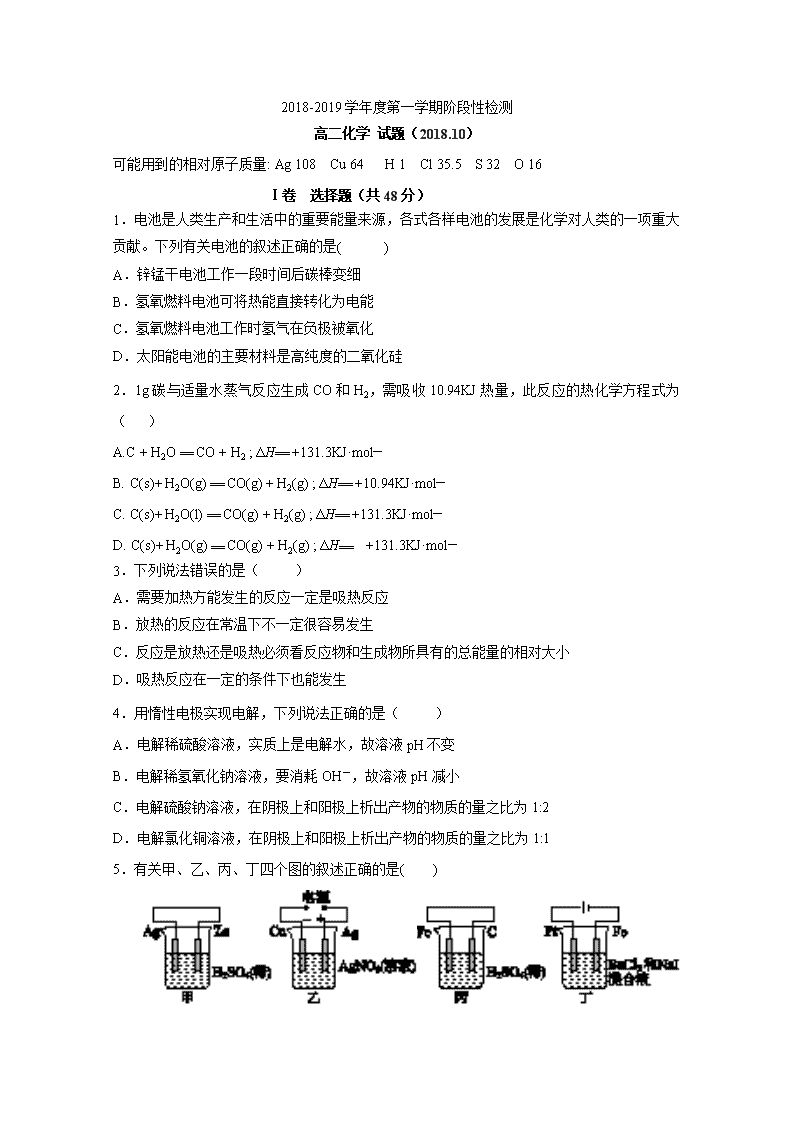
5.有关甲、乙、丙、丁四个图的叙述正确的是( )
A.甲中负极反应式为2H++2e-===H2↑
B.乙中阳极反应式为Ag++e-===Ag
C.丙中H+向碳棒方向移动
D.丁中电解开始时阳极产生黄绿色气体
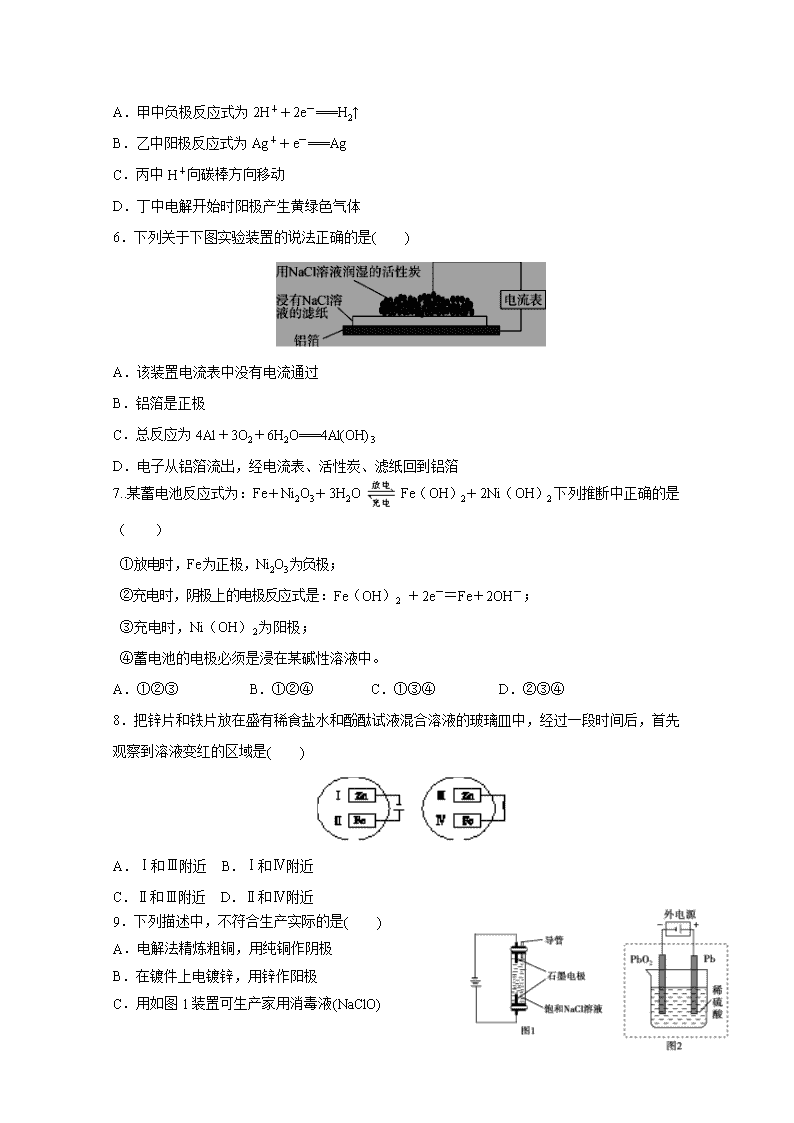
6.下列关于下图实验装置的说法正确的是( )
A.该装置电流表中没有电流通过
B.铝箔是正极
C.总反应为4Al+3O2+6H2O===4Al(OH)3
D.电子从铝箔流出,经电流表、活性炭、滤纸回到铝箔
7..某蓄电池反应式为:Fe+Ni2O3+3H2OFe(OH)2+2Ni(OH)2下列推断中正确的是( )
①放电时,Fe为正极,Ni2O3为负极;
②充电时,阴极上的电极反应式是:Fe(OH)2 +2e-=Fe+2OH-;
③充电时,Ni(OH)2为阳极;
④蓄电池的电极必须是浸在某碱性溶液中。
A.①②③ B.①②④ C.①③④ D.②③④
8.把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中,经过一段时间后,首先观察到溶液变红的区域是( )
A.Ⅰ和Ⅲ附近 B.Ⅰ和Ⅳ附近
C.Ⅱ和Ⅲ附近 D.Ⅱ和Ⅳ附近
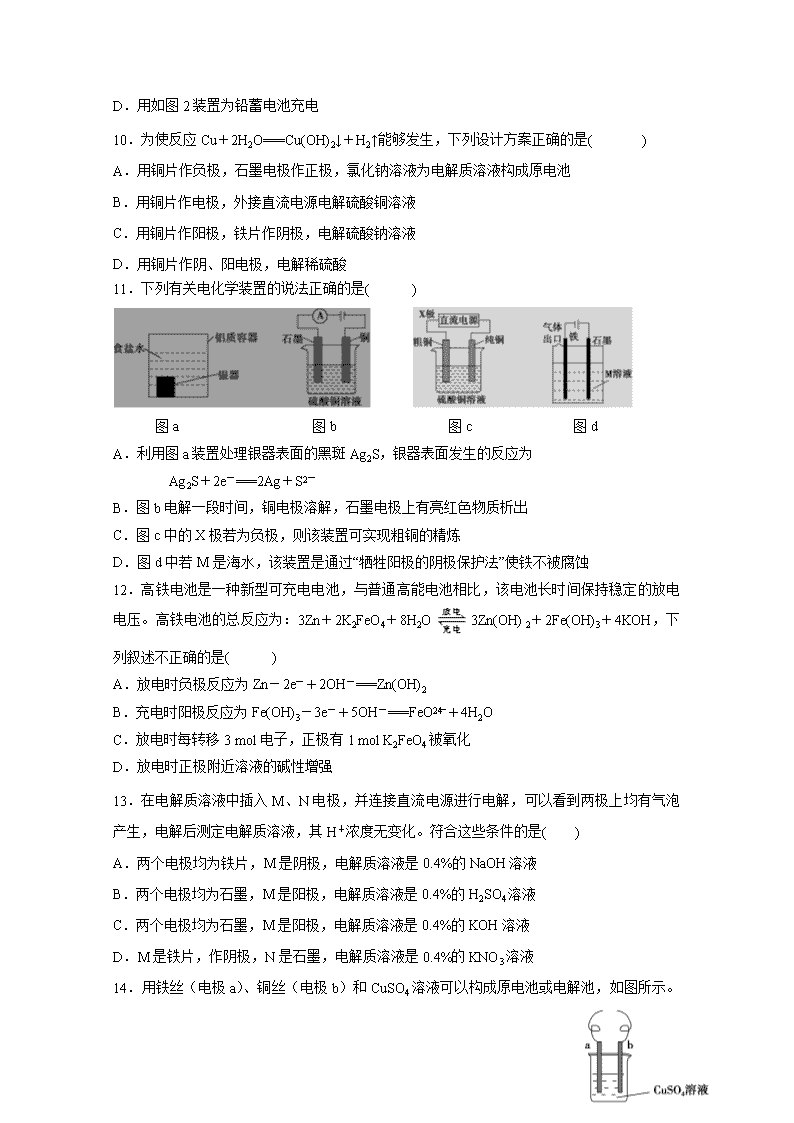
9.下列描述中,不符合生产实际的是( )
A.电解法精炼粗铜,用纯铜作阴极
B.在镀件上电镀锌,用锌作阳极
C.用如图1装置可生产家用消毒液(NaClO)
D.用如图2装置为铅蓄电池充电
10.为使反应Cu+2H2O===Cu(OH)2↓+H2↑能够发生,下列设计方案正确的是( )
A.用铜片作负极,石墨电极作正极,氯化钠溶液为电解质溶液构成原电池
B.用铜片作电极,外接直流电源电解硫酸铜溶液
C.用铜片作阳极,铁片作阴极,电解硫酸钠溶液
D.用铜片作阴、阳电极,电解稀硫酸
11.下列有关电化学装置的说法正确的是( )
图a 图b 图c 图d
A.利用图a装置处理银器表面的黑斑Ag2S,银器表面发生的反应为
Ag2S+2e-===2Ag+S2-
B.图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C.图c中的X极若为负极,则该装置可实现粗铜的精炼
D.图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
12.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O3Zn(OH) 2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A.放电时负极反应为Zn-2e-+2OH-===Zn(OH)2
B.充电时阳极反应为Fe(OH)3-3e-+5OH-===FeO+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
13.在电解质溶液中插入M、N电极,并连接直流电源进行电解,可以看到两极上均有气泡产生,电解后测定电解质溶液,其H+浓度无变化。符合这些条件的是( )
A.两个电极均为铁片,M是阴极,电解质溶液是0.4%的NaOH溶液
B.两个电极均为石墨,M是阳极,电解质溶液是0.4%的H2SO4溶液
C.两个电极均为石墨,M是阳极,电解质溶液是0.4%的KOH溶液
D.M是铁片,作阴极,N是石墨,电解质溶液是0.4%的KNO3溶液
14.用铁丝(电极a)、铜丝(电极b)和CuSO4
溶液可以构成原电池或电解池,如图所示。则下列说法正确的是 ( )。
A.构成原电池时b极反应为Cu-2e-=Cu2+
B.构成电解池时a极质量一定减少
C.构成电解池时b极质量可能减少也可能增加
D.构成的原电池或电解池工作后可能产生大量气体
15.如图所示,将铁棒和石墨棒插入1 L 1 mol·L-1食盐水中。下列说法正确的是( )
A.若电键K与N连接,铁被保护不会腐蚀
B.若电键K与N连接,正极反应式是4OH--4e-===2H2O+O2↑
C.若电键K与M连接,将石墨棒换成铜棒,可实现铁棒上镀铜
D.若电键K与M连接,当两极共产生22.4 L(标准状况)气体时,生成了1 mol NaOH
16.将0.2 mol AgNO3、0.4 mol Cu(NO3)2和0.6 mol KCl溶于水配成100 mL溶液,用惰性电极电解一段时间后,在一极上析出0.3 mol Cu,此时,另一极上的气体体积(标准状况)为 ( )
A.4.48 L B.5.6 L
C.6.7 L D.7.8 L
Ⅱ卷 非选择题(共52分)
17.(1)由氢气和氧气反应生成1mol水蒸气放热241.8KJ,写出该反应的热化学方程式_______________________.若1g水蒸气转化成液态水时放热2.444KJ,则反应H2(g) + 1/2O2(g) == H2O(l)的△H=______________ kJ·。
(2).已知298K时下述反应的实验数据:
N2(g) + 2O2(g) == 2NO2(g) △H1 = + 67.7kJ•mol—1
N2H4(g)+ O2(g) == N2(g)+ 2H2O(g) △H2 = — 534kJ•mol—1
求得此温度下2N2H4(g) + 2NO2(g) == 3N2(g) + 4H2O(g)的反应焓变为 。
18.Ⅰ.某学生利用下面实验装置探究盐桥式原电池的工作原理。
按照实验步骤依次回答下列问题:
(1)导线中电子流向为________(用a、b表示);
(2)写出装置中锌电极上的电极反应式:____________;
(3)若装置中铜电极的质量增加0.64 g,则导线中转移的电子数目为________;
(4)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的K+、Cl-的移动方向表述正确的是________。
A.盐桥中的K+向左侧烧杯移动、Cl-向右烧杯移动
B.盐桥中的K+向右侧烧杯移动、Cl-向左烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动
D.盐桥中的K+、Cl-几乎不移动
Ⅱ.金属腐蚀的电化学原理可用下图模拟。
(1)铁棒上的电极反应式为________________;C棒上的电极反应式为: 该图所表示的是____________ (填“析氢”或“吸氧”)腐蚀。
(2)若将O2撤走,并将NaCl溶液改为稀H2SO4溶液,则此图可表示________(填“析氢”或“吸氧”)腐蚀原理;若用牺牲阳极法来保护铁棒不被腐蚀溶解,即可将碳棒改为________棒。
19.下图是一个电化学过程的示意图。已知甲池的总反应式为
(1)甲池是________装置,乙池是________装置。(填“原电池”或“电解池”)
(2)通入CH4的电极名称是________,B(石墨)电极的名称是___________。
(3)写出电极反应式:通入CH4的电极__________________________。
A(Fe)电极______________________。B(石墨)电极
(4)乙池中反应的化学方程式为___________________________。
20.如图所示为相互串联的甲、乙两电解池。试回答:
甲 乙
(1)若甲池利用电解原理在铁上镀银,则A是________ (填电极名称),电极反应式是____________;B是________(填电极材料),电极反应式是 ___________,应选用的电解质溶液是 ________溶液。
(2)乙池中发生的总反应的离子方程式为 ,若滴入少量酚酞试液,开始电解一段时间,铁极附近呈____色,此时溶液的PH (填“变大”“变小”或“不变”);若要使溶液复原应加
入
(3)若该装置电源为铅蓄电池,电池总反应式为:Pb+PbO2+4 H++2SO42-PbSO4+2H2O,则放电时:正极的电极反应式是______________ ;电解液中H2SO4的浓度将变 ______ ;当外电路通过1 mol电子时,理论上负极板的质量增加 _______g.