- 1.28 MB
- 2021-08-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
西藏自治区昌都市第一高级中学2020届高三下学期第一次模拟考试理综化学
可能用到的相对原子质量:H 1 C 12 N 14 O 16 F 19 Na 23 Al 27
一、选择题:每小题6分,共78分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学与生产生活密切相关,下列有关说法中不正确的是( )
A.酒精能使蛋白质变性,酒精纯度越高杀菌消毒效果越好
B.酸雨以及光化学烟雾的形成通常都与氮的含氧化合物有关
C.传统泡沫灭火器中用的是小苏打和硫酸铝
D.金属焊接前常用NH4Cl溶液处理焊接处
8.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.100 ℃时,1 L pH=6纯水中含H+数目为10−6NA
B.0.1 mol·L−1 Na2CO3溶液中,Na+的数目为0.2NA
C.常温常压下,17 g羟基(—18OH)所含中子数为9NA
D.标准状况下,22.4 L CHCl3中所含C—Cl键的数目为3NA
9.中美元首 G20 峰会确定携手采取积极行动管制芬太尼。芬太尼为一种麻醉、镇痛药物,超剂量使用该药物会导致严重后果,其结构简式如图所示。下列说法正确的是( )
A.芬太尼分子中含有碳碳双键官能团
B.芬太尼分子中所有的碳原子可能共平面
C.芬太尼的一氯取代物有 13 种
D.芬太尼的分子式为 C 22 H 22 N 2 O
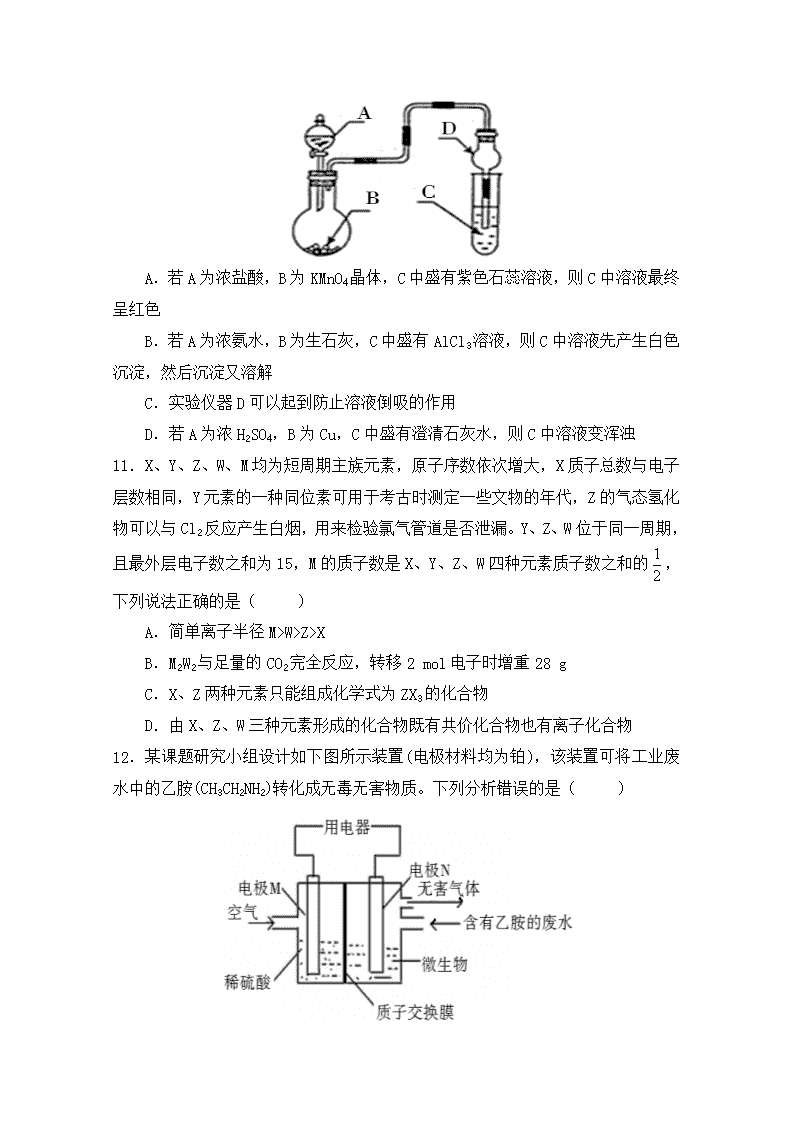
10.用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
A.若A为浓盐酸,B为KMnO4晶体,C中盛有紫色石蕊溶液,则C中溶液最终呈红色
B.若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,则C中溶液先产生白色沉淀,然后沉淀又溶解
C.实验仪器D可以起到防止溶液倒吸的作用
D.若A为浓H2SO4,B为Cu,C中盛有澄清石灰水,则C中溶液变浑浊
11.X、Y、Z、W、M均为短周期主族元素,原子序数依次增大,X质子总数与电子层数相同,Y元素的一种同位素可用于考古时测定一些文物的年代,Z的气态氢化物可以与Cl2反应产生白烟,用来检验氯气管道是否泄漏。Y、Z、W位于同一周期,且最外层电子数之和为15,M的质子数是X、Y、Z、W四种元素质子数之和的,下列说法正确的是( )
A.简单离子半径M>W>Z>X
B.M2W2与足量的CO2完全反应,转移2 mol电子时增重28 g
C.X、Z两种元素只能组成化学式为ZX3的化合物
D.由X、Z、W三种元素形成的化合物既有共价化合物也有离子化合物
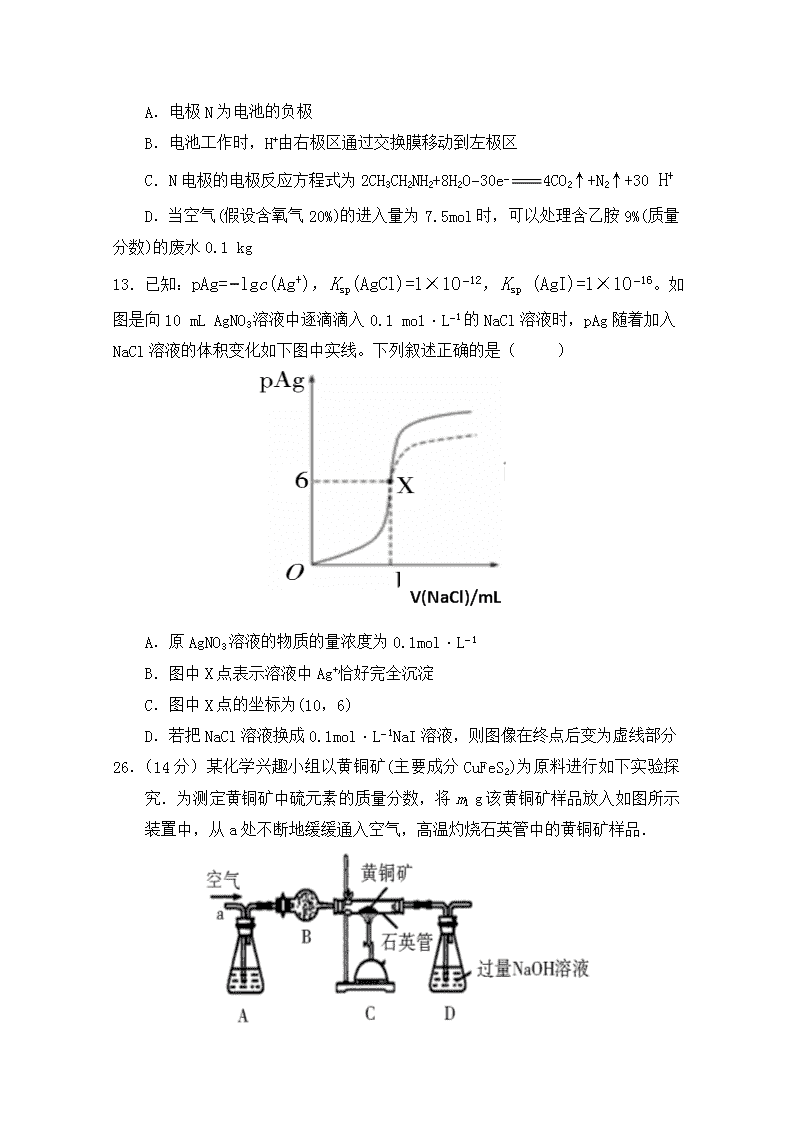
12.某课题研究小组设计如下图所示装置(电极材料均为铂),该装置可将工业废水中的乙胺(CH3CH2NH2)转化成无毒无害物质。下列分析错误的是( )
A.电极N为电池的负极
B.电池工作时,H+由右极区通过交换膜移动到左极区
C.N电极的电极反应方程式为2CH3CH2NH2+8H2O−30e−4CO2↑+N2↑+30 H+
D.当空气(假设含氧气20%)的进入量为7.5 mol时,可以处理含乙胺9%(质量分数)的废水0.1 kg
13.已知:pAg=−lgc(Ag+),Ksp(AgCl)=1×10−12,Ksp (AgI)=1×10−16。如图是向10 mL AgNO3溶液中逐滴滴入0.1 mo1·L−1的NaCl溶液时,pAg随着加入NaCl溶液的体积变化如下图中实线。下列叙述正确的是( )
V(NaCl)/mL
A.原AgNO3溶液的物质的量浓度为0.1mol·L−1
B.图中X点表示溶液中Ag+恰好完全沉淀
C.图中X点的坐标为(10,6)
D.若把NaCl溶液换成0.1mol·L−1NaI溶液,则图像在终点后变为虚线部分
26.(14分)某化学兴趣小组以黄铜矿(主要成分CuFeS2)为原料进行如下实验探究.为测定黄铜矿中硫元素的质量分数,将m1 g该黄铜矿样品放入如图所示装置中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铜矿样品.
(1)锥形瓶A内所盛试剂是__________;装置B的作用是__________;锥形瓶D内发生反应的离子方程式为__________。
(2)反应结束后将锥形瓶D中的溶液进行如下处理:
如图则向锥形瓶D中加入过量H2O2溶液反应的离子方程式为__________;操作Ⅱ是洗涤、烘干、称重,其中洗涤的具体方法__________;该黄铜矿中硫元素的质量分数为_________(用含m1、m2的代数式表示)。
(3)反应后固体经熔炼、煅烧后得到泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO),要验证熔渣中存在FeO,应选用的最佳试剂是__________。
A.KSCN溶液、氯水 B.稀盐酸、KMnO4溶液
C.稀硫酸、KMnO4溶液 D.NaOH溶液
(4)已知:Cu+在强酸性环境中会发生反应生成Cu和Cu2+。设计实验方案验证泡铜中是否含有Cu2O__________。
27.(14分)元素铬(Cr)在自然界主要以+3价和+6价存在。请回答下列问题:
(1)+6价的Cr能引起细胞的突变而对人体不利,可用亚硫酸钠将其还原。离子反应方程式为:3SO32−+Cr2O72−+8H+2Cr3++3SO42−+4H2O,该反应氧化剂和还原剂的物质的量之比为_____。
(2)工业上利用铬铁矿( FeO·Cr2O3)冶炼铬的工艺流程如图所示:
①为加快焙烧速率和提高原料的利用率,可采取的措施之一是___________。
②水浸Ⅰ要获得浸出液的操作是___________。
③浸出液的主要成分为Na2CrO4,加入Na2S反应后有Na2SO4生成,则操作Ⅱ发生反应的离子方程式为___________。
(3)常温下Cr(OH)3的溶度积Ksp=1×10−32,若要使Cr3+完全沉淀,则pH应调为______[c(Cr3+)降至10−5mol·L−1可认为完全沉淀]。
(4)以铬酸钠(Na2CrO4)为原料,用电化学法可制备重铬酸钠(Na2Cr2O7),实验装置如图所示(已知:2CrO42−+2H+Cr2O72−+H2O)。
①阳极的电极反应式为___________。
②电解一段时间后,测得阳极区溶液中Na+物质的量由a mol变为b mol,则生成重铬酸钠的物质的量为___________mol。
28.(15分)CO和H2被称为合成气,用合成气可以合成乙酸。回答下列问题:
(1)已知CO、H2、CH3COOH的燃烧热分别为-283.0kJ/mol、-285.8kJ/mol、-1255.0kJ/mol,则用合成气合成CH3COOH(l)的可逆过程的热化学反应方程式为 ;
(2)在密闭容器中发生合成乙酸的反应,下列可以提高CH3COOH产率的措施有 。
A.恒温恒容,通入少量氦气 B.及时分离出产物乙酸
C.加入高效催化剂 D.压缩容器体积
(3)在150℃时,2L的密闭容器中发生反应:2H2(g)+2CO(g)CH3COOH(g)
ΔH>0,起始通入4molH2和4molCO,CH3COOH蒸汽的浓度数据随时间变化如下表所示:
时刻/min
0
2
4
6
8
c(CH3COOH)/mol/L
0
0.3
0.5
0.6
0.6
①0~2min内用CO表示该反应的速率为 ,随着反应的进行速率逐渐减慢的可能原因是 ;
②150℃时该反应的平衡常数的数值约为 ;(计算结果保留一位小数)
③平衡后再通入1molH2,则CH3COOH(g)的体积分数 ,若再次通入
1molH2和1molCO,则CH3COOH(g)的体积分数 。(填“增大”“减小”或者“不变”)
35.[化学——选修3:物质结构与性质](15分)
铝广泛应用于航空、建筑、汽车等行业,目前工业上采用电解氧化铝和冰晶石(Na3AlF6)混合物的方法制取铝。回答下列问题:
(1)某同学写出了铝原子的4种不同状态的电子排布图:
其中能量最低的是_______(填字母),电子由状态C到状态B所得原子光谱为_______光谱(填“发射”或“吸收”),状态D是铝的某种激发态,但该电子排布图有错误,主要是不符合________。
(2)熔融状态的氯化铝可挥发出二聚分子Al2Cl6,其结构如图所示。
①a键的键能_________b键的键能(填“>”“<”或“=”),其理由是______________________。
②Al2Cl6中铝原子的杂化方式为___________;AlCl3的空间结构为
___________________。
(3)冰晶石属于离子化合物,由Na+和AlF63−组成,在冰晶石的晶胞中,AlF63−占据的位置相当于氯化钠晶胞中Cl−的位置。冰晶石的化学式为___________,一个冰晶石晶胞中Na+的个数为___________。
②已知冰晶石的密度为2.95 g/cm3,则冰晶石晶胞的边长a=___________pm(列出算式即可,阿伏加德罗常数值为6.02×1023)。
36.[化学——选修5:有机化学基础](15分)
H是合成抗炎药洛萦洛芬钠的关键中间体,它的一种合成路线如下:
(1)A的化学名称为___________。
(2)G的分子式为___________;H中官能团的名称是___________。
(3)E的结构简式为___________,反应②的反应类型为___________。
(4)反应⑥的化学方程式为___________。
(5)写出同时满足下列条件的F的同分异构体的结构简式___________。
Ⅰ.能发生水解反应生成酸和醇
Ⅱ.能发生银镜反应
Ⅲ.核磁共振氢谱有5组峰且峰面积之比为3∶2∶2∶2∶1
(6)仿照H的合成线,设计一种由合成的合成路线______________________。
化学答案
选择题: 7-13 AACCDDB
(2分)
(2分)
(2分)
(2分)
(2分)
(2分)
(2分)
(2分)
28.(15分)
(1) 2H2(g)+2CO(g)CH3COOH(l) ΔH=+117.4kJ/mol(3分)
(2) BD(2分)
(3)①0.3mol/(L·min)(2分);
随着反应的进行反应物浓度降低(2分)(其他答案合理亦给分);
②1.5(2分); ③减小(2分); 增大(2分)
(2分)
(2分)
(2分)
(2分)
(2分)
(2分)