- 563.50 KB
- 2021-08-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第八章 水溶液中的离子平衡
[考纲解读] 1.了解电解质的概念。了解强电解质和弱电解质的概念。2.理解电解质在水溶液中的电离,以及电解质溶液的导电性。3.理解弱电解质在水中的电离平衡,能利用电离平衡常数进行相关计算。4.了解水的电离、离子积常数。5.了解溶液pH的含义及其测定方法,能进行pH的简单计算。6.了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。7.了解难溶电解质的沉淀溶解平衡。理解溶度积(Ksp)的含义,能进行相关的计算。
第24讲 弱电解质的电离平衡
1.强、弱电解质
(1)定义与物质类别
(2)与化合物类别的关系
强电解质主要是大部分离子化合物及某些共价化合物,弱电解质主要是某些共价化合物。
(3)电离方程式的书写——“强等号,弱可逆,多元弱酸分步离”
①强电解质:如H2SO4:H2SO4===2H++SO。
②弱电解质:
a.一元弱酸,如CH3COOH:
CH3COOHCH3COO-+H+。
b.多元弱酸,分步分离,电离方程式只写第一步,如H2CO3:
H2CO3H++HCO。
c.多元弱碱,分步电离,一步书写。如Fe(OH)3:
Fe(OH)3Fe3++3OH-。
③酸式盐:
a.强酸的酸式盐
如NaHSO4在水溶液中:NaHSO4===Na++H++SO;熔融时:
NaHSO4===Na++HSO。
b.弱酸的酸式盐:如NaHCO3:
NaHCO3===Na++HCO。
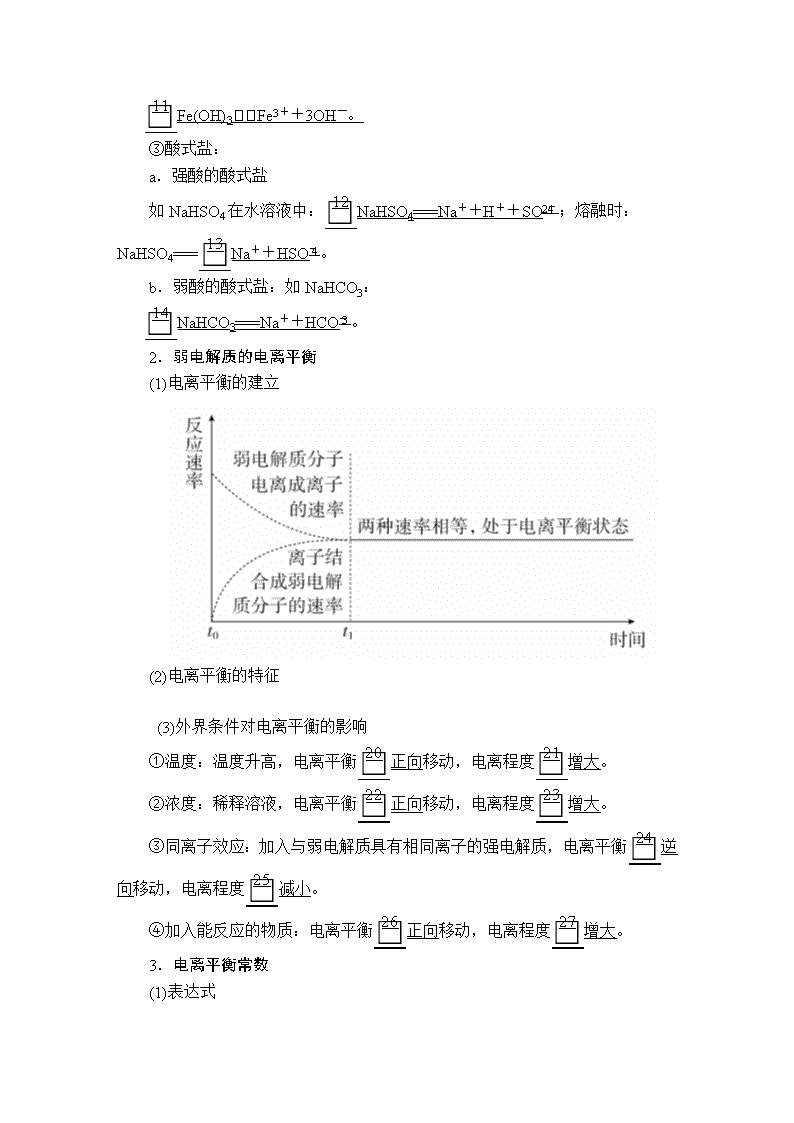
2.弱电解质的电离平衡
(1)电离平衡的建立
(2)电离平衡的特征
(3)外界条件对电离平衡的影响
①温度:温度升高,电离平衡正向移动,电离程度增大。
②浓度:稀释溶液,电离平衡正向移动,电离程度增大。
③同离子效应:加入与弱电解质具有相同离子的强电解质,电离平衡逆向移动,电离程度减小。
④加入能反应的物质:电离平衡正向移动,电离程度增大。
3.电离平衡常数
(1)表达式
①一元弱酸HA的电离常数:根据HAH++A-,可表示为
Ka=。
②一元弱碱BOH的电离常数:根据BOHB++OH-,可表示为
Kb=。
(2)特点
电离常数只与温度有关,与电解质的浓度、酸碱性无关,由于电离过程是吸热的,故温度升高,K增大。多元弱酸是分步电离的,各级电离常数的大小关系是K1≫K2……,所以其酸性主要决定于第一步电离。
(3)意义
相同条件下,K值越大,表示该弱电解质越易电离,所对应的酸性或碱性相对越强。
(4)影响因素
4.电离度
(1)概念:一定条件下,当弱电解质在溶液中达到电离平衡时,溶液中已经电离的电解质分子数占原来弱电解质总分子数的百分数。
(2)表达式:α=×100%。
(3)意义:衡量弱电解质的电离程度,在相同条件下(浓度、温度相同),不同弱电解质的电离度越大,弱电解质的电离程度越大。
1.判断正误,正确的画“√”,错误的画“×”,并指明错因。
(1)稀释氨水时,电离平衡正向移动,c(NH3·H2O)减小,c(NH)增大。(×)
错因:稀释氨水时,c(NH3·H2O)、c(NH)均减小。
(2)由0.1 mol·L-1一元碱BOH的pH=10,可知溶液存在BOH===B++OH-。(×)
错因:0.1 mol·L-1的BOH pH=10,说明其c(OH-)=10-4 mol·L-1,仅极少部分电离,其电离方程式用“”。
(3)0.1 mol·L-1的CH3COOH与0.01 mol·L-1的CH3COOH中,c(H+)之比为10∶1。(×)
错因:加水稀释,电离程度增大,所以0.1_mol·L-1的CH3COOH与0.01_mol·L-1的CH3COOH中c(H+)之比小于10∶1。
(4)H2CO3的电离常数表达式:Ka=。(×)
错因:H2CO3为二元弱酸,分步电离,其中Ka1=,Ka2=。
(5)弱电解质的电离平衡右移,电离平衡常数一定增大。(×)
错因:K仅与温度有关。
(6)电离常数大的酸溶液中的c(H+)一定比电离常数小的酸溶液中的c(H+)大。(×)
错因:酸溶液中的c(H+)除与K值大小有关外,还与酸的浓度有关。
2.教材改编题
(据人教选修四P44 T4)已知25 ℃下,醋酸溶液中存在下述关系:
=1.69×10-5
其中的数值是该温度下醋酸的电离平衡常数。
试回答下述问题:
(1)向上述溶液中加入一定量的NaOH溶液,上述数值将________(填“增大”“减小”或“不变”)。
(2)若醋酸的起始浓度为0.0010 mol/L,平衡时氢离子浓度c(H+)是____________[提示:醋酸的电离常数很小,平衡时的c(CH3COOH)可近似视为仍等于0.0010 mol/L]。
答案 (1)不变 (2)1.3×10-4 mol/L
考点 弱电解质的电离平衡及影响因素
[典例1] (2018·重庆调研)稀氨水中存在着下列平衡:NH3·H2ONH+OH-,若要使平衡向左移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热 ⑥加入少量MgSO4固体
A.①②③⑤ B.③⑥
C.③ D.③⑤
解析 若在氨水中加入NH4Cl固体,c(NH)增大,平衡向逆反应方向移动,c(OH-)减小,①不合题意;硫酸中的H+与OH-反应,使c(OH-)减小,平衡向正反应方向移动,②不合题意;当在氨水中加入NaOH固体后,c(OH-)增大,平衡向逆反应方向移动,③符合题意;若在氨水中加入水,稀释溶液,平衡向正反应方向移动,但c(OH-)减小;④不合题意;电离属吸热过程,加热平衡向正反应方向移动,c(OH-)增大,⑤不合题意;加入少量MgSO4固体发生反应Mg2++2OH-===Mg(OH)2↓,溶液中c(OH-)减小,⑥不合题意。
答案 C
名师精讲
影响弱电解质电离平衡的因素
(1)内因:弱电解质本身的性质,是决定因素。
(2)外界条件对弱电解质电离平衡的影响
以0.1 mol·L-1的CH3COOH溶液为例:
CH3COOHCH3COO-+H+ ΔH>0
1.下列关于电解质溶液的说法正确的是( )
A.0.1 L 0.5 mol·L-1 CH3COOH溶液中含有的H+数为0.05NA
B.室温下,稀释0.1 mol·L-1CH3COOH溶液,溶液的导电能力增强
C.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中减小
D.CH3COOH溶液加水稀释后,溶液中的值减小
答案 D
解析 A项,CH3COOH为弱电解质,在水溶液中部分电离,0.1 L 0.5 mol·L
-1CH3COOH溶液中含有的H+数小于0.05NA,错误;B项,CH3COOH溶液中存在平衡,CH3COOHCH3COO-+H+,加水稀释,平衡右移,产生的离子数增加,但溶液的体积增大,c(CH3COO-)、c(H+)减小,导电能力减弱,错误;C项,加水稀释时,平衡CH3COOHCH3COO-+H+右移,n(H+)增大,n(CH3COOH)减小,==,故比值变大,错误;D项,稀释时,n(CH3COO-)增大,n(CH3COOH)减小,故的值减小,正确。
2.一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示。下列说法不正确的是( )
A.在O点时,醋酸不导电
B.a、b、c三点,a点时醋酸溶液中H+浓度最小
C.b点时,醋酸电离程度最大
D.可通过微热的方法使c点溶液中c(CH3COO-)增大
答案 C
解析 A项,在O点时没有水,醋酸没有电离,不导电,正确;B项,导电能力为b>c>a,a、b、c三点,a点时醋酸溶液中H+浓度最小,正确;C项,加水促进醋酸电离,b点时醋酸电离程度不是最大,错误;D项,加热向电离方向移动,正确。
考点 强、弱电解质的比较
[典例2] (2018·长沙市长郡中学月考)pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则( )
A.x为弱酸,VxVy
C.y为弱酸,VxVy
解析 由图知:将一元酸x和y分别稀释10倍,pH的变化量ΔpHx=1,ΔpHy<1,所以x为强酸,y为弱酸。pH=2时弱酸y的浓度大,滴加NaOH溶液至pH=7时消耗NaOH溶液的体积y比x大。
答案 C
名师精讲
1.判断强、弱电解质的方法
(1)电解质是否完全电离
在溶液中强电解质完全电离,弱电解质部分电离。据此可以判断HA是强酸还是弱酸,如:若测得0.1 mol/L的HA溶液的pH=1,则HA为强酸;若pH>1,则HA为弱酸。
(2)是否存在电离平衡
强电解质不存在电离平衡,弱电解质存在电离平衡,在一定条件下电离平衡会发生移动。
①一定pH的HA溶液稀释前后pH的变化:
将pH=3的HA溶液稀释100倍后,再测其pH,若pH=5,则为强酸,若pH<5,则为弱酸。
②升高温度后pH的变化:若升高温度,溶液的pH明显减小,则是弱酸。因为弱酸存在电离平衡,升高温度时,电离程度增大,c(H+)增大。而强酸不存在电离平衡,升高温度时,只有水的电离程度增大,pH变化幅度小。
2.常温下,一元强酸(碱)和一元弱酸(碱)稀释时的pH变化图像
3.一元强酸与一元弱酸的比较
3.下列事实一定能证明HNO2是弱电解质的是( )
①常温下NaNO2溶液pH大于7 ②用HNO2溶液做导电实验,灯泡很暗 ③HNO2与NaCl不能发生反应
④常温下0.1 mol·L-1HNO2溶液的pH=2.1 ⑤NaNO2和H3PO4反应,生成HNO2 ⑥常温下将pH=1的HNO2溶液稀释至原体积的100倍,溶液pH约为2.8
A.①④⑥ B.①②③④
C.①④⑤⑥ D.①②③④⑤⑥
答案 C
解析 ①常温下NaNO2溶液pH大于7,说明亚硝酸钠是强碱弱酸盐,则HNO2是弱电解质,故①正确;②溶液的导电性与离子浓度及离子所带电荷数有关,用HNO2溶液做导电实验,灯泡很暗,不能证明HNO2为弱电解质,故②错误;③HNO2与NaCl不能发生反应,只能说明不符合复分解反应发生的条件,但不能说明HNO2是弱电解质,故③错误;④常温下0.1 mol·L-1HNO2溶液的pH=2.1,说明HNO2不完全电离,即说明HNO2为弱电解质,故④正确;⑤较强酸可以制取较弱酸,NaNO2和H3PO4反应,生成HNO2,说明HNO2
的酸性弱于H3PO4,则HNO2为弱电解质,故⑤正确;⑥常温下将pH=1的HNO2溶液稀释至原体积的100倍,溶液pH约为2.8,说明HNO2是弱电解质,故⑥正确。
4.在一定温度下,有a.盐酸、b.硫酸、c.醋酸三种酸:
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________(用字母表示,下同)。
(2)等体积、等物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是________。
(3)若三者c(H+)相同时,物质的量浓度由大到小的顺序是________。
(4)当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是________。
答案 (1)b>a>c (2)b>a=c
(3)c>a>b(或c>a=2b) (4)c>a=b
解析 HCl===H++Cl-;H2SO4===2H++SO;CH3COOHH++CH3COO-。
(2)同体积、同物质的量浓度的三种酸,因随着NaOH溶液的加入,CH3COOH电离平衡右移,提供的H+和盐酸相同,中和NaOH的能力盐酸和醋酸相同,而H2SO4提供的H+是它们的2倍,故b>a=c。
(3)c(H+)相同时,醋酸溶液浓度最大,因醋酸为弱酸,电离程度小,H2SO4浓度为盐酸的一半,故c>a>b(或c>a=2b)。
(4)当三者c(H+)相同且体积也相同时,因HCl、H2SO4为强电解质,在溶液中完全电离,所以H+总的物质的量相同,故产生H2的体积相同。CH3COOH为弱电解质,最终能提供的H+最多,生成的H2最多,故c>a=b。
考点 电离平衡常数及其应用
[典例3] 已知25 ℃时弱电解质电离平衡常数:
Ka(CH3COOH)=1.8×10-5,Ka(HSCN)=0.13。
(1)将20 mL 0.10 mol·L-1 CH3COOH溶液和20 mL 0.10 mol·L-1的HSCN溶液分别与0.10 mol·L-1的NaHCO3溶液反应,实验测得产生CO2气体体积V与时间t的关系如图。
反应开始时,两种溶液产生CO2的速率明显不同的原因是_________________________________________________________;
反应结束后所得溶液中c(SCN-)______c(CH3COO-)(填“>”“=”或“<”)。
(2)2.0×10-3 mol·L-1的氢氟酸中,调节溶液pH(忽略调节时体积变化),测得平衡体系中c(F-)、c(HF)与溶液pH的关系如下图。
则25 ℃时,HF电离平衡常数为:Ka(HF)=________。
解析 (1)反应结束后,溶质为CH3COONa和NaSCN,因CH3COOH酸性弱于HSCN,故CH3COONa水解程度大,c(CH3COO-)Ka(CH3COOH),溶液中c(H+):HSCN>CH3COOH,c(H+)大反应速率快 >
(2)4×10-4
名师精讲
1.电离平衡常数的应用
(1)判断弱酸(或弱碱)的相对强弱,电离平衡常数越大,酸性(或碱性)越强。
(2)判断盐溶液的酸性(或碱性)强弱,电离平衡常数越大,对应的盐水解程度越小,碱性(或酸性)越弱。
(3)判断复分解反应能否发生,一般符合“强酸制弱酸”规律。
(4)判断微粒浓度比值的变化
弱电解质加水稀释时,能促进弱电解质的电离,溶液中离子和分子的浓度会发生相应的变化,但电离平衡常数不变,题中经常利用电离平衡常数来判断溶液中微粒浓度比值的变化情况。如:0.1 mol/L CH3COOH溶液加水稀释,=
=,酸溶液加水稀释,c(H+)减小,K值不变,则增大。
2.电离常数计算的两种类型(以弱酸HX为例)
(1)已知c(HX)始和c(H+),求电离常数(水的电离忽略不计)
HX H+ + X-
:c(HX)始 0 0
:c(HX)始-c(H+) c(H+) c(H+)
则:Ka==。
由于弱酸只有极少一部分电离,c(H+)的数值很小,可作近似处理:c(HX)始-c(H+)≈c(HX)始,则Ka=。
(2)已知c(HX)始和电离常数,求c(H+)
根据上面的推导有Ka=≈
则:c(H+)=。
5.(2018·长沙质检)已知下面三个数据:7.2×10-4、4.6×10-4、4.9×10-10分别是下列有关的三种酸的电离常数(25 ℃),若已知下列反应可以发生:NaCN+HNO2===HCN+NaNO2 NaCN+HF===HCN+NaF NaNO2+HF===HNO2+NaF。由此可判断下列叙述中不正确的是( )
A.K(HF)=7.2×10-4
B.K(HNO2)=4.9×10-10
C.根据两个反应即可得出一元弱酸的强弱顺序为HF>HNO2>HCN
D.K(HCN)
相关文档
- 2020届高考化学一轮复习化学反应中2021-08-0615页
- 2020版高考一轮复习化学通用版学案2021-08-0611页
- 2020届高考化学一轮复习化学平衡状2021-08-0619页
- 2020版高考一轮复习化学通用版学案2021-08-067页
- 2020版高考一轮复习化学通用版学案2021-08-066页
- 2020届高考化学一轮复习化学能与热2021-08-0623页
- 2020届高考化学一轮复习化学能与热2021-08-0614页
- 2020届高考化学一轮复习化学有关计2021-07-0923页
- 2020届高考化学一轮复习化学反应原2021-07-0920页
- 2021届高考化学一轮复习化学反应速2021-07-098页