- 426.00 KB
- 2021-08-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时作业9 化学反应的限度
9
基础巩固
1.下列反应中,不属于可逆反应的是( )
A.2NO2===N2O4与N2O4===2NO2
B.H2+I22HI与2HIH2+I2
C.CO2+H2O===H2CO3与H2CO3===CO2↑+H2O
D.CaO+CO2===CaCO3与CaCO3CaO+CO2↑
解析:本题考查化学反应的可逆性.A、B、C中均为可逆反应,只有D中反应条件不同,二者不是可逆反应,故选D。
答案:D
2.某条件下某可逆反应达到最大限度时,我们称为此反应已达到“化学平衡”。下列关于化学平衡的说法中正确的是 ( )
A.当反应达到化学平衡时,反应物已完全转化为生成物
B.当反应达到化学平衡时,正、逆反应均已停止
C.当反应达到化学平衡时,反应混合物中各成分的浓度保持不变
D.当条件改变时,平衡不可能遭到破坏
解析:可逆反应进行不到底,反应物和生成物共存,A错;达到化学平衡时,只是正逆反应速率相同,但不等于零,反应仍在进行,B错;达到化学平衡时各组分的浓度不再发生改变,C正确;化学平衡是有条件的动态平衡,条件改变时平衡可能会破坏,直至建立新的平衡,D错。
答案:C
3.下列关于燃料充分燃烧的说法,不正确的是( )
A.空气量越多越好
B.应通入适量的空气
C.固体燃料燃烧前要粉碎
D.液体燃料燃烧时可以雾状喷出
解析:空气的量只要能满足燃料充分燃烧即可,大量的空气只会带走更多的热量。
答案:A
4.(2019年河北省唐山市开滦高一期中)在373 K时,密闭容器中充入一定量的NO2和SO2,发生如下反应:NO2+SO2NO+SO3 ,平衡时,下列叙述正确的是( )
①NO和SO3的物质的量一定相等
②NO2和SO2的物质的量一定相等
③体系中的总物质的量一定等于反应开始时总物质的量
④SO2、NO2、NO、SO3的物质的量一定相等
A.①和② B.②和③
C.①和③ D.③和④
解析:本题考查化学平衡状态的判断。①根据方程式,因为NO和SO3
9
的物质的量之比为1∶1,所以NO和SO3的物质的量一定相等,正确;②平衡时NO2和SO2的物质的量不变,不一定相等,与起始投料量有关,故错误;③两边气体的计量数相等,所以体系中的总物质的量一定等于反应开始时总物质的量,故正确;④SO2、NO2、NO、SO3 的物质的量不变,但不一定相等,故错误;故选C。
答案:C
5.(2019年广州模拟)在1 L定容的密闭容器中,可以证明可逆反应N2+3H22NH3已达到平衡状态的是( )
A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
B.一个N≡N断裂的同时,有3个H—H生成
C.其他条件不变时,混合气体的密度不再改变
D.v正(N2)=2v逆(NH3)
解析:c(N2)∶c(H2)∶c(NH3)=1∶3∶2等于化学方程式各物质的计量数之比,但不能说明各物质的浓度不变,不一定为平衡状态,A错误;一个N≡N断裂的同时,有3个H—H生成,说明正、逆反应速率相等,反应达到了平衡,B正确;混合气体的密度ρ=,质量在反应前后是守恒的,体积不变,密度始终不变,所以密度不变的状态不一定是平衡状态,C错误;v正(N2)=2v逆(NH3)时,正、逆反应速率不相等,未达到平衡状态,D错误。
答案:B
6.(2019年河南省南阳一中月考)在一定温度下,下列叙述不是可逆反应A(g)+3B(g)2C(g)+2D(s)达到平衡的标志的是( )
①C的生成速率与C的消耗速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④恒容容器,混合气体的密度不再变化
⑤恒容容器,混合气体的总压强不再变化
⑥混合气体的质量不再变化
⑦单位时间内消耗a mol A,同时生成3a mol B
⑧A、B、C、D的分子数之比为1∶3∶2∶2
A.②⑧ B.②⑤⑧
C.①③④⑦ D.②⑤⑥⑧
解析:本题考查化学平衡状态的判断。化学反应达到平衡状态的标志是同种物质的生成速率等于消耗速率、或者各组分的浓度不再变化,①同种物质的生成和消耗速率相等,可以判断达到了平衡;②A、B都是反应物,它们的生成、消耗速率总是等于系数比,不可以判断平衡;③物质的浓度不再变化说明达到了平衡;④恒容下,反应体系中有气体和固体,如果没有达到平衡,气体的密度就会发生变化,如果密度不变了就平衡了;⑤两边气体的化学计量数不相等,如果没有达到平衡,压强会发生改变,压强不变就达到了平衡。⑥反应体系中有气体和固体,如果没有到达平衡,气体的质量就会发生变化。⑦单位时间内消耗a mol A,同时生成 3a mol B,可以转化成同一种物质A的变化,则是单位时间内消耗a mol A,同时生成 a mol A,同种物质生成速率和消耗速率相等,说明达到了平衡。⑧分子数之比不能说明各物质的量不再发生改变。选A。
答案:A
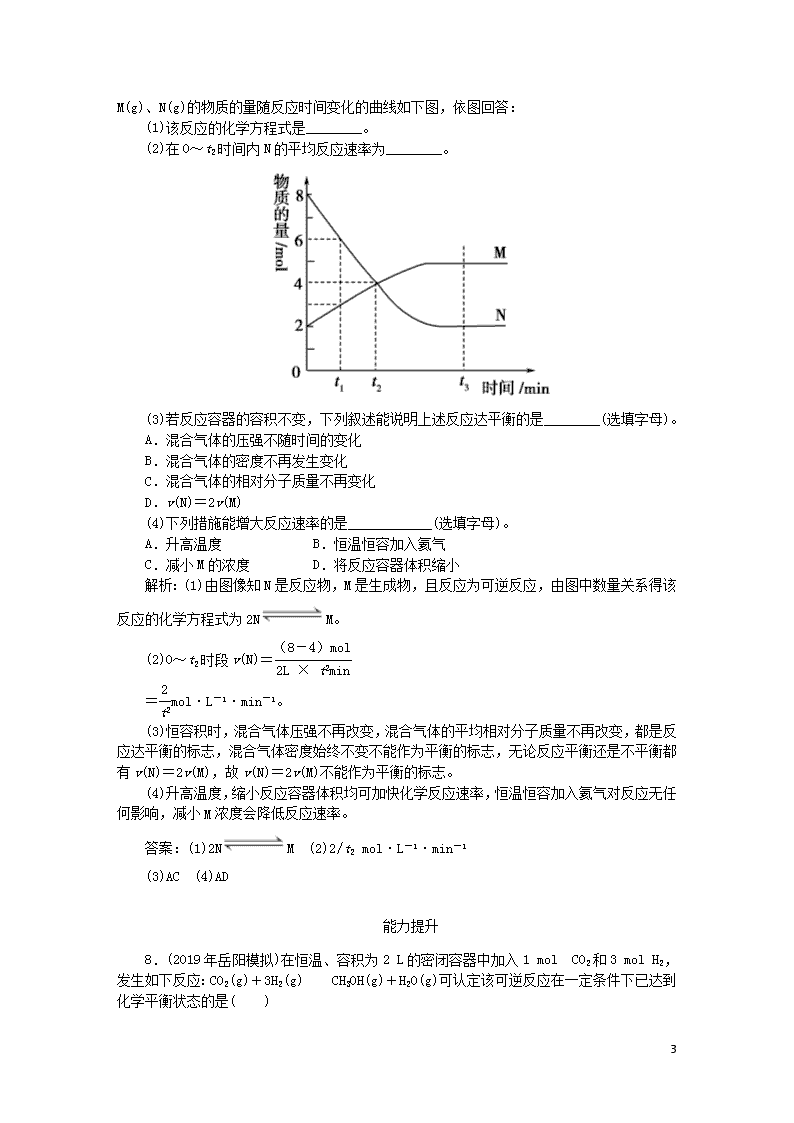
7.(2019年四川资阳中学期中)一定温度下,某容积为2 L的密闭容器内,
9
某一反应中M(g)、N(g)的物质的量随反应时间变化的曲线如下图,依图回答:
(1)该反应的化学方程式是________。
(2)在0~t2时间内N的平均反应速率为________。
(3)若反应容器的容积不变,下列叙述能说明上述反应达平衡的是________(选填字母)。
A.混合气体的压强不随时间的变化
B.混合气体的密度不再发生变化
C.混合气体的相对分子质量不再变化
D.v(N)=2v(M)
(4)下列措施能增大反应速率的是____________(选填字母)。
A.升高温度 B.恒温恒容加入氦气
C.减小M的浓度 D.将反应容器体积缩小
解析:(1)由图像知N是反应物,M是生成物,且反应为可逆反应,由图中数量关系得该反应的化学方程式为2NM。
(2)0~t2时段v(N)=
=mol·L-1·min-1。
(3)恒容积时,混合气体压强不再改变,混合气体的平均相对分子质量不再改变,都是反应达平衡的标志,混合气体密度始终不变不能作为平衡的标志,无论反应平衡还是不平衡都有v(N)=2v(M),故v(N)=2v(M)不能作为平衡的标志。
(4)升高温度,缩小反应容器体积均可加快化学反应速率,恒温恒容加入氦气对反应无任何影响,减小M浓度会降低反应速率。
答案:(1)2NM (2)2/t2 mol·L-1·min-1
(3)AC (4)AD
能力提升
8.(2019年岳阳模拟)在恒温、容积为2 L的密闭容器中加入1 mol CO2和3 mol H2,发生如下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g)可认定该可逆反应在一定条件下已达到化学平衡状态的是( )
9
A.容器中CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1∶1
B.v正(CO2)=3v逆(H2)
C.容器内混合气体平均相对分子质量保持不变
D.容器中CO2、H2、CH3OH、H2O的物质的量浓度都相等
解析:A项,四种物质的量比为1∶3∶1∶1不能说明反应达到平衡,错误;B项,当v正(CO2)=v逆(H2)时,反应达到平衡状态,错误;C项,因为反应前后气体的物质的量不等,所以相对分子质量随着反应进行而改变,当相对分子质量不变时,反应达到平衡,正确;D项,四种物质的浓度相等,不能说明反应达到平衡,错误。
答案:C
9.(2019年河南省南阳市一中月考)两种气体A、B分别为0.6 mol与0.5 mol。在0.4 L密闭容器中发生反应:3A(g)+B(g)mC(g)+2D(g),经5 min后达到平衡,此时C为0.2 mol,又知在此反应时间,D的平均反应速率为0.1 mol·(L·min)-1。下列结论正确的是( )
A.m的值为2
B.改变压强,该平衡状态发生改变
C.A的平均反应速率为0.1 mol·(L·min)-1
D.平衡时,反应混合物的总物质的量为1 mol
解析:A.5 min后生成D(0.1×0.4×5) mol=0.2 mol,等于C的物质的量,所以m=2,故A正确。B.该反应气体物质的量不变化,所以改变压强,该平衡状态不发生改变,故B错误;C.消耗A 0.3 mol,A的平均反应速率为D的倍,等于0.15 mol·(L·min)-1,故C错误;D. 该反应气体物质的量不变化,所以平衡时,反应混合物的总物质的量为1.1 mol,故D错误。故选A。
答案:A
10.(双选)在密闭容器中进行反应:X2(g)+Y2(g)2Z(g)。已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度可能是( )
A.Z为0.3 mol·L-1 B.Y2为0.35 mol·L-1
C.X2为0.2 mol·L-1 D.Z为0.4 mol·L-1
解析:用极限法,物质转化时,其他物质不能出现负数和零。
X2(g)+Y2(g)2Z(g)
0.1 0.3 0.2
①X2为0: 0 0.2 0.4
②Y2为0: <0 0 >0(舍去)
③Z为0: 0.2 0.4 0
所以各物质的物质的量浓度可能的范围是:
X2:0
相关文档
- 高中化学人教版必修2(练习)2_3_2 化2021-08-0615页
- 2019-2020学年高中化学课时作业122021-08-067页
- 化学反应的限度(教案,必修)2021-08-064页
- 高中化学第2章化学反应的方向、限2021-07-086页
- 高中化学第二章化学键化学反应规律2021-07-0815页
- 2019-2020学年高中化学人教版必修22021-07-0815页
- 2020版新教材高中化学第2章化学键2021-07-088页
- 高中化学第2章化学反应的方向限度2021-07-0876页
- 2019届二轮复习12化学反应的限度与2021-07-0822页
- 2021届一轮复习鲁科版化学反应的限2021-07-0710页