- 1.84 MB
- 2021-08-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
一
、
等效平衡的概念
:
在
一定条件
下,同一可逆反应只要
起始组分
的量
相当
,无论经过何种
途径
,但达到化学平衡时,只要任何相同组分(同种物质)的
物质的量分数(百分含量)
相同,这样的平衡称为等效平衡。
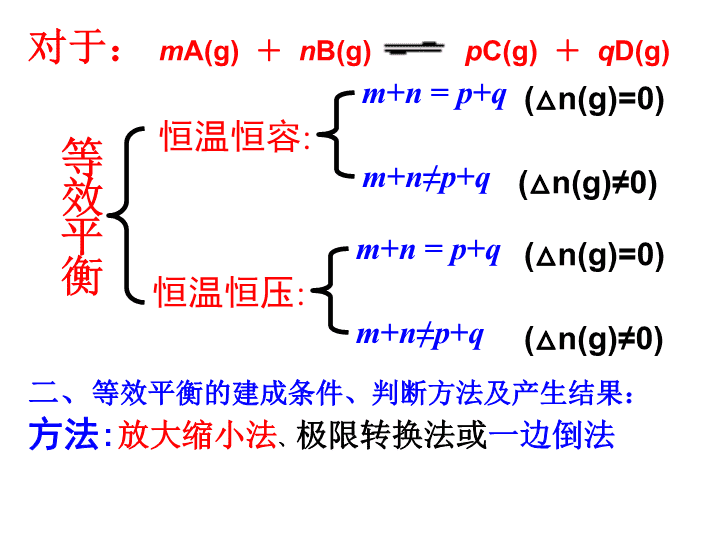
等效平衡专题
等效平衡
恒温恒容
:
m
+
n
=
p
+
q
m
+
n
≠
p
+
q
恒温恒压
:
m
+
n
=
p
+
q
m
+
n
≠
p
+
q
对于:
m
A(g)
+
n
B(g)
p
C(g)
+
q
D(g)
(△n(g)=0)
(△n(g)=0)
(△n(g)≠0)
(△n(g)≠0)
二、
等效平衡的建成条件、判断方法及产生结果:
方法
:
放大缩小法
、
极限转换法或
一边倒法
一)恒温恒容
1
:
(
△n
(
g
)
=0
)
H
2
a%
I
2
b%
H
I
c%
平衡状态
Ⅰ
H
2
(g)
+ I
2
(g)
2HI
(g)
H
2
a%
I
2
b%
H
I
c%
平衡状态
H
2
a%
I
2
b%
H
I
c%
平衡状态
Ⅱ
H
2
a%
I
2
b%
H
I
c%
平衡状态
Ⅱ
?
1mol H
2
1mol I
2
A
1mol H
2
1mol I
2
B
1mol H
2
1mol I
2
B
2mol H
2
2mol I
2
B
方法
:
放大缩小法
恒温恒容
(
△n
(
g
)
=0
)
H
2
(g)
+ I
2
(g)
2HI
(g)
1mol H
2
1mol I
2
B
1mol H
2
1mol I
2
B
2mol H
2
2mol I
2
B
1mol H
2
1mol I
2
B
1mol H
2
1mol I
2
B
2mol H
2
2mol I
2
B
相对等效平衡
H
2
a%
I
2
b%
H
I
c%
平衡状态
Ⅰ
1mol H
2
1mol I
2
A
例
1
、
恒温恒容时对于反应:
H
2
(g) + I
2
(g) 2HI(g)
下列条件能与下图达到等效平衡的是( )
1mol H
2
1mol
I
2
开始
H
2
a%
I
2
b%
H
I
c%
平衡状态
A. 2 mol HI
B. 2 mol H
2
+2 mol I
2
C. 1 mol H
2
+1 mol I
2
+2 mol HI
D. 0.5 mol H
2
+0.5 mol I
2
+1 mol HI
(
1 1
0
)
(
2 2 0
)
(
2 2 0
)
(
1 1 0
)
ABCD
极限转化或一边倒
例
2
:
在一个
1L
的密闭容器中,加入
2molA
和
1molB
,发生下述反应:
2A(g)+B(g) 3C(g)+D(s)
达到平衡时,
C
的
浓度为
1.2mol/L
。维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,
C
的
浓度
仍为
1.2mol/L
的是
( )
A
、
0.3mol C + 0.1mol D
B
、
1.6mol A + 0.8mol B + 0.6mol C + 0.2mol D
C
、
3mol C + 1mol D + 1mol B
D
、
4mol A + 2mol B
结论:对于
气态物质反应前后分子总数不变的可逆反应,
只要起始组分的
物质的量比
相等(相当)。则为等效平衡。
B
注意
:
上题中的答案
D
虽然
A/B = 4/2
= 2/1,
同条件下可达到等效平衡,但
C
的浓度却不为
1.2mol/L
,
而为
?
2.4mol/L
二、等效平衡的建成条件、判断方法
及产生结果:
1
:对于
气态物质反应前后
分子数不变化
的可逆反应
等效平衡的
判断方法是
:
使用
极限转化
的方法将各种情况变换成同一反应物或生成物,然后观察有关物质的
物质的量
比
是否相等。
若相等
产生结果:
各组分百分量相同,
n
、
c
同比例变化,
则为等效平衡。
m
A(g)
+
n
B(g)
p
C(g)
+
q
D(g)
m
+
n
=
p
+
q
一)
恒温、恒容:
(△n(g)=0)
一)恒温恒容
2
:
(
△n
(
g
)
≠ 0
)
4molSO
2
2molO
2
B
方法
:
放大缩小法
极限转换法或
一边倒法
2SO
2
+ O
2
2SO
3
SO
2
a%
O
2
b%
SO
3
c%
平衡状态
Ⅰ
SO
2
a%
O
2
b%
SO
3
c%
SO
2
a%
O
2
b%
SO
3
c%
平衡状态
Ⅱ
SO
2
a%
O
2
b%
SO
3
c%
平衡状态
Ⅱ
SO
2
O
2
SO
3
平衡状态
Ⅱ
?
2molSO
2
1molO
2
A
2molSO
2
1molO
2
B
2molSO
2
1molO
2
B
4molSO
2
2molO
2
B
①
若平衡不移动
②
若平衡移动
恒温恒容
(
△n
(
g
)
≠ 0
)
SO
2
a%
O
2
b%
SO
3
c%
平衡状态
2mol SO
2
1mol O
2
A
2mol SO
2
1mol O
2
B
2mol SO
2
1mol O
2
B
4mol SO
2
2mol O
2
B
2mol SO
2
1mol O
2
B
2mol SO
2
1mol O
2
B
4mol SO
2
2mol O
2
B
非等效平衡!
2SO
2
+ O
2
2SO
3
方法
:
放大缩小法
结论:
对于
气态物质反应前后分子总数变化的可逆反应,
只要
起始组分的
物质的量
相等(相当),则为等效平衡。否则非等效 。
例
3
:
在一个
1L
的密闭容器中,加入
2molA
和
1molB
,发生下述反应:
2A(g)+B(g) 3C(g)+D(g)
达到平衡时,
C
的体积分数为
a%
。维持容器的体积和温度不变,按下列配比作为起始物质,达平衡后,
C
的体积分数仍为
a%
是
A
、
3mol C + 1mol D
B
、
1mol A + 0.5mol B + 1.5mol C + 0.5mol D
C
、
1mol A + 0.5mol B + 1.5mol C
D
、
4mol A + 2mol B
A
、
B
二、等效平衡的建成条件、判断方法及产生结果:
一)
恒温、恒容:
2
、
对于气态物质反应前后
分子数变化
的可逆反应等效平衡的
判断方法是
:
使用
极限转化
的方法将各种情况变换成同一反应物或生成物,然后观察有关物质的
物质的量
是否对应
相等
。
若相等
产生结果:
各组分百分量、
n
、
c
均相同,
则为等效平衡(绝对等效)
m
A(g)
+
n
B(g)
p
C(g)
+
q
D(g)
m
+
n
≠
p
+
q
(△n(g)≠0)
H
2
a%
I
2
b%
H
I
c%
平衡状态
H
2
(g)
+ I
2
(g)
2HI
(g)
H
2
a%
I
2
b%
H
I
c%
平衡状态
H
2
a%
I
2
b%
H
I
c%
平衡状态
1mol H
2
1mol
I
2
A
1mol H
2
1mol
I
2
B
1mol H
2
1mol
I
2
B
2mol H
2
2mol
I
2
B
H
2
a%
I
2
b%
H
I
c%
二)恒温恒压
2
:
(
△n
(
g
)
=0
)
H
2
a%
I
2
b%
H
I
c%
平衡状态
H
2
(g)
+ I
2
(g)
2HI
(g)
1mol H
2
1mol I
2
A
1mol H
2
1mol I
2
B
1mol H
2
1mol I
2
B
2mol H
2
2mol I
2
B
等效平衡
1mol H
2
1mol I
2
B
1mol H
2
1mol I
2
B
二)恒温恒压
2
:
(
△n
(
g
)
=0
)
练习
1
、在一密闭容器中,加入
2molA
和
1molB
,发生下述反应:
2A(g)+B(g) 3C(g)+D(
s
)
达到平衡时,
C
的浓度为
1.2mol/L
。维持容器的
压强
和温度不变,按下列配比作为起始物质,达到平衡后,
C
的
浓度
仍为
1.2mol/L
的是
( )
A
、
0.3mol C + 0.1mol D
B
、
1.6mol A + 0.8mol B + 0.6mol C + 0.2mol D
C
、
3mol C + 1mol D + 1mol B
D
、
4mol A + 2mol B
A
、
B
、
D
SO
2
a%
O
2
b%
SO
3
c%
平衡状态
Ⅱ
SO
2
a%
O
2
b%
SO
3
c%
2SO
2
+ O
2
2SO
3
SO
2
a%
O
2
b%
SO
3
c%
2molSO
2
1molO
2
B
2molSO
2
1molO
2
B
4molSO
2
2molO
2
B
方法
:
放大
或
缩小法
SO
2
a%
O
2
b%
SO
3
c%
平衡状态
Ⅰ
2molSO
2
1molO
2
A
二)恒温恒压
1
:
(
△n
(
g
)
≠ 0
)
2mol SO
2
1mol O
2
B
2mol SO
2
1mol O
2
B
4mol SO
2
2mol O
2
B
等效平衡
2mol SO
2
1mol O
2
B
2mol SO
2
1mol O
2
B
二)恒温恒压
1
:
(
△n
(
g
)
≠ 0
)
2SO
2
+ O
2
2SO
3
SO
2
a%
O
2
b%
SO
3
c%
平衡状态
Ⅰ
2molSO
2
1molO
2
A
结论:
对于
气态物质反应前后分子总数变化的可逆反应,
只要
起始组分的
物质的量
相等(相当),则为等效平衡。否则非等效 。
例
4
、
(将前例
3
条件改变)
在一密闭容器中
,加入
2molA
和
1molB
,发生下述反应:
2A(g)+B(g) 3C(g)+D(g)
达到平衡时,
C
的体积分数为
a%
。维持容器的
压强
和温度不变,按下列配比作为起始物质,达平衡后,
C
的体积分数仍为
a%
是
A
、
3mol C + 1mol D
B
、
1mol A + 0.5mol B + 1.5mol C + 0.5mol D
C
、
1mol A + 0.5mol B + 1.5mol C
D
、
4mol A + 2mol B
A
、
B
、
D
在一定温度下,一个压强恒定的密闭容器中发生反应
2A(g)+B(g)
3C(g)+D(g)
,根据下表有关数据分析
恒温、恒压
达平衡时
D
的体积分数(分别选填
a%
或
b%
a≠b
)
。
A
B
C
D
平衡时
D
的体积分数
起始
充入
2mol
1mol
0
0
1mol
0.5mol
1.5mol
0.5mol
4mol
2mol
0
0
2mol
2mol
0
0
a%
a%
a%
b% (a≠b)
二、等效平衡的建成条件、判断方法及产生结果:
与可逆反应气态物质的化学
计量数
无关
,
使用
极限转化
的方法将各种情况变换成同一反应物或生成物,然后观察有关物质的
物质的量
比
是否相等。
若相等,
二)
恒温、恒压
下等效平衡的
判断方法是
:
产生结果:
各组分百分量、
c
相同,
n
同比例
变化
等效平衡小结
条件
等效条件
结果
恒
温
恒
容
(
△
n(
g
)≠0)
(
△
n(
g
)=0)
恒温恒压
投料换算成相同物质表示时
量相同
投料换算成相同物质表示时
等比例
投料换算成相同物质表示时
等比例
两次平衡时各组分百分量、
n
、
c
均相同
两次平衡时各组分百分量相同,
n
、
c
同比例变化
两次平衡时各组分百分量、
c
相同
n
同比例变化
等效平衡规律
:
①
恒温恒容条件下的等效平衡
Ⅰ
:
对反应前后气体分子数不变的可逆反应,只要换算成反应物(或生成物)的
物质的量的比值
与原平衡相同,则二平衡等效。
II
:
对反应前后气体分子数改变的可逆反应,只改变起始加入量,只要通过可逆反应的化学计量数比换算成平衡式左
或
右边同一半边的
物质的量
与原平衡相同,则二平衡等效。
②
恒温恒压下的等效平衡
III
:
改变起始加入情况,只要按化学计量数换算成平衡式左或右边同一半边的
物质的量
的比值
与原平衡相同,则
二平衡等效。
注
:I
、
III
为相对等效;
II
为绝对等效
.
化学平衡特征和标志
练习
5
、在一个
1L
的密闭容器中,加
2molA 1molB
发生下述反应:
达到平衡时,
C
的浓度为
1.2mol/L , C
的体积分数为
a%
。
维持容器的
压强和温度
不变,按下列配比作为起始物质,达到平衡后,
C
的浓度仍是
1.2mol/L
(或
C
的体积分数仍是
a%
)的是
A
、
3mol C+1mol D
B
、
1mol A+0.5mol B+1.5mol C+0.5mol D
C
、
1mol A+0.5mol B+1.5mol C
D
、
4mol A+2mol B
ABD
三、等效平衡的应用:
练习
6
在一固定容积的密闭容器中,充入
2molA
和
1molB
发生反应:
2A(g)+B(g) xC(g)
,达到平衡后
C
的体积分数为
Φ%
。若维持容器体积和温度不变,按
0.6molA
,
0.3molB
和
1.4molC
为起始物质,达到平衡后,
C
的体积分数也为
Φ%
,则
x
的值 ( )
A
、只能为
2
B
、只能为
3
C
、可能是
2
,也可能是
3
D
、无法确定
C
注意:
C
无论是多少,分解时总是按
2
:
1
分解。
练习
7
、在一固定容积的密闭容器中充入
2molA
和
1molB
,发生反应:
2A(
气
)+B(
气
) xC(
气
),
达到平衡后,
C
的体积分数为
W%
。若维持容器体积和温度不变,按
0.6molA
、
0.3molB
和
1.4molC
为起始物质,达到平衡后,
C
的体积分数仍为
W%
,则
x
值为( )
A
、
1 B
、
2 C
、
3 D
、
4
BC
﹏
同练习
6
练习
8
、某温度下,向某密闭容器中加入
1molN
2
和
3molH
2
,
使之反应合成
NH
3
,平衡后测得
NH
3
的体积分数为
m
。若
T
不变,只改变起始加入量,使之反应平衡后
NH
3
的体积分数仍为
m
,若
N
2
、
H
2
、
NH
3
的加入量用
X
、
Y
、
Z
表示应满足:
(
1
)恒定
T
、
V
:
[1]
若
X=0
,
Y=0
,则
Z=-----------
。
[2]
若
X=0.75
,
Y=----------
,
Z=----------
。
[3]X
、
Y
、
Z
应满足的一般条件是
---------------
(
2
)恒定
T
、
P
:
[1]
若
X=0
、
Y=0
,则
Z
。
[2]
若
X=0.75,
则
Y
,
Z
。
[3]X
、
Y
、
Z
应满足的一般条件是
>0
=2.25mol
≥0
Y=3X
,
Z≥0
2mol
2.25mol
0.5mol
X+Z/2=1 , Y+3Z/2=3
练习
9
、在固定体积的密闭容器内,加入
2
mol A
、
1mol B
,发生反应:
A(
气
)+B(
气
) 2C(
气
)
达 到平衡时,
C
的
质量
分数为
W
。在相同
(T
、
V)
条件下,按下列情况充入物质达到平衡时
C
的
质量
分数仍为
W
的是
A.2mol C
B.3mol C
C.4mol A
、
2mol B
D.1mol A
、
2mol C
CD
练习
10
、在一固定容积的密闭容器中充入
2molA
和
1molB
,发生反应:
2A(
气
)+B(
气
) xC(
气
),
达到平衡后,
C
的体积分数为
W%
。若维持容器体积和温度不变,按
0.6molA
、
0.3molB
和
1.4molC
为起始物质,达到平衡后,
C
的体积分数仍为
W%
,则
x
值为( )
A
、
1 B
、
2 C
、
3 D
、
4
练习
11
、
某温度下在一固定容积的密闭容器中,发生如下反应:
2A(
气
)+B(
气
) 2C(
气
),
若开始只充入
2molC(
气
)
,达到平衡时,混合气体的压强比开始时增大了
20%
;若开始时只充入
2molA
和
1molB
的混合气体,达到平衡
A
的转化率为( )
两次达到平衡后产生的热量值是否相等?
A
、
20% B
、
40% C
、
60% D
、
80%
BC
C
练习
12.
某温度下,在一容积可变的容器中,反应:
2A(g)+B(g) 2C(g)
达到平衡时,
A
、
B
和
C
的物质的量分别为
4mol
、
2mol
、
4mol
。维持容器的温度和压强不变,对平衡混合物中三者的物质的量做如下的调整,可是平衡右移的是
( )
A
、均减半
B
、均加倍
C
、均增加
1mol D
、均减少
1mol
C
详解:(三行式法)依阿佛加德罗定律:气体的物质的量比
=
体积比
=
压强比
由题意:
2A(
气
) + B(
气
) 2C(
气
) △V
2 1 2 1
开始: ? ? ?
变化: ? ? ?
平衡:
4mol 2mol 4mol
由于该反应在一容积可变的容器中进行,即恒温、恒压,
只要
起始组分的
物质的量比
相等(相当)。则为等效平衡。可认为平衡不移动,淘汰
A
、
B
故有:各增加
1mol
时,可作如下计算:
由题意:
2A(
气
) + B(
气
) 2C(
气
) △V
2 1 2 1
开始:(
4+1
)
mol
(
2+0.5
)
mol
(
4+1
)
mol
变化: ? ? ?
平衡: ? ? ?
则达到平衡后
为等效平衡。可认为平衡不移动,
但
B
只增加了
0.5mol,
与题所给条件不符,需再增加
0.5mol B
才相符。依勒夏特列原理,此时平衡将右移
,
故选:
C