- 360.81 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时规范练27 物质的检验、分离和提纯
(时间:45分钟 满分:100分)
一、选择题(本题共10小题,每小题5分,共50分,每小题只有一个选项符合题目要求)
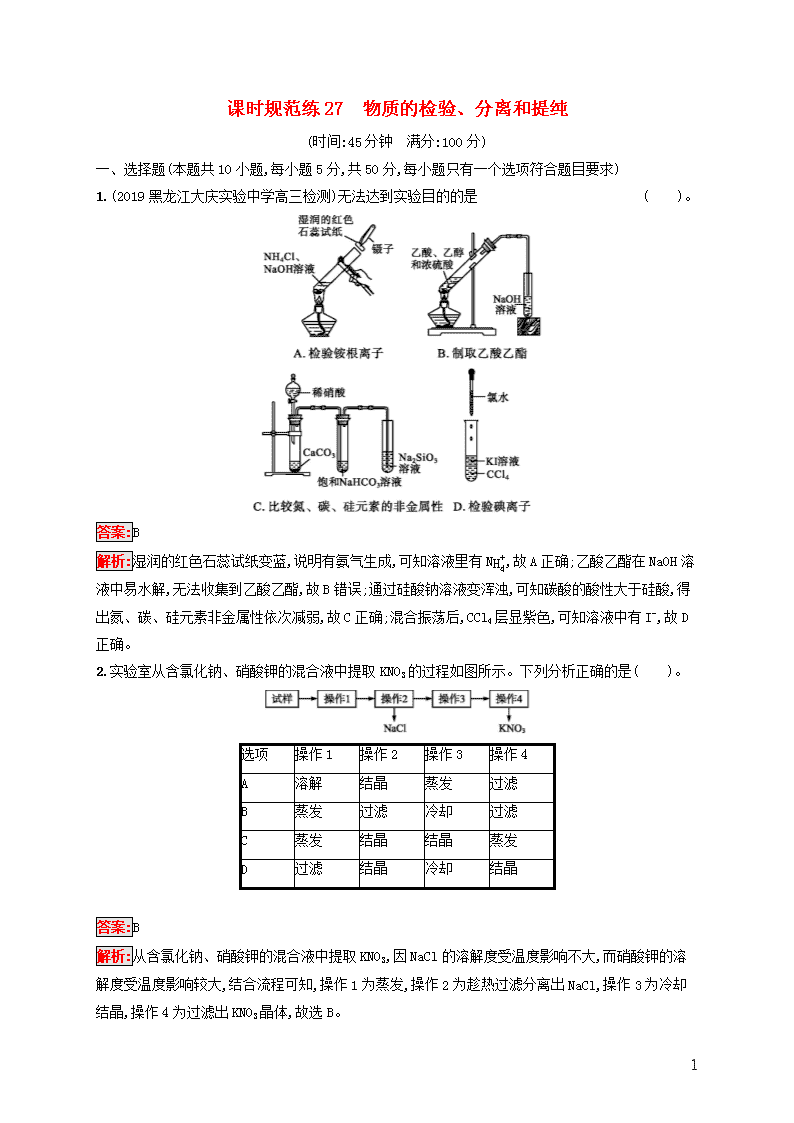
1.(2019黑龙江大庆实验中学高三检测)无法达到实验目的的是( )。
答案:B
解析:湿润的红色石蕊试纸变蓝,说明有氨气生成,可知溶液里有NH4+,故A正确;乙酸乙酯在NaOH溶液中易水解,无法收集到乙酸乙酯,故B错误;通过硅酸钠溶液变浑浊,可知碳酸的酸性大于硅酸,得出氮、碳、硅元素非金属性依次减弱,故C正确;混合振荡后,CCl4层显紫色,可知溶液中有I-,故D正确。
2.实验室从含氯化钠、硝酸钾的混合液中提取KNO3的过程如图所示。下列分析正确的是( )。
选项
操作1
操作2
操作3
操作4
A
溶解
结晶
蒸发
过滤
B
蒸发
过滤
冷却
过滤
C
蒸发
结晶
结晶
蒸发
D
过滤
结晶
冷却
结晶
答案:B
解析:从含氯化钠、硝酸钾的混合液中提取KNO3,因NaCl的溶解度受温度影响不大,而硝酸钾的溶解度受温度影响较大,结合流程可知,操作1为蒸发,操作2为趁热过滤分离出NaCl,操作3为冷却结晶,操作4为过滤出KNO3晶体,故选B。
7
3.下列各组混合物的分离和提纯方法正确的是( )。
A.用萃取法分离汽油和水的混合液
B.用结晶法提纯NaCl和KNO3混合物中的KNO3
C.直接蒸馏酒精溶液得到无水乙醇
D.除去FeCl3溶液中少量的FeCl2,加入足量的铁屑,充分反应后,过滤
答案:B
解析:汽油和水互不相溶,应使用分液的方法进行分离,A项错误;NaCl的溶解度随温度变化较小,而KNO3的溶解度随温度变化较大,故可用结晶法提纯NaCl和KNO3混合物中的KNO3,B项正确;酒精和水都容易挥发,直接蒸馏酒精溶液得不到无水乙醇,应在酒精溶液中加入CaO再蒸馏,C项错误;除去FeCl3溶液中少量的FeCl2,应通入足量的Cl2,D项错误。
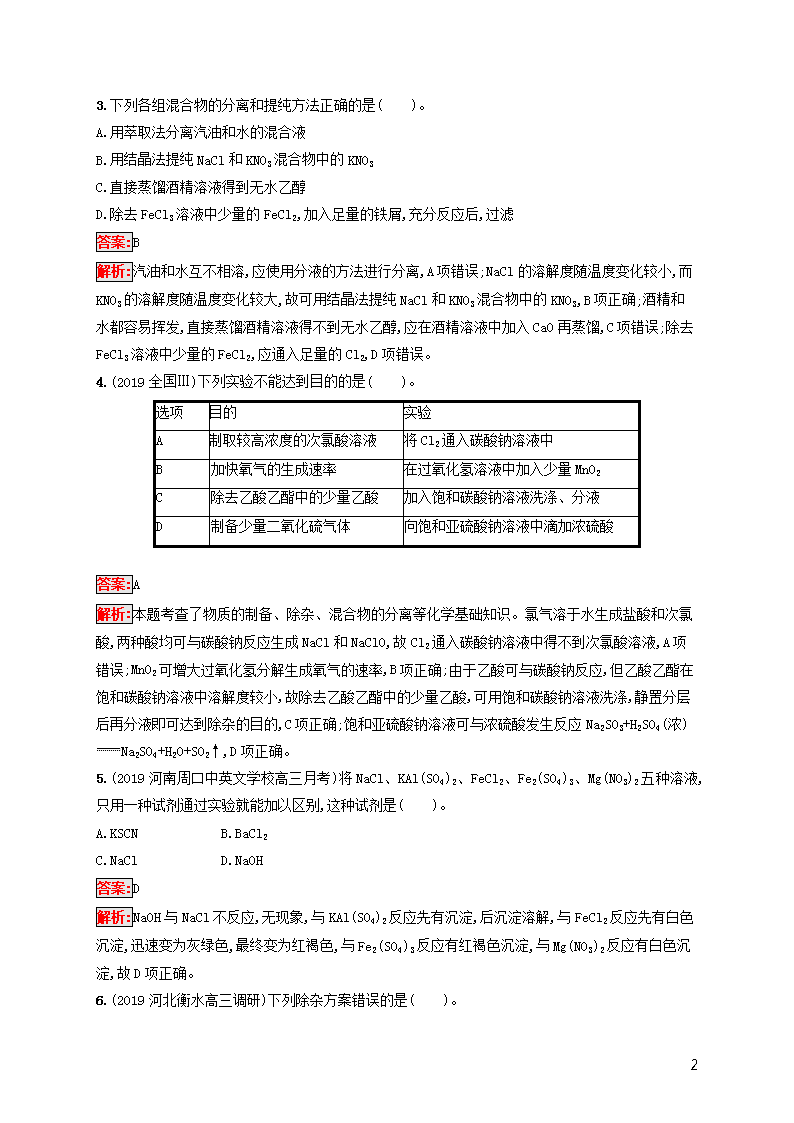
4.(2019全国Ⅲ)下列实验不能达到目的的是( )。
选项
目的
实验
A
制取较高浓度的次氯酸溶液
将Cl2通入碳酸钠溶液中
B
加快氧气的生成速率
在过氧化氢溶液中加入少量MnO2
C
除去乙酸乙酯中的少量乙酸
加入饱和碳酸钠溶液洗涤、分液
D
制备少量二氧化硫气体
向饱和亚硫酸钠溶液中滴加浓硫酸
答案:A
解析:本题考查了物质的制备、除杂、混合物的分离等化学基础知识。氯气溶于水生成盐酸和次氯酸,两种酸均可与碳酸钠反应生成NaCl和NaClO,故Cl2通入碳酸钠溶液中得不到次氯酸溶液,A项错误;MnO2可增大过氧化氢分解生成氧气的速率,B项正确;由于乙酸可与碳酸钠反应,但乙酸乙酯在饱和碳酸钠溶液中溶解度较小,故除去乙酸乙酯中的少量乙酸,可用饱和碳酸钠溶液洗涤,静置分层后再分液即可达到除杂的目的,C项正确;饱和亚硫酸钠溶液可与浓硫酸发生反应Na2SO3+H2SO4(浓)Na2SO4+H2O+SO2↑,D项正确。
5.(2019河南周口中英文学校高三月考)将NaCl、KAl(SO4)2、FeCl2、Fe2(SO4)3、Mg(NO3)2五种溶液,只用一种试剂通过实验就能加以区别,这种试剂是( )。
A.KSCN B.BaCl2
C.NaCl D.NaOH
答案:D
解析:NaOH与NaCl不反应,无现象,与KAl(SO4)2反应先有沉淀,后沉淀溶解,与FeCl2反应先有白色沉淀,迅速变为灰绿色,最终变为红褐色,与Fe2(SO4)3反应有红褐色沉淀,与Mg(NO3)2反应有白色沉淀,故D项正确。
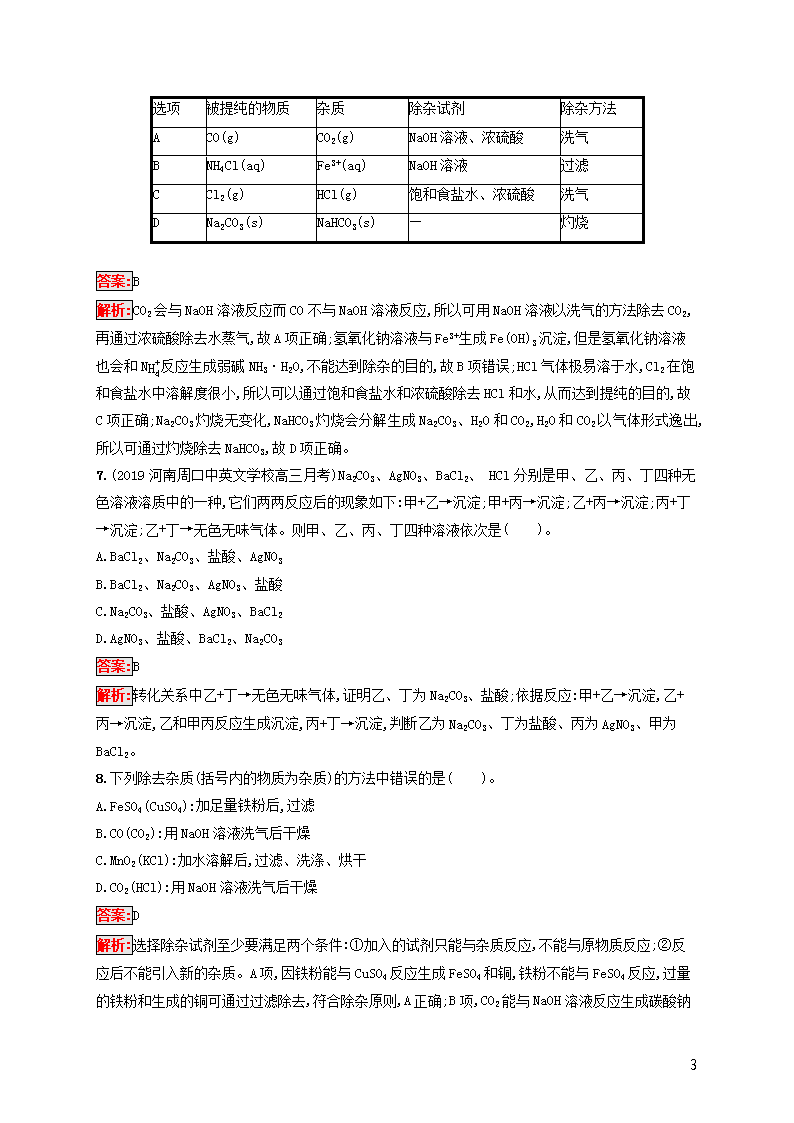
6.(2019河北衡水高三调研)下列除杂方案错误的是( )。
7
选项
被提纯的物质
杂质
除杂试剂
除杂方法
A
CO(g)
CO2(g)
NaOH溶液、浓硫酸
洗气
B
NH4Cl(aq)
Fe3+(aq)
NaOH溶液
过滤
C
Cl2(g)
HCl(g)
饱和食盐水、浓硫酸
洗气
D
Na2CO3(s)
NaHCO3(s)
—
灼烧
答案:B
解析:CO2会与NaOH溶液反应而CO不与NaOH溶液反应,所以可用NaOH溶液以洗气的方法除去CO2,再通过浓硫酸除去水蒸气,故A项正确;氢氧化钠溶液与Fe3+生成Fe(OH)3沉淀,但是氢氧化钠溶液也会和NH4+反应生成弱碱NH3·H2O,不能达到除杂的目的,故B项错误;HCl气体极易溶于水,Cl2在饱和食盐水中溶解度很小,所以可以通过饱和食盐水和浓硫酸除去HCl和水,从而达到提纯的目的,故C项正确;Na2CO3灼烧无变化,NaHCO3灼烧会分解生成Na2CO3、H2O和CO2,H2O和CO2以气体形式逸出,所以可通过灼烧除去NaHCO3,故D项正确。
7.(2019河南周口中英文学校高三月考)Na2CO3、AgNO3、BaCl2、 HCl分别是甲、乙、丙、丁四种无色溶液溶质中的一种,它们两两反应后的现象如下:甲+乙→沉淀;甲+丙→沉淀;乙+丙→沉淀;丙+丁→沉淀;乙+丁→无色无味气体。则甲、乙、丙、丁四种溶液依次是( )。
A.BaCl2、Na2CO3、盐酸、AgNO3
B.BaCl2、Na2CO3、AgNO3、盐酸
C.Na2CO3、盐酸、AgNO3、BaCl2
D.AgNO3、盐酸、BaCl2、Na2CO3
答案:B
解析:转化关系中乙+丁→无色无味气体,证明乙、丁为Na2CO3、盐酸;依据反应:甲+乙→沉淀,乙+丙→沉淀,乙和甲丙反应生成沉淀,丙+丁→沉淀,判断乙为Na2CO3、丁为盐酸、丙为AgNO3、甲为BaCl2。
8.下列除去杂质(括号内的物质为杂质)的方法中错误的是( )。
A.FeSO4(CuSO4):加足量铁粉后,过滤
B.CO(CO2):用NaOH溶液洗气后干燥
C.MnO2(KCl):加水溶解后,过滤、洗涤、烘干
D.CO2(HCl):用NaOH溶液洗气后干燥
答案:D
解析:选择除杂试剂至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质。A项,因铁粉能与CuSO4反应生成FeSO4和铜,铁粉不能与FeSO4反应,过量的铁粉和生成的铜可通过过滤除去,符合除杂原则,A正确;B项,CO2
7
能与NaOH溶液反应生成碳酸钠和水,CO不能与NaOH溶液反应,用NaOH溶液洗气后干燥符合除杂原则,B正确;C项,MnO2不溶于水,KCl溶于水,加水溶解后,过滤、洗涤、烘干,既除去了杂质,又没有引入新的杂质,符合除杂原则,C正确;D项,HCl能与NaOH溶液反应生成氯化钠和水,CO2能与NaOH溶液反应生成碳酸钠和水,用NaOH溶液洗气,除去了杂质,也反应掉了原物质,不符合除杂原则,D错误。
9.X溶液中含有下表离子中的某5种,且浓度均为0.1 mol·L-1(不考虑水的电离与离子水解)。向X溶液中加入足量稀盐酸,有无色气体生成,经分析反应前后阴离子种类没有变化。下列叙述不正确的是( )。
阳离子
阴离子
Na+ Ca2+
Fe2+ Al3+
Fe3+ Mg2+
OH- HCO3-
CO32- Cl-
NO3- SO42-
A.X溶液中不可能含有HCO3-或CO32-
B.生成无色气体的离子方程式为3Fe2++NO3-+4H+3Fe3++NO↑+2H2O
C.根据电荷守恒,原溶液中一定含Mg2+
D.X溶液中一定含3种阳离子、2种阴离子
答案:D
解析:加入足量稀盐酸后,阴离子种类没有变化,说明X溶液中不含OH-、HCO3-、CO32-,含有Cl-,有无色气体生成,应是NO3-与Fe2+在酸性条件下发生氧化还原反应生成NO气体:3Fe2++NO3-+4H+3Fe3++NO↑+2H2O,因此X溶液中肯定还有NO3-和Fe2+。由于Cl-、NO3-、Fe2+的浓度均为0.1mol·L-1,此时电荷已守恒,但已知X溶液中含有5种离子,则还应含有阴、阳离子各一种,阴离子只能是SO42-,则由电荷守恒可知,阳离子可能是Ca2+或Mg2+,由于Ca2+与SO42-不能大量共存,所以只能是Mg2+。综上所述,溶液中含有两种阳离子:Fe2+、Mg2+,三种阴离子:Cl-、NO3-、SO42-,故D项不正确。
10.根据下图海水综合利用的工业流程图,判断下列说法正确的是( )。
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
A.过程①的提纯是物理过程,过程②通过氧化还原反应可产生2 种单质
B.过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
C.在过程④⑥反应中每氧化0.2 mol Br-需消耗2.24 L Cl2
D.在过程③中将MgCl2·6H2O灼烧即可制得无水MgCl2
答案:B
7
解析:过程①的提纯是通过化学反应除去杂质,A错误;过程⑤反应生成硫酸和氢溴酸,溶液呈强酸性,生产中需解决其对设备的腐蚀问题,B正确;在过程④⑥反应中每氧化0.2molBr-需消耗标准状况下的2.24LCl2,C错误;MgCl2·6H2O在灼烧时会发生水解,D错误。
二、非选择题(本题共3个小题,共50分)
11.(14分)硼氢化钠(NaBH4)在化工等领域具有重要的应用价值。某研究小组采用偏硼酸钠(NaBO2)为主要原料制备NaBH4,其流程如下:
已知:NaBH4常温下能与水反应,可溶于异丙胺(沸点33 ℃)。
(1)在第①步反应加料之前,需要将反应器加热至100 ℃以上并通入氩气,该操作的目的是 ,原料中的金属钠通常保存在 中,实验室取用少量金属钠需要用到的实验用品有 、 、玻璃片和小刀等。
(2)第②步分离采用的方法是 ;第③步分出NaBH4并回收溶剂,采用的方法是 。
答案:(1)除去反应器中的水蒸气和空气 煤油 镊子 滤纸
(2)过滤 蒸馏
解析:(1)在加料之前将反应器加热至100℃,可以除去反应器中的水蒸气,通入氩气后排净反应器中的空气,防止Na、H2与空气中的O2反应;金属钠通常保存在煤油中;在取用钠时,应用镊子将钠从煤油中取出,并用滤纸吸干表面的煤油。
(2)经过第②步分离后得到溶液和固体,故第②步分离采用的方法为过滤;由于异丙胺的沸点低,故第③步分出NaBH4并回收溶剂可以采用蒸馏的方法。
12.(18分)我国青海查尔汗盐湖蕴藏着丰富的食盐资源。经分析知道,该湖水中含有高浓度的Na+、K+、Mg2+及Cl-等。利用盐湖水可得到某些物质。其主要工业流程如下:
请根据上述流程,回答下列问题:
(1)利用湖水得到晶体(A)的方法是 (填“降温”或“蒸发”)结晶法。
(2)操作Ⅰ的名称为 ,此操作适用于分离 。
(3)本流程中分别采用条件1和条件2获得不同晶体,所依据的物理性质是 。
a.摩尔质量 b.溶解度
7
c.溶解性 d.熔、沸点
(4)检验钾肥中是否含有Na+的实验方法是 ,若含有Na+,能观察到的现象是 。若需得到高纯度的钾肥,可以采用的提纯方法为 。
答案:(1)蒸发 (2)过滤 固体和液体混合物 (3)b (4)焰色反应 火焰呈黄色 重结晶法
解析:(1)天然湖水应采用蒸发的方法使溶质结晶。(2)固体和液体混合物的分离,应用过滤的方法。(3)由流程图可知,条件1和条件2温度不同,利用物质在不同温度下的溶解度不同进行分离。(4)检验Na+、K+等应用焰色反应。
13.(18分)某化学兴趣小组设计如下实验方案。将浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如下图所示:
请回答下列问题:
(1)装置B的作用是 。
(2)设计装置C的目的是验证SO2的 性,装置C中发生反应的离子方程式是 。装置D中NaOH全部转化为NaHSO3的标志是 。
(3)向NaHSO3溶液中加入NaClO溶液时,反应有三种可能的情况:
Ⅰ.HSO3-与ClO-恰好反应
Ⅱ.NaClO不足
Ⅲ.NaClO过量
甲同学分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请完成下表:(已知酸性H2SO3>H2CO3>HClO)
序号
实验操作
现象
结论
①
加入几小块CaCO3固体
有气泡产生
Ⅰ或Ⅱ
②
滴加少量淀粉-KI溶液,振荡
Ⅲ
③
滴加少量溴水,振荡
Ⅱ
④
滴加少量酸性KMnO4溶液,振荡
溶液呈紫色
(4)请设计简单实验证明室温下HSO3-的电离平衡常数Ka与水解平衡常数Kb的相对大小: 。
7
答案:(1)防倒吸(或安全瓶)
(2)还原 SO2+Br2+2H2O4H++SO42-+2Br- 溶液由红色变为无色
(3)②溶液变为蓝色 ③溴水褪色 ④Ⅰ或Ⅲ
(4)常温下,用pH试纸(或pH计)测定NaHSO3溶液的pH,若pH<7,则Ka>Kb;若pH>7,则KaKb,说明HSO3-的电离程度大于水解程度,溶液呈酸性,反之,溶液呈碱性,据此可通过测定溶液的pH来比较Ka和Kb的相对大小。
7