- 435.50 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
邢台市第八中学2018-2019年度第二学期期末考试试卷
高二年级 化学
一、单选题(每题3分,共18小题)
1. 下列说法中正确的是( )
A. 分子中键能越大,键长越长,则分子越稳定
B. 失电子难的原子获得电子的能力一定强
C. 在化学反应中,某元素由化合态变为游离态,该元素被还原
D. 电子层结构相同的不同离子,其半径随核电荷数增多而减小
【答案】D
【解析】
分子中键能越大,键长越短,则分子越稳定,A不正确。失电子难的原子获得电子的能力不一定强,例如稀有气体,B不正确。某元素由化合态变为游离态,该元素可能被还原,也可能被氧化,C不正确。所以正确的答案是D。
2.下列各组元素性质的递变情况错误的是
A. Li、Be、B原子的最外层电子数依次增多
B. P、S、Cl元素的最高化合价依次升高
C. N、O、F电负性依次增大
D. Na、K、Rb第一电离能逐渐增大
【答案】D
【解析】
【分析】
A.根据原子核外电子排布分析;
B.根据元素的最高正价等于核外最外层电子数分析;
C.同周期元素从左到右元素的电负性逐渐增强;
D.同主族元素从上到下元素的第一电离能依次减小。
【详解】A.Li、Be、B原子最外层电子数分别为1、2、3,则原子最外层电子数依次增多,选项A正确;
B.P、S、Cl元素最外层电子数分别为5、6、7,最高正价分别为+5、+6、+7
,最高正价依次升高,选项B正确;
C.同周期元素从左到右元素的电负性逐渐增强,则N、O、F电负性依次增大,选项C正确,
D.同主族元素从上到下元素的第一电离能依次减小,则Na、K、Rb元素的第一电离能依次减小,选项D错误。
答案选D。
3.关于元素周期律和元素周期表的下列说法中正确的是( )
A. 目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现
B. 按原子的电子构型,可将周期表分为5个区
C. 俄国化学家道尔顿为元素周期表的建立做出了巨大贡献
D. 同一主族的元素从上到下,金属性呈周期性变化
【答案】B
【解析】
A.随着科学技术的发展,人们可以不断合成一些元素,元素周期表中元素的种类在不断的增加,故A错误;B.按构造原理最后填入电子的能级符号,可将周期表分为5个区,5个区分别为s区、d区、p区、ds区和f区,故B正确;C.俄国化学家门捷列夫对元素周期表做出了巨大贡献,而不是道尔顿,故C错误;D.同一主族的元素从上到下,金属性逐渐增强,而不是呈周期性变化,故D错误;故选B。
4.将Fe、Cu、Fe2+、Fe3+和Cu2+盛于同一容器中充分反应,反应后Fe有剩余,则容器中其它存在的单质或离子只能是
A. Cu、Fe3+ B. Fe2+、Fe3+ C. Cu、Cu2+ D. Cu、Fe2+
【答案】D
【解析】
试题分析:金属的还原性为铁大于铜,相同条件下,铁先与铜反应,离子的氧化性为铁离子大于铜离子大于亚铁离子。相同条件下,铁离子先被还原,其次是铜离子,因为铁有剩余,所以铜不反应,反应后一定有铜剩余,铁与铁离子反应生成亚铁离子,铜离子都会发生反应生成亚铁离子和铜,所以反应后一定有亚铁离子和铜,选D。
考点: 铁的化学性质,铜及其重要化合物的性质
5.已知N2+O2===2NO为吸热反应,ΔH=+180 kJ·mol-1,其中N≡N、O===O键的键能分别为946 kJ·mol-1、498 kJ·mol-1,则N—O键的键能为( )
A. 1 264 kJ·mol-1 B. 632 kJ·mol-1 C. 316 kJ·mol-1 D. 1 624 kJ·mol-1
【答案】B
【解析】
反应热就是断键吸收的能量和形成化学键所放出的能量的差值,即946 kJ·mol-1+498 kJ·mol-1-2x=180 kJ·mol-1,解得x=632 kJ·mol-1 ,答案选B。
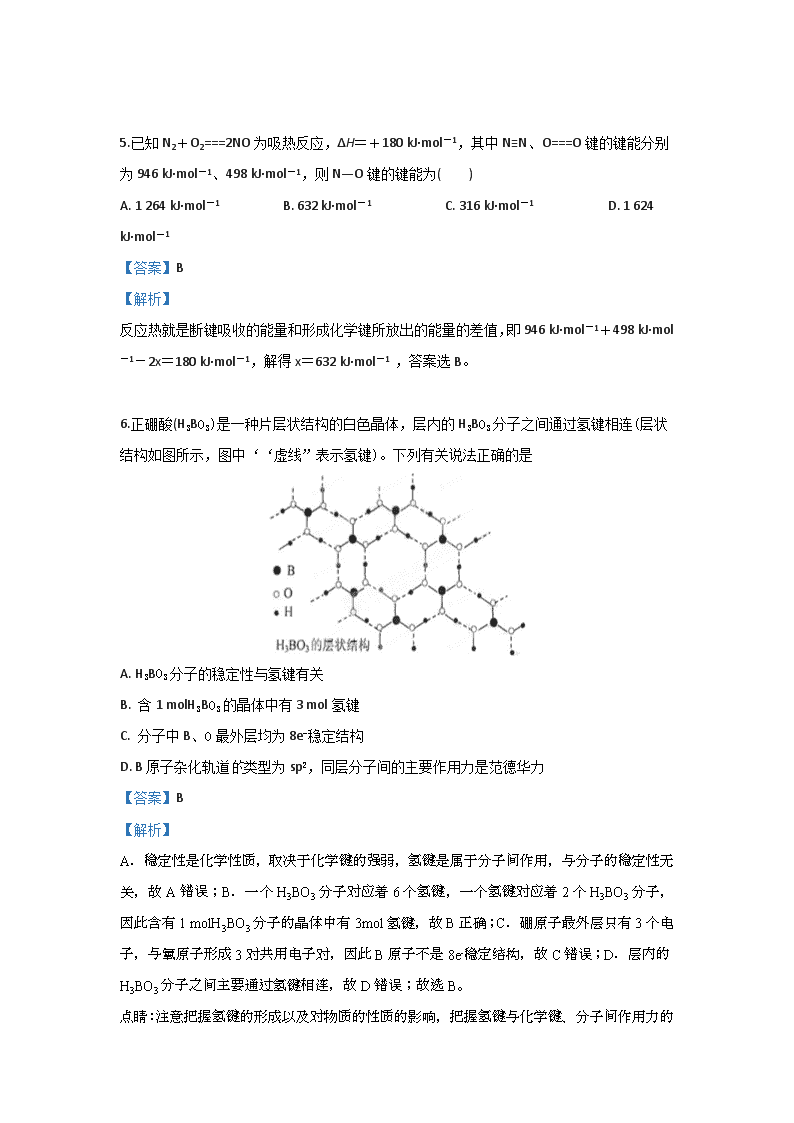
6.正硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子之间通过氢键相连(层状结构如图所示,图中‘‘虚线”表示氢键)。下列有关说法正确的是
A. H3BO3分子的稳定性与氢键有关
B. 含1 molH3BO3的晶体中有3 mol氢键
C. 分子中B、O最外层均为8e-稳定结构
D. B原子杂化轨道类型为sp2,同层分子间的主要作用力是范德华力
【答案】B
【解析】
A.稳定性是化学性质,取决于化学键的强弱,氢键是属于分子间作用,与分子的稳定性无关,故A错误;B.一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子,因此含有1 molH3BO3分子的晶体中有3mol氢键,故B正确;C.硼原子最外层只有3个电子,与氧原子形成3对共用电子对,因此B原子不是8e-稳定结构,故C错误;D.层内的H3BO3分子之间主要通过氢键相连,故D错误;故选B。
点睛:注意把握氢键的形成以及对物质的性质的影响,把握氢键与化学键、分子间作用力的区别。氢键是分子间作用力的一种,F、O、N的电负性较强,对应的氢化物分子之间能形成氢键,氢键的存在,多数物质的物理性质有显著的影响,如熔点、沸点,溶解度,粘度,密度等,存在氢键的物质,水溶性显著增强,分子间作用力增强,熔沸点升高或降低。关于氢键需要注意以下三点:①有氢键的分子间也有范德华力,但有范德华力的分子间不一定有氢键。②一个氢原子只能形成一个氢键,这就是氢键的饱和性。③分子内氢键基本上不影响物质的性质。
7.下列晶体熔化时不需要破坏化学键的是
A. 晶体硅 B. 食盐 C. 干冰 D. 金属钾
【答案】C
【解析】
试题分析:A.晶体硅 是原子晶体,熔化时断裂共价键,错误;B.食盐是离子晶体,熔化时断裂离子键,错误;C.干冰是分子晶体,熔化时破坏的是分子间作用力,与分子内的化学键无关,正确;D.金属钾是金属晶体,熔化时断裂的为金属键,错误.
考点:考查物质的熔化与晶体类型的关系的知识。
8. 根据等电子原理:由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,可互称为等电子体,它们具有相似的结构特性。以下各组粒子结构不相似的是
A. CO和N2 B. O3和NO2— C. CO2和N2O D. N2H4和C2H4
【答案】D
【解析】
试题分析:原子数和价电子数分别都相等的是等电子体,互为等电子体的微粒结构相似。则A、CO和N2互为等电子体,结构相似,A错误;B、臭氧和亚硝酸根离子互为等电子体,结构相似,B错误;C、CO2和N2O互为等电子体,结构相似,C错误;D、N2H4和C2H4的原子数相等,但最外层电子数不同,前者是14,后者是12,不能互为等电子体,则结构不同,D正确,答案选D。
考点:考查等电子体
9.据图装置和表中提供的物质完成实验室制取、收集表中气体并进行尾气处理(
省略夹持、加热及净化装置),最合理的选项是( )
选项
中的物质
中的物质
中收集的气体
中的物质
A
浓氨水
B
稀硫酸
石灰石
溶液
C
稀硝酸
D
浓盐酸
溶液
A. A B. B C. C D. D
【答案】D
【解析】
试题分析:A、氨气的收集错误,错误;B、试剂错误,应选用稀盐酸与石灰石反应,因为稀硫酸与石灰石反应生成微溶的硫酸钙附着在石灰石表面,阻碍反应进一步进行,错误;C、试剂错误,稀硝酸与铜反应生成NO,错误;D、正确。
考点:考查气体的制备与收集有关问题。
10.已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,下列说法错误的是( )
元素
I1
I2
I3
I4
X
500
4600
6900
9500
Y
580
1800
2700
11600
A. 元素X的常见化合价是+1价
B. 元素Y是第ⅢA族元素
C. 元素X与氯形成化合物时,化学式可能是XCl
D. 若元素Y处于第三周期,则它可与冷水剧烈反应
【答案】D
【解析】
【分析】
观察表中的数据,X元素的I1和I2相差很大,而I2、I3、I4的差距相差较小,则X易形成X+,即X位于I A族;同理,Y元素的I3和I4相差极大,则Y易形成Y3+,Y位于III A族。
【详解】A. 由电离能的数据可以推出X易形成+1价的化合物,A正确;
B. 由电离能的数据可以推出Y易形成+3价的化合物,则Y位于III A族,B正确;
C. X位于I A族,则其与氯形成化合物时,化学式可能是XCl,C正确;
D. Y位于III A族,若Y在第三周期,则Y为Al,它和沸水反应缓慢,不和冷水反应,D错误;
故合理选项D。
【点睛】对于元素的电离能而言,In和In+1的两个数据发生突变时,该元素易形成+n价的化合物,从而可以判断该元素在周期表中的族位置。
11.下列物质分类正确的是( )
A. SO2、SiO2、CO均为酸性氧化物 B. 稀豆浆、盐酸、氯化铁溶液均为胶体
C. 烧碱、纯碱、金属铜均为电解质 D. 盐酸、氯水、氨水均为混合物
【答案】D
【解析】
【详解】A. 酸性氧化物指能和碱反应,只生成盐和水的氧化物,CO不是酸性氧化物,A错误;
B. 盐酸、氯化铁溶液不属于胶体,B错误;
C. 电解质指在熔融状态下或者水溶液中,能导电的化合物,所以铜不是电解质,C错误;
D. 盐酸是HCl
的水溶液,氯水是将氯气通入到水中形成的溶液,氨水是将氨气通入到水中的溶液,则这三种溶液都是混合物,D正确;
故合理选项为D。
【点睛】电解质指在熔融状态下或者水溶液中,能导电的化合物。
12.X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A. 原子半径:W>Z>Y>X>M
B. XZ2、X2M2、W2Z2均为直线型的共价化合物
C. 由X元素形成的单质不一定是原子晶体
D. 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
【答案】C
【解析】
正确答案:C
由题意可知,X、Y、Z、M、W这五种短周期元素的排列,不是按原子序数依次递增排列的,其中只有X、Y、Z三种元素是原子序数依次递增的同周期元素,由X、Y、Z的最外层电子数之和为15,X与Z可形成XZ2分子,可推出X、Y、Z分别为C、N、O三种元素;再根据Y与M形成的气态化合物在标准状况下的密度,就可计算出该气态化合物的相对分子质量为17,从而确定M为H元素,最后根据W的质子数是X、Y、Z、M四种元素质子数之和的1/2,推出W为Na 元素。所以,原子半径应是W>X>Y>Z>M(即Na>C>N>O>H),A选项错。B选项中CO2、C2H2均为直线型共价化合物,而Na2O2不是直线型共价化合物(折线型化合物),B错误。C选项是正确的,例如石墨、C60、碳纳米管、石墨烯等碳单质就不是原子晶体。D选项中,X、Y、Z、M四种元素可形成化合物 (NH4)2CO3、NH4HCO3、CO(NH2)2(尿素)等,前二种为离子化合物,而尿素为共价化合物,所以D错。
【此处有视频,请去附件查看】
13.下列关于晶体的说法中正确的是( )
A. 离子晶体中每个离子周围均吸引着6个带相反电荷的离子
B. 金属晶体的熔点和沸点都很高
C. 分子晶体中都存在范德华力,可能不存在共价键
D. 原子晶体中的相邻原子间只存在非极性共价键
【答案】C
【解析】
【详解】A. 离子晶体中每个离子周围可能吸引着6个带相反电荷的离子,比如NaCl晶体;也可能吸引着8个带相反电荷的离子,比如CsCl晶体;A错误;
B. 金属晶体的熔点和沸点很高,但是跨度也很大,比如金属汞在常温下为液态,即其熔点低,B错误;
C. 分子晶体中都存在范德华力,可能不存在共价键,比如稀有气体形成的分子晶体,C正确;
D. 原子晶体中的相邻原子间可能只存在非极性共价键,比如硅晶体、金刚石;也可能只存在极性共价键,比如SiO2晶体;D错误;
故合理选项为C。
14.设NA表示阿伏加德罗常数,下列叙述中不正确的是
A. 标准状况,11.2L氧气所含的原子数为NA
B. 1.8g的NH4+离子中含有的电子数为NA
C. 常温常压下,48gO3和O2的混合气体含有的氧原子数为3NA
D. 2.4g金属镁变为镁离子时失去的电子数为0.1NA
【答案】D
【解析】
试题分析:2.4gMg为0.1mol,转变为Mg2+时失去电子数为0.2mol,D错误,其余的都正确。答案选D。
考点:阿伏伽德罗常数
点评:阿伏伽德罗常数是历年高考的“热点”问题。多年来全国高考化学试题出现的几率为100%。这双因为它既考查了学生对物质的量与粒子数、质量、气体体积和物质的量浓度之间的关系,又可以与物质结构、盐类水解、弱电解质的电离等其他的概念性知识点结合成综合性习题。
15.表中对于相关物质的分类全部正确的是( )
选项
纯净物
混合物
碱性氧化物
非电解质
A
液氯
漂白粉
Al2O3
CO
B
醋酸
浓硫酸
Na2O2
乙醇
C
碱石灰
盐酸
K2O
Cl2
D
胆矾
水玻璃
CaO
SO2
A. A B. B C. C D. D
【答案】D
【解析】
【详解】A. Al2O3属于两性氧化物,A错误;
B. Na2O2属于过氧化物,B错误;
C. 碱石灰是CaO和NaOH的混合物,Cl2既不是电解质,也不是非电解质,C错误;
D. 水玻璃是Na2SiO3的水溶液,D正确;
故合理选项为D。
【点睛】电解质和非电解质的研究对象都是化合物,所以单质不属于电解质,或非电解质。
16.现有一种蓝色晶体,可表示为MxFey(CN)6,经X 射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上。其晶体中阴离子的最小结构单元如下图所示。下列说法中正确的是( )
A. 该晶体的化学式为MFe2(CN)6
B. 该晶体属于离子晶体,M呈+3价
C. 该晶体属于离子晶体,M呈+2价
D. 晶体中与每个Fe3+距离最近且等距离的CN-为3个
【答案】A
【解析】
【分析】
Fe3+和Fe2+互相占据立方体互不相邻的顶点,则该结构单元中,所含Fe3+有个,Fe2+有个,CN-有个。由于该晶体的化学式为MxFey(CN)6,所以y=2,且该晶体的化学式中含有1个Fe3+、1个Fe2+,所以x为1,即该化学式为MFe2(CN)6。
【详解】A. 经计算得知,该结构单元中,含有个Fe2+、个Fe3+、3个CN-。由于该晶体的化学式为MxFey(CN)6,则y=2,x=1,即该化学式为MFe2(CN)6,A正确;
B. 从构成晶体的微粒来看,该晶体为离子晶体;由于化学式为MFe2(CN)6,M呈+1价,B错误;
C. 该晶体为离子晶体;由于化学式为MFe2(CN)6,M呈+1价,C错误;
D. 晶体中与每个Fe3+距离最近且等距离的CN-为6个,D错误;
故合理选项为A。
17.下列物质的变化规律,与共价键的键能有关的是
A. F2、Cl2、Br2、I2的熔、沸点逐渐升高
B. HF的熔、沸点高于HCl
C. 金刚石的硬度、熔点、沸点都高于晶体硅
D. NaF、NaCl、NaBr、NaI的熔点依次降低
【答案】C
【解析】
【详解】A.F2、Cl2、Br2、I2 属于分子晶体,影响熔沸点的因素是分子间作用力的大小,物质的相对分子质量越大,分子间作用力越强,沸点越高,与共价键无关系,故A不符合题意;
B.HF的沸点较HCl高是因为HF分子间存在氢键,其作用力较HCl分子间作用力大,与共价键无关,故B不符题意;
C.金刚石、晶体硅属于原子晶体,原子之间存在共价键,原子半径越小,键能越大,熔沸点越高,与共价键的键能大小有关,故C符合题意;
D.NaF、NaCl、NaBr、NaI属于离子晶体,离子半径越大,键能越小,熔沸点越低,与离子键的键能大小有关,故D不符合题意;
答案选C
【点睛】本题主要考查同种类型的晶体熔、沸的高低的比较,一般情况下,原子晶体中共价键键长越短,熔沸点越高;金属晶体中,形成金属键的金属阳离子半径越小,电荷数越多,金属键越强,熔沸点越高;分子晶体中形成分子晶体的分子间作用力越大,熔沸点越高;离子晶体中形成离子键的离子半径越小,电荷数越多,离子键越强,熔沸点越高。
18.CaC2晶体的晶胞结构与NaCl晶体的相似(如下图所示),但由于CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为( )
A. 4 B. 6 C. 8 D. 12
【答案】A
【解析】
【详解】CaC2晶体的晶胞结构与NaCl晶体的相似,且CaC2晶体中哑铃形C22-使晶胞沿一个方向拉长,则原先的正方体构型变为了长方体构型(可以看成时长方体的高被拉长,长和宽依旧不变),则1个Ca2+周围距离最近的C22-数目为4,故合理选项为A。
【点睛】对于此类题目,要先理解题目的意思,再结合立体几何知识去分析,得到答案。
二、填空题(共46分)
19.A、B、C、D、E五种常见元素的基本信息如下所示:A元素的一种原子的原子核内没有中子,B是所有元素中电负性最大的元素,C的基态原子2p轨道中有三个未成对电子,D是主族元素且与E同周期,其最外能层上有两个运动状态不同的电子,E能形成红色(或砖红色)的E2O和黑色的EO 两种氧化物。请回答下列问题:
(1)写出E元素原子基态时的电子排布式:______________。
(2)C元素的第一电离能比氧元素的第一电离能__________(填“大”或“小”)。
(3)与D元素同周期且未成对电子数最多的元素是__________。
(4)A、C、E三种元素可形成[E(CA3)4]2+配离子,其中存在的化学键类型有___(填字母)。
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+配离子具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl-取代时,能得到两种不同结构的产物,则[E(CA3)4 ]2+的空间构型为__________(填字母)。
a.平面正方形 b.正四面体形 c.三角锥形 d.V形
【答案】 (1). 1s22s22p63s23p63d104s1 (2). 大 (3). Cr (4). ①③ (5). a
【解析】
【分析】
A元素的一种原子的原子核内没有中子,则A为H。B是所有元素中电负性最大的元素,则B为F。C的基态原子2p轨道中有三个未成对电子,则C为N。E能形成红色(或砖红色)的E2O和黑色的EO,则E为Cu。D是主族元素且与E同周期,其最外能层上有两个运动状态不同的电子,则D为Ca。综上所述,A为H,B为F,C为N,D为Ca,E为Cu。
【详解】(1)E为Cu,29号元素,其基态原子的核外电子排布式为1s22s22p63s23p63d104s1;
(2)C为N,其非金属性比O弱,由于氮元素的2p轨道电子处于半充满稳定状态,其第一电离能要比O的大;
(3)D为Ca,位于第四周期,该周期中未成对电子数最多的元素是Cr(核外电子排布式为1s22s22p63s23p63d54s1);
(4)A、C、E三种元素可形成[Cu(NH3)4]2+配离子,其化学键Cu-N属于配位键,N-H属于极性共价键,故合理选项为①③;当[Cu(NH3)4]2+中的两个NH3被两个Cl-取代时,能得到两种不同结构的产物,则说明该离子的空间构型为平面正方形(参考甲烷的空间构型的验证实验)。
20.根据所学知识回答下列问题。
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的和单质燃烧时均放出大量热,可用作燃料.已知和为短周期元素,其原子的第一至第四电离能如下表所示:
电离能/
932
1821
15390
21771
738
1451
7733
10540
①某同学根据上述信息,推断的核外电子排布如图所示,该同学所画的电子排布图违背了__________, 元素位于周期表五个区域中的________ 区。
②分子的中心原子采取___杂化, 的空间构型为________。
(2)原子或离子外围有较多能量相近的空轨道,所以其能与一些分子或离子形成配合物。
① 与原子或离子形成配合物分子或离子应具备的结构特征是_________。
② 六氰合亚铁离子中不存在____________(填字母)。
A.共价键 B.非极性键 C.配位键 D. 键
写出一种与互为等电子体的单质的分子式:___________ 。
(3)—种合金的晶胞结构如图,请据此回答下列问题:
① 该合金的化学式为____________。
② 若晶体的密度为 ,则该晶胞棱长为____________ (设为阿伏加德罗常数的值,用含和的代数式表示,不必化简)。
【答案】 (1). 能量最低原理 (2). s (3). (4). 直线形 (5). 具有孤对电子
(6). B (7). (8). (9).
【解析】
【详解】(1)①由图1电子轨道排布图可知,3s能级未填满就填充3p能级,2p能级的轨道内有自旋方向相同的2个电子,所以违背能量最低原理与泡利原理.由表中电离能可知,二者第三电离能剧增,故为+2价,都为短周期元素,故A为铍、B为Mg,镁价层电子排布为3s2,处于周期表中s区,故答案为:能量最低原理;s;
②BeCl2分子中Be的成2个σ键,杂化轨道数为2,采取sp杂化,没有孤对电子对,为直线型,故答案为:sp;直线;
(2)①形成配离子具备的条件为:中心原子具有空轨道,配体具有孤对电子对,故答案为:具有孤对电子;
②六氰合亚铁离子[Fe(CN)6]4-中Fe2+与CN-形成配位键,CN-中存在C≡N三键,为极性共价键,三键中有1个σ键2个π键,所以CN-中共价键、配位键、σ键、π键;CN-中C原子与1个单位负电荷用N原子替换可得CN-等电子体的单质为N2,故答案为:B;N2;
(3)①由晶胞图示可知,晶胞中含有4个Al原子,且都位于晶胞内部,则晶胞平均含有4个Al,晶胞中Fe位于顶点的有8个,位于面心的有6个,位于棱上的有12个,位于体心的有1个,含有Fe原子数目为8×+6×+12×+1=8,Fe与 Al原子数目之比为8:4=2:1,故该合金的化学式为Fe2Al,故答案为:Fe2Al;
②一个晶胞中含有8个Fe原子和4个Al原子,晶胞的质量为g,棱长为,故答案为:。
21.A、B、C、D四种可溶性盐,阳离子分别可能是Ba2+、Na+、Ag+、Cu2+中的某一种,阴离子分别可能是中的某一种。
(1) C的溶液呈蓝色,向这四种盐溶液中分别加盐酸,B盐有沉淀产生,D盐有无色无味气体逸出。则它们的化学式应为:
A_______,B_______,C_______,D_______
(2)写出下列反应的离子方程式:
①A+C__________________________。
②D+盐酸________________________。
【答案】 (1). BaCl2 (2). AgNO3 (3). CuSO4 (4). Na2CO3 (5). Ba2++SO42-=BaSO4↓ (6). CO32-+2H+=H2O +CO2↑
【解析】
【分析】
A、B、C、D都是可溶性盐,Ag+只能和搭配,只能和剩余的Na+搭配,在此基础上,和Cu2+搭配,则Ba2+和Cl-搭配,即这四种盐为AgNO3、Na2CO3、CuSO4、BaCl2。C的溶液呈蓝色,则C为CuSO4。B+HCl产生沉淀,则B为AgNO3。D+HCl产生气体,则D为Na2CO3。所以A为BaCl2。综上所述,A为BaCl2,B为AgNO3,C为CuSO4,D为Na2CO3。
【详解】(1)经分析这四种盐为AgNO3、Na2CO3、CuSO4、BaCl2,结合题中给出的实验现象,可以推出A为BaCl2,B为AgNO3,C为CuSO4,D为Na2CO3;
(2)A+C为BaCl2和CuSO4的反应,其离子方程式为:Ba2++SO42-=BaSO4↓;D+盐酸为Na2CO3和盐酸的反应,其离子方程式为:CO32-+2H+=H2O +CO2↑。
22.某课外活动小组利用下列化学反应在实验室中制备氯气,并进行有关氯气性质的研究。
(1)该小组同学欲用图所示仪器及试剂(不一定全用)制备并收集纯净、干燥的氯气。
① 应该选择的仪器是__________(填字母)。
② 将各仪器按先后顺序连接起来,应该是a接__________,__________接__________,__________接__________,__________接h(用导管口处的字母表示)。
③ 浓盐酸与二氧化锰反应的离子方程式为__________。
(2)该小组同学设计分别利用图所示装置探究氯气的氧化性。
①G中的现象是__________,原因是__________(用化学方程式表示)。
②H中的现象是__________。
【答案】 (1). ABCDE (2). d (3). e (4). f (5). g (6). b (7). c (8). MnO2+ 4H++2Cl- Mn 2++Cl2↑+2H2O (9). 溶液由无色变为蓝色 (10). Cl2+2KI= I2+2KCl (11). 产生白色沉淀
【解析】
【分析】
本题主要考察氯气的制备,及氯气的化学性质的探究。Cl2的实验室制备装置有:A(发生装置)、C(除去HCl气体)、D(干燥装置)、B(收集装置)、E(尾气处理)。题中还要探究Cl2的氧化性,Cl可以将I-氧化为I2,也可以将氧化为。
【详解】(1)①Cl2的实验室制备有A(发生装置)、C(除去HCl气体)、D(干燥装置)、B(收集装置)、E(尾气处理);
②装置的连接顺序为ACDBE,则导管口为a-d,e-f,g-b,c-h;
③该反应的离子方程式为:;
(2)①试管中的反应方程式为:,生成的I2可以使淀粉溶液变蓝;
②该实验中涉及的化学反应有:,,所以可以看到H中有白色沉淀生成。
23.已知元素周期表中,元素Q、R、W、Y与元素X相邻。Y
的最高价氧化物对应的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是__________。
(2)R和Y形成的化合物中,R呈现最高化合价的化合物的化学式是____。
【答案】 (1). 原子晶体 (2). As2S5
【解析】
【分析】
W的氯化物分子呈正四面体结构,则W为C或Si。若W为C,则中心元素X为Si,右边的含氧酸H3PO4不是强酸,不符合题意。所以W为Si,X为P,Y为S。W与Q形成高温陶瓷,则Q为N,R为As。如下表所示:
C
N(Q)
Si(W)
P(X)
S(Y)
As(R)
【详解】(1)W为Si,其氧化物为SiO2,则其氧化物的晶体类型为原子晶体;
(2)R为As(V A族),Y为S(VI A族),则R呈现最高化合价的化合物的化学式是As2S5。