- 588.50 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
六、化学平衡 选择题 练习(一)
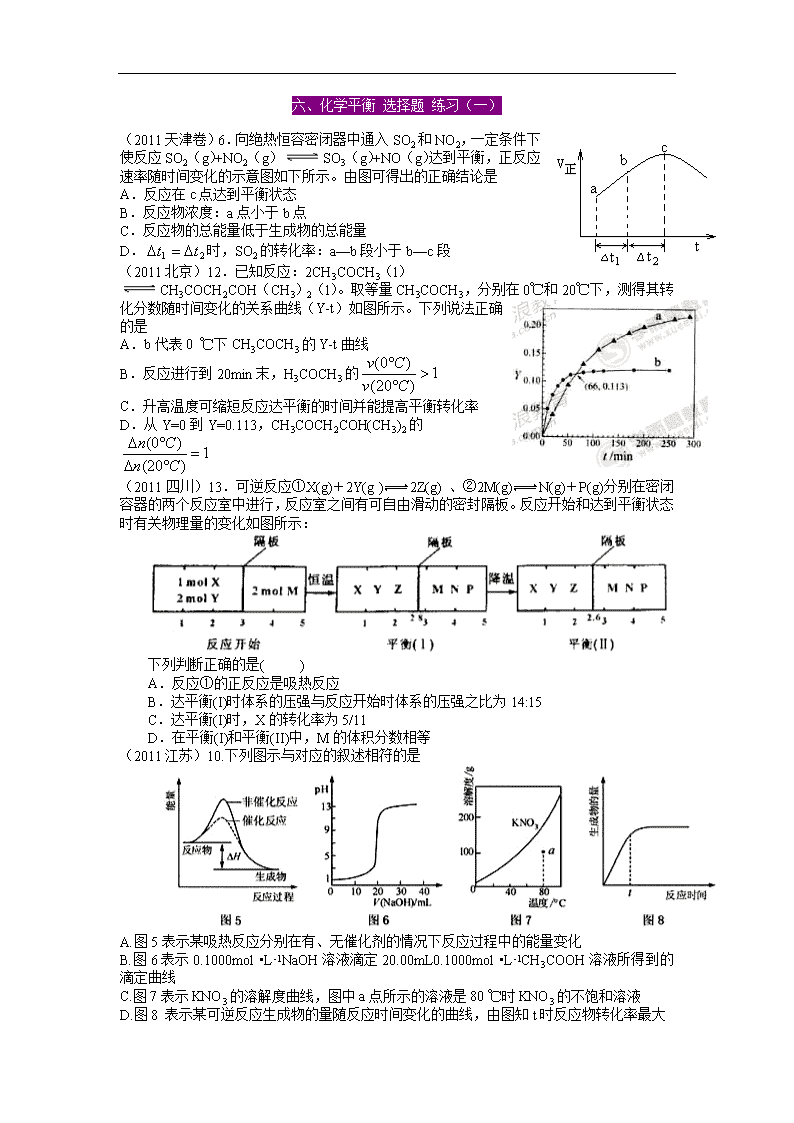
(2011天津卷)6.向绝热恒容密闭器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g)SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是
A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量低于生成物的总能量
D.时,SO2的转化率:a—b段小于b—c段
(2011北京)12.已知反应:2CH3COCH3(l)CH3COCH2COH(CH3)2(l)。取等量CH3COCH3,分别在0℃和20℃下,测得其转化分数随时间变化的关系曲线(Y-t)如图所示。下列说法正确的是
A.b代表0 ℃下CH3COCH3的Y-t曲线
B.反应进行到20min末,H3COCH3的
C.升高温度可缩短反应达平衡的时间并能提高平衡转化率
D.从Y=0到Y=0.113,CH3COCH2COH(CH3)2的
(2011四川)13.可逆反应①X(g)+2Y(g )2Z(g) 、②2M(g)N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有可自由滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:
下列判断正确的是( )
A.反应①的正反应是吸热反应
B.达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C.达平衡(I)时,X的转化率为5/11
D.在平衡(I)和平衡(II)中,M的体积分数相等
(2011江苏)10.下列图示与对应的叙述相符的是
A.图5表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图6表示0.1000mol •L-1NaOH溶液滴定20.00mL0.1000mol •L-1CH3COOH溶液所得到的滴定曲线
C.图7表示KNO3的溶解度曲线,图中a点所示的溶液是80 ℃时KNO3的不饱和溶液
D.图8 表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大
(2011江苏)15.700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:
CO(g)+H2O(g) CO2+H2(g)
反应过程中测定的部分数据见下表(表中t1>t2):
反应时间/min
n(CO)/mol
H2O/ mol
0
1.20
0.60
t1
0.80
t2
0.20
下列说法正确的是(双选)
A.反应在t1min内的平均速率为
B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)=0.4mol。
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
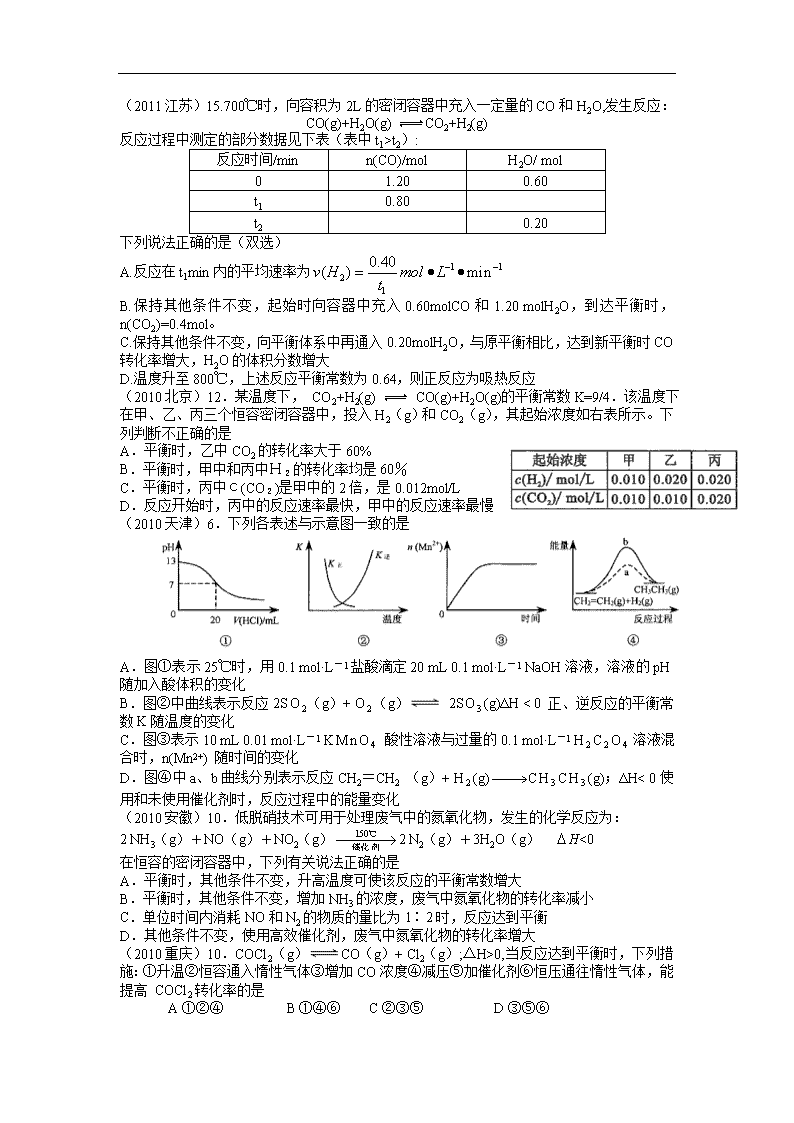
(2010北京)12.某温度下, CO2+H2(g) CO(g)+H2O(g)的平衡常数K=9/4.该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如右表所示。下列判断不正确的是
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
(2010天津)6.下列各表述与示意图一致的是
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g)+ O2(g) 2SO3(g)ΔH < 0 正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol·L-1 KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2 (g)+ H2(g)CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
(2010安徽)10.低脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:
2 NH3(g)+NO(g)+NO2(g)2 N2(g)+3H2O(g) H<0
在恒容的密闭容器中,下列有关说法正确的是
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小
C.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
D.其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大
(2010重庆)10.COCl2(g)CO(g)+ Cl2(g);△H>0,当反应达到平衡时,下列措施:①升温②恒容通入惰性气体③增加CO浓度④减压⑤加催化剂⑥恒压通往惰性气体,能提高 COCl2转化率的是
A ①②④ B ①④⑥ C ②③⑤ D ③⑤⑥
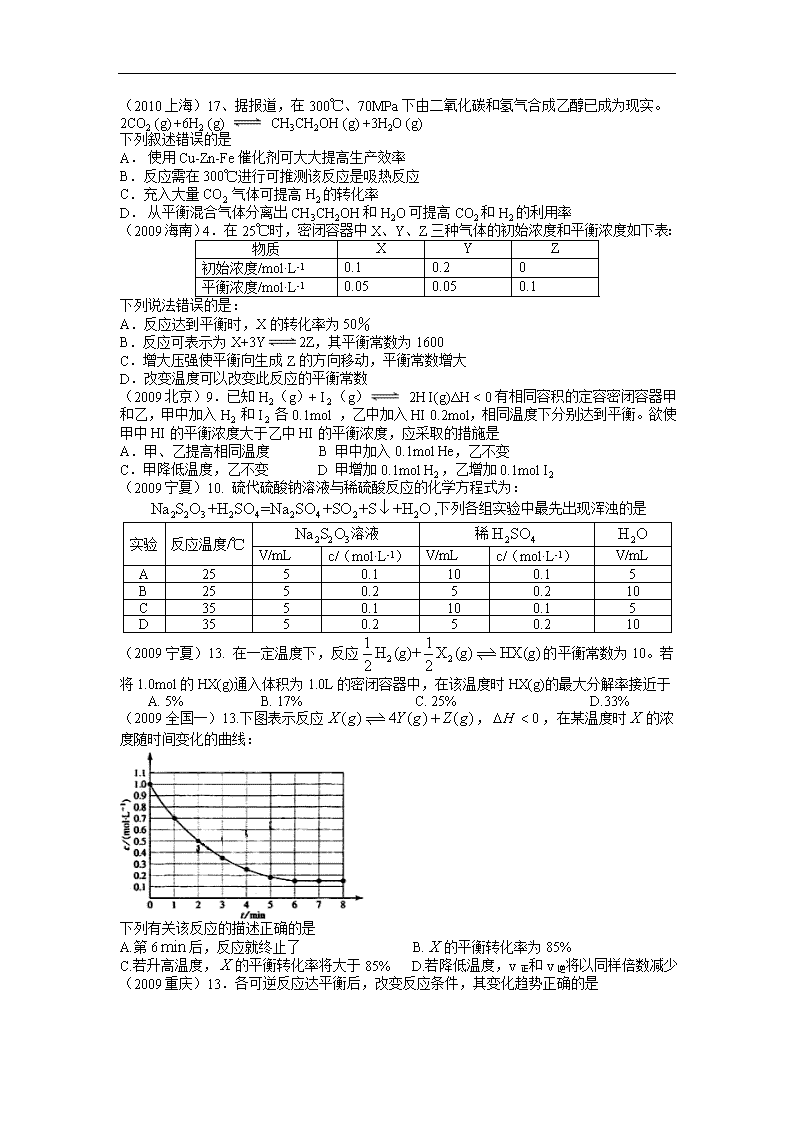
(2010上海)17、据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。
2CO2 (g) +6H2 (g) CH3CH2OH (g) +3H2O (g)
下列叙述错误的是
A. 使用Cu-Zn-Fe催化剂可大大提高生产效率
B. 反应需在300℃进行可推测该反应是吸热反应
C. 充入大量CO2 气体可提高H2的转化率
D. 从平衡混合气体分离出CH3CH2OH和H2O可提高CO2和H2的利用率
(2009海南)4.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质
X
Y
Z
初始浓度/mol·L-1
0.1
0.2
0
平衡浓度/mol·L-1
0.05
0.05
0.1
下列说法错误的是:
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X+3Y2Z,其平衡常数为1600
C.增大压强使平衡向生成Z的方向移动,平衡常数增大
D.改变温度可以改变此反应的平衡常数
(2009北京)9.已知H2(g)+ I2(g) 2HI(g)ΔH < 0有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol ,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
A.甲、乙提高相同温度 B 甲中加入0.1mol He,乙不变
C.甲降低温度,乙不变 D 甲增加0.1mol H2,乙增加0.1mol I2
(2009宁夏)10. 硫代硫酸钠溶液与稀硫酸反应的化学方程式为:
,下列各组实验中最先出现浑浊的是
实验
反应温度/℃
溶液
稀
V/mL
c/(mol·L-1)
V/mL
c/(mol·L-1)
V/mL
A
25
5
0.1
10
0.1
5
B
25
5
0.2
5
0.2
10
C
35
5
0.1
10
0.1
5
D
35
5
0.2
5
0.2
10
(2009宁夏)13. 在一定温度下,反应的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于
A. 5% B. 17% C. 25% D.33%
(2009全国一)13.下图表示反应,,在某温度时的浓度随时间变化的曲线:
下列有关该反应的描述正确的是
A.第6后,反应就终止了 B.的平衡转化率为85%
C.若升高温度,的平衡转化率将大于85% D.若降低温度,v正和v逆将以同样倍数减少
(2009重庆)13.各可逆反应达平衡后,改变反应条件,其变化趋势正确的是
(2009四川)13.在一体积可变的密闭容器中,加入一定量的X、Y,发生反应
mX(g) nY(g) △H=Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
气体体积
C(Y)/mol·L-1
温度℃
1
2
3
100
1.00
0.75
0.53
200
1.20
0.90
0.63
300
1.30
1.00
0.70
下列说法正确的是
A.m>n B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
(2009广东)15、取五等份NO2 ,分别加入温度不同、容积相同的恒容密闭容器中,发生反应:2NO2(g) N2O4(g),ΔH<0 反应相同时间后,分别测定体系中NO2的百分量(NO2%),并作出其随反应温度(T)变化的关系图。下列示意图中,可能与实验结果相符的是(双选)
(2011天津卷)6.D(2011北京)12.D(2011四川)13.C(2011江苏)10.C
(2011江苏)15.BC(2010北京)12.C(2010天津)6.B(2010安徽)10.C
(2010重庆)10.B(2010上海)17、B(2009海南)4.C(2009北京)9.C
(2009宁夏)10.D(2009宁夏)13.B(2009全国一)13.B(2009重庆)13.D
(2009四川)13.C(2009广东)15、BD
六、化学平衡 选择题 练习(二)
(2009江苏)14.I2在KI溶液中存在下列平衡:
I2(aq)+I-(aq) I3-(aq)
某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是(双选)
A. 反应I2(aq)+I-(aq)I3-(aq)的H>0
B. 若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2
C. 若反应进行到状态D时,一定有v正>v逆
D. 状态A与状态B相比,状态A的c(I2)大
(2008全国一)11.已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g). △H= -1025KJ/mol该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
(2008全国二)13.在相同温度和压强下,对反应CO2(g) + H2(g)CO(g) + H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
实验
CO2
H2
CO
H2O
甲
a mol
a mol
0 mol
0 mol
乙
2a mol
a mol
0 mol
0 mol
丙
0 mol
0 mol
a mol
a mol
丁
a mol
0 mol
a mol
a mol
上述四种情况达到平衡后,n (CO)的大小顺序是
A.乙=丁>丙=甲 B.乙>丁>甲>丙 C.丁>乙>丙=甲 D.丁>丙>乙>甲
(2008宁夏卷)12.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
① NH4I(s) NH3(g)+HI(g) ②2HI(g) H2(g)+I2(g)
达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下反映①的平衡常数为
T1
碘化氢的量
时 间
T2
A.9 B.16 C.20 D. 25
(2008四川卷)8.在密闭容器中进行如下反应:H2(g) +I2(g) 2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所示.符合图示的正确判断是
A.T1>T2,ΔH>0 B.T1>T2,ΔH<0
C.T1<T2,ΔH>0 D.T1<T2,ΔH<0
(2008北京卷)12.工业上制备纯硅反应的热化学方程式如下:
SiCl4(g)+2H2(g)=Si(s)+4HCl(g);mol(Q>0)
某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(Lmin)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
(2008山东卷)14.高温下,某反应达平衡,平衡常数K=
。恒容时,温度升高,H2 浓度减小。下列说法正确的是
A.该反应的焓变为正值 B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO + H2 CO2 + H2
(2008广东卷B)8.将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g) 2HBr(g)平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是
A.a>b B.a=b C.a<b D.无法确定
(2007北京)10.一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:
2X(g)+Y(g)Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
A.以X浓度变化表示的反应速率为0.001mol/(L·S)
B.将容器体积变为20L,Z的平衡浓度变为原来的
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的△H>0
(2007宁夏)13.一定条件下,合成氨气反应达到平衡时,测得混合气体中氨气的体积分数为20.0% ,与反应前的体积相比,反应后体积缩小的百分率是
A.16.7% B.20.0% C.80.0% D.83.3%
(2007全国1)13.右图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相适合的是
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态I后,增大反应物浓度,平衡发生移动,达到平衡态II
C.该反应达到平衡态I后,减小反应物浓度,平衡发生移动,达到平衡态II
D.同一反应物在平衡态I和平衡态II时浓度不相等
(2007全国2)6.已知:C(s)+CO2(g)2CO(g) △H>0。该反应的达到平衡后,下列条件有利于反应向正方向进行的是
A 升高温度和减小压强 B 降低温度和减小压强
C 降低温度和增大压强 D 升高温度和增大压强
(2007四川)13.向某密闭容器中充人1molCO和2molH2O(g),发生反应:CO+H2O(g) CO2+H2。
当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
A.0.5 molCO+2molH2O(g)+1 molCO2+1 molH2
B.1 molCO+1 molH2O(g)+1 molCO2+1 molH2
C.0.5 molCO+1.5 molH2O(g)+0.4molCO2+0.4molH2
D.0.5 molCO+1.5 molH2O(g)+0.5molCO2+0.5molH2
答案
(2009江苏)14.BC(2008全国一)11.C(2008全国二)13.A(2008宁夏卷)12.C
(2008四川卷)8.D(2008北京卷)12.D(2008山东卷)14.A(2008广东卷B)8.A
(2007北京)10、A(2007宁夏)13.A
(2007全国1)13.C(2007全国2)6.A(2007四川)13.B