- 322.50 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
化学能与热能
第2课时
[教学目标]
1、能根据事实判断吸热反应、放热反应,能说出中和热的涵义。
2、了解化学能的应用。
3、通过实验探究体验科学研究的一般过程,了解科学研究的基本方法。
4、通过实验发展学习化学的兴趣,进一步形成交流、合作、反思、评价的学习习惯。
【教学重点】 进一步理解化学反应与能量之间的变化关系。
【教学难点】 化学能与热能的转化关系。
【教学过程】
[复习] 两条基本的自然定律:质量守恒定律和能量守恒定律。
[板书] 二、化学能与热能的相互转化
生石灰与水反应生成糊状的氢氧化钙,试管发烫,说明反应放出了热能。
[设问]热能是能量的一种表现形式。那么,除刚才的这个反应,其它的化学反应过程中是不是也会有能量变化呢?其表现形式又是怎样的?根据你已有的知识经验举例说明。
[学生举例]
[归纳小结]
物质在发生化学反应的同时还伴随着能量的变化,这些能量变化通常又表现为热量的变化。
[设疑]
那么,化学变化中热量变化的具体形式又有哪些呢?这将是我们本节课研究的主要内容。下面我们通过实验来进行研究、探讨,从中我们还可以了解到科学研究的一般过程和方法。
[分组实验] 见教材P33实验2-1。
[思考与讨论]
用眼睛不能直接观察到反应中的热量变化,那么,你将采取哪些简单易行的办法来了解反应中的热量变化?各有什么优缺点?
[交流与评价]
1、实验过程中,你自己最满意的做法是什么?最不满意的做法是什么?
2、在思考、讨论的过程中,其他同学给了你哪些启示?你又给了他们哪些启示?
[演示实验] 见教材实验2-2
[思考与讨论]
1、通过观察实验现象,你得出了哪些结论?写出反应方程式。
2、你觉得做这个实验时需要注意哪些问题?还可以做哪些改进?实验中对你最有启发的是什么?
[小结] 化学反应中的能量变化经常表现为热量的变化,有的放热,有的吸热。
[设疑] 通过前面的学习,我们知道燃烧反应、金属与酸的反应是放热的,而氢氧化钡晶体与氯化铵晶体的反应是吸热的,那么,作为一类重要而常见的反应,酸与碱的中和反应是放热的还是吸热的呢?下面,请同学们自己通过实验来揭开这个秘密。
[分组实验] 建议按教参P34页的三组对比实验进行。
[讨论与交流]
1、通过实验,你得出什么结论?如何解释?
2、通过这个实验,你学到了哪些知识?学会了哪些研究方法?
3、要明显的感知或测量反应中的热量变化,实验中应注意哪些问题?
[教师讲解]
1、中和反应都是放热反应。
2、三个反应的化学方程式虽然不同,反应物也不同,但本质是相同的,都是氢离子与氢氧根离子反应生成水的反应,属于中和反应。由于三个反应中氢离子与氢氧根离子的量都相等,生成水的量也相等,所以放出的热量也相等。
3、中和热:酸与碱发生中和反应生成1mol水所释放的热量称为中和热。
4、要精确地测定反应中的能量变化,一是要注重“量的问题”,二是要最大限度地减小实验误差。
[总结和板书计划]
二、化学能与热能的相互转化
1、两条基本的自然定律
(1)质量守恒定律:
(2)能量守恒定律:一种能量可以转化为另一种能量,
总能量保持不变。
(1)放热反应
(2)吸热反应
根据能量变化情况角度分:
(1)化学上把有热量放出的化学反应叫做放热反应
(2)化学上把吸收热量的化学反应叫做吸热反应
规律:
能量
反应过程
反应过程
反应物
生成物
能量
放热反应
吸热反应
反应物
生成物
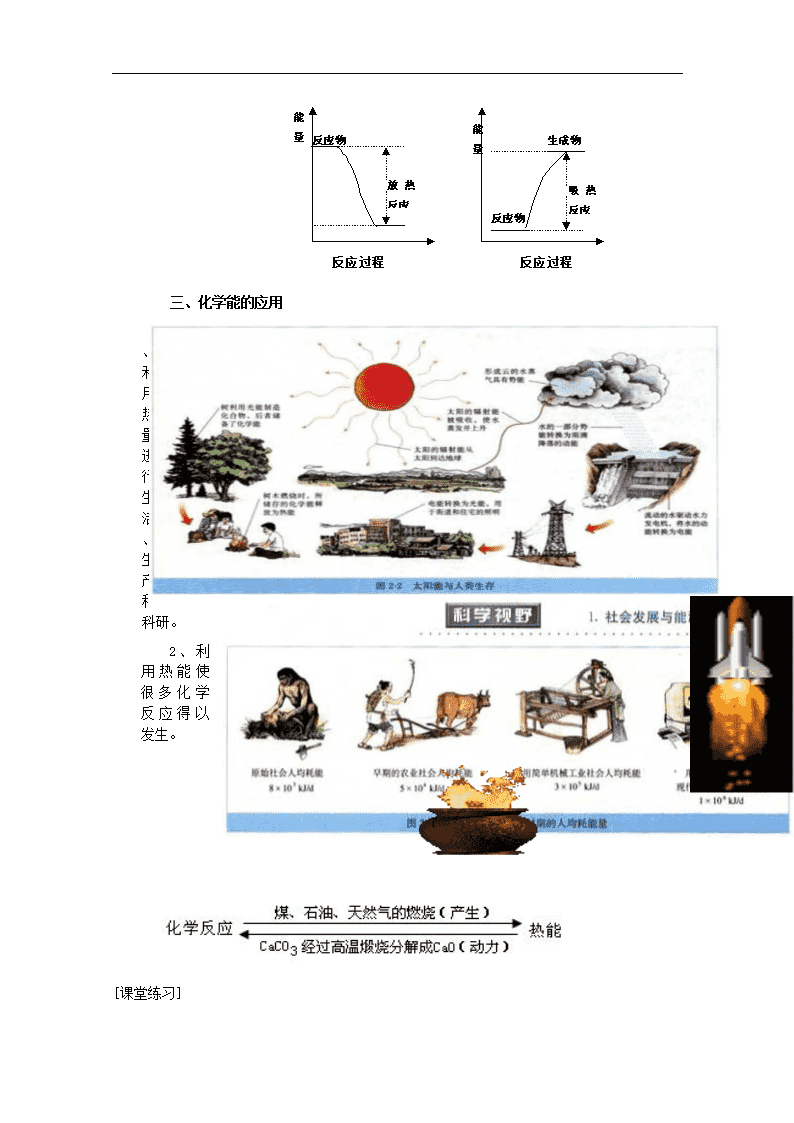
三、化学能的应用
1、利用热量进行生活、生产和科研。
2、利用热能使很多化学反应得以发生。
[课堂练习]
1、下列反应中属吸热反应的是 ( )
A.镁与盐酸反应放出氢气 B.氢氧化钠与盐酸的反应
C.硫在空气或氧气中燃烧 D.Ba(OH)2•8H2O与NH4Cl反应
2、下列说法不正确的是 ( )
A.化学反应除了生成新物质外,还伴随着能量的变化
B.放热反应不需要加热即可发生
C.需要加热条件的化学反应都是吸热反应
D.1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热。
3、城市使用的燃料,现大多为煤气、液化石油气。煤气的主要成分是CO、H2的混合气体,它由煤炭与水蒸气在高温下反应制得,故又称水煤气。试回答:
(1)写出制取水煤气的主要化学方程式 ,该反应是——————反应(填吸热、放热)。(2)设液化石油气的主要成分为丙烷(C3H8 ),其充分燃烧后产物为CO2和 H2O,试比较完全燃烧等质量的C3H8及CO所需氧气的质量比。
4、比较完全燃烧同体积下列气体需要的空气体积的大小:
5、天然气(以甲烷计)、石油液化气(以丁烷C4H10计)、水煤气(以CO、H2体积比1:1计)
6、两位同学讨论放热和吸热反应。甲说加热后才能发生的化学反应是吸热反应,乙说反应中要持续加热才能进行的反应是吸热反应。你认为他们的说法正确吗?为什么?
[课堂小结]
[课堂反思]