- 1.71 MB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
5
讲 水溶液中的离子平衡
-
2
-
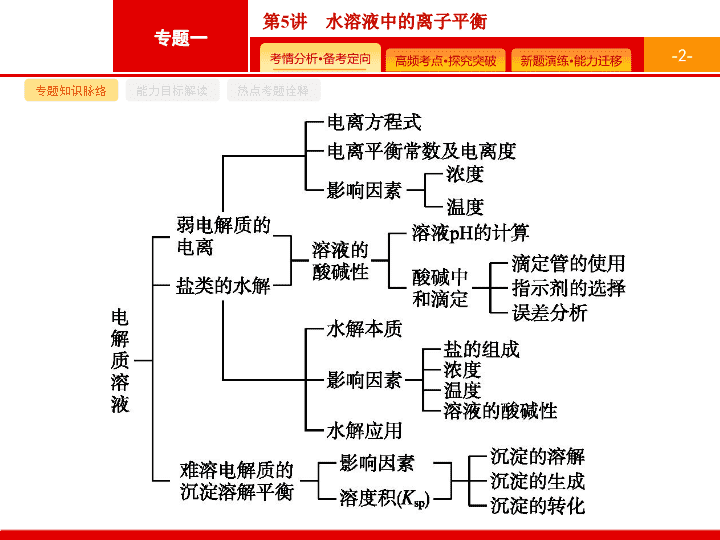
专题知识脉络
能力目标解读
热点考题诠释
-
3
-
专题知识脉络
能力目标解读
热点考题诠释
-
4
-
专题知识脉络
能力目标解读
热点考题诠释
1
.(2019
全国
Ⅰ
)NaOH
溶液滴定邻苯二甲酸氢钾
(
邻苯二甲酸
H
2
A
的
K
a1
=1.1×10
-3
,
K
a2
=3.9×10
-6
)
溶液
,
混合溶液的相对导电能力变化曲线如图所示
,
其中
Q
点为反应终点。下列叙述错误的是
(
)
A.
混合溶液的导电能力与离子浓度和种类有关
B.Na
+
与
A
2-
的导电能力之和大于
HA
-
的
C.
Q
点的混合溶液
pH=7
D.
M
点的混合溶液中
,
c
(Na
+
)>
c
(K
+
)>
c
(OH
-
)
C
-
5
-
专题知识脉络
能力目标解读
热点考题诠释
解题要领
随着
NaOH
溶液的加入
,
混合溶液中离子浓度和种类发生变化
,
因此混合溶液的导电能力与离子浓度和种类有关
,A
项正确
;
P
点的混合溶液中能导电的离子主要为
HA
-
和
K
+
,
Q
点为反应终点
,
因此
Q
点的混合溶液中能导电的离子主要为
A
2-
、
K
+
、
Na
+
,
故
Na
+
与
A
2-
的导电能力之和大于
HA
-
的
,B
项正确
;
Q
点的混合溶液中含有的
A
2-
能发生水解反应而使溶液呈碱性
,C
项错误
;
Q
点为反应终点
,
因此
Q
点的混合溶液中
c
(Na
+
)=
c
(K
+
)>
c
(OH
-
),
继续加入氢氧化钠溶液后
,
M
点的混合溶液中
c
(Na
+
)>
c
(K
+
)>
c
(OH
-
),D
项正确。
-
6
-
专题知识脉络
能力目标解读
热点考题诠释
2
.(2018
全国
Ⅲ
)
用
0.100 mol·L
-1
AgNO
3
溶液滴定
50.0 mL 0.050 0 mol·L
-1
Cl
-
溶液的滴定曲线如图所示。下列有关描述错误的是
(
)
A.
根据曲线数据计算可知
K
sp
(AgCl)
的数量级为
10
-10
B.
曲线上各点的溶液满足关系式
c
(Ag
+
)·
c
(Cl
-
)=
K
sp
(AgCl)
C.
相同实验条件下
,
若改为
0.040 0 mol·L
-1
Cl
-
溶液
,
反应终点
C
移到
A
D.
相同实验条件下
,
若改为
0.050 0 mol·L
-1
Br
-
溶液
,
反应终点
C
向
B
方向移动
C
-
7
-
专题知识脉络
能力目标解读
热点考题诠释
解题要领
相同实验条件下
,
若改为
0.040 0
mol
·
L
-1
Cl
-
溶液
,
恰好反应时
,0.040
0
mol
·
L
-1
×50.0
mL=0.100
mol
·
L
-1
·V
,
V
=20
mL,
故反应终点横坐标应为
20,C
项描述错误
;
相同实验条件下
,
若改为
0.050
0
mol
·
L
-1
Br
-
溶液
,
反应终点横坐标不变
,
由于
K
sp
(AgCl)>
K
sp
(AgBr),
故反应终点纵坐标变大
,
故
D
项描述正确。
-
8
-
专题知识脉络
能力目标解读
热点考题诠释
3
.(2017
全国
Ⅱ
)
改变
0.1 mol·L
-1
二元弱酸
H
2
A
溶液的
pH,
溶液中
H
2
A
、
HA
-
、
A
2-
的物质的量分数
δ
(X)
随
pH
的变化如图所示
[
已知
下列叙述错误的是
(
)
A.pH=1.2
时
,
c
(H
2
A)=
c
(HA
-
)
B.lg[
K
2
(H
2
A)]=-4.2
C.pH=2.7
时
,
c
(HA
-
)>
c
(H
2
A)=
c
(A
2-
)
D.pH=4.2
时
,
c
(HA
-
)=
c
(A
2-
)=
c
(H
+
)
D
-
9
-
专题知识脉络
能力目标解读
热点考题诠释
-
10
-
专题知识脉络
能力目标解读
热点考题诠释
4
.(2017
全国
Ⅲ
)
在湿法炼锌的电解循环溶液中
,
较高浓度的
Cl
-
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入
Cu
和
CuSO
4
,
生成
CuCl
沉淀从而除去
Cl
-
。根据溶液中平衡时相关离子浓度的关系图
,
下列说法错误的是
(
)
C
-
11
-
专题知识脉络
能力目标解读
热点考题诠释
-
12
-
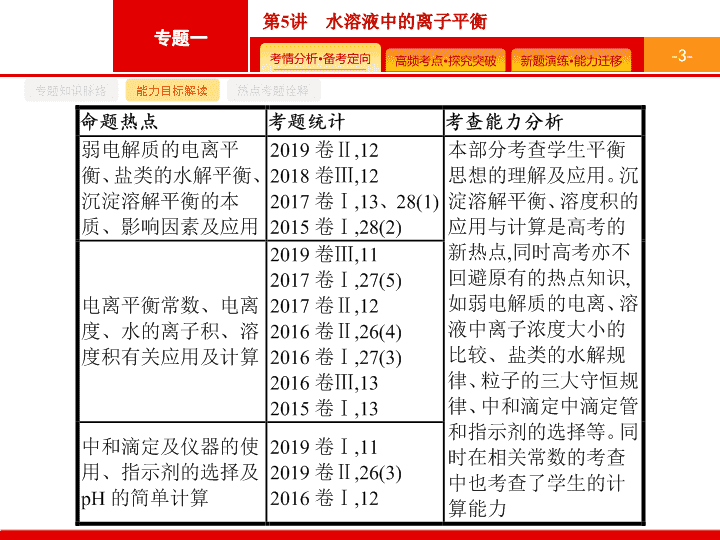
命题热点一
命题热点二
命题热点三
命题热点四
弱电解质的电离平衡
有关弱电解质电离解题的思维路径
-
13
-
命题热点一
命题热点二
命题热点三
命题热点四
问题探究
1
.
如何判断一元强酸与一元弱酸
?
-
14
-
命题热点一
命题热点二
命题热点三
命题热点四
2
.
怎样设计实验证明
HA(
一元酸
)
是否为弱电解质
?
(1)
设计的基本思路
:
判断
HA
是否为弱电解质
(
或弱酸
)
的基本思路有两种
:
一种是直接根据
HA
本身或其强碱盐的性质进行相应的实验设计
(
简称直接设计
),
二是选择一种已知的强酸进行对照性实验设计
(
简称对照设计
)
。
(2)
直接设计
(
以
HA
溶液为例
):
①
若已知
c
(HA),
测定其
pH,
若
pH>-lg
c
(HA),
则
HA
是弱酸。
②
向
HA
溶液中加入该酸对应的钠盐晶体
,
测定加入晶体后溶液的
pH
有无变化
,
若
pH
变大
,
则
HA
为弱酸。
③
若
c
(HA)
未知
,
先测量
HA
溶液的
pH(
设其为
a
),
然后将该溶液稀释至原体积的
100
倍
,
再测定稀释后的
pH,
若
pH<
a
+2,
则
HA
为弱酸。
④
测
NaA
溶液的
pH,
若
pH>7,
或加入酚酞溶液后溶液变红
,
则
HA
是弱酸。
-
15
-
命题热点一
命题热点二
命题热点三
命题热点四
(3)
对照设计
:
①
选用相同物质的量浓度的盐酸作参照物质进行对照实验。
a.
比较两者导电性强弱
,
若
HA
溶液导电能力弱
,
则
HA
为弱酸。
b.
比较相同条件下与某种较活泼的金属单质的反应情况
,
若反应过程中产生气体速率
HA
的较慢
,
则为弱酸。
②
选用
pH
相同的盐酸作参照物。
a.
将两种酸稀释至原体积的相同倍数
(
不低于
100
倍
)
后
,
比较溶液
pH
的相对大小
,
若
HA
的小
,
则为弱酸。
b.
取相同体积的两种酸用碱进行滴定
,
完全反应时
,
若
HA
消耗的碱较多
,
则为弱酸。
c.
比较两种酸与某种较活泼的金属单质的反应情况
,
若反应过程中产生气体速率
HA
较快
,
则为弱酸。
d.
将等体积的两种酸分别与足量的某种较活泼的金属单质反应
,
若
HA
最终生成的气体较多
,
则
HA
是弱酸。
-
16
-
命题热点一
命题热点二
命题热点三
命题热点四
例
1
25
℃
时
,
用浓度为
0.100 0 mol·L
-1
的
NaOH
溶液滴定
20.00 mL
浓度均为
0.100 0 mol·L
-1
的三种酸
HX
、
HY
、
HZ
的溶液
,
滴定曲线如图所示。下列说法正确的是
(
)
A.
在相同温度下
,
同浓度的三种酸溶液的导电能力顺序
:
HZHY>HZ,
则酸性强弱顺序为
HX
c
(HS
-
)
。
(3)
弱碱的稀释和强碱溶液稀释的比较。
弱碱稀释至原体积的
10
n
倍
,pC(OH
-
)
增大值小于
n
,
强碱稀释至原体积的
10
n
倍
,pC(OH
-
)
增大值等于
n
。
答案
D
-
27
-
命题热点一
命题热点二
命题热点三
命题热点四
对点训练
2
常温下
,
向
20.00 mL 0.1 mol·L
-1
HA
溶液中滴入
0.1 mol·L
-1
NaOH
溶液
,
溶液中由水电离出的氢离子浓度的负对数
[-lg
c
水
(H
+
)]
与所加
NaOH
溶液体积的关系如图所示
,
下列说法中不正确的是
(
)
A.
常温下
K
a
(HA)
约为
10
-5
B.
M
、
P
两点溶液对应的
pH=7
C.
b
=20.00
D.
M
点后溶液中均存在
c
(Na
+
)>
c
(A
-
)
B
-
28
-
命题热点一
命题热点二
命题热点三
命题热点四
-
29
-
命题热点一
命题热点二
命题热点三
命题热点四
盐类水解及溶液中粒子浓度大小比较
溶液中粒子浓度大小比较解题的思维路径
-
30
-
命题热点一
命题热点二
命题热点三
命题热点四
-
31
-
命题热点一
命题热点二
命题热点三
命题热点四
-
32
-
命题热点一
命题热点二
命题热点三
命题热点四
例
3
下列溶液中
,
关于离子浓度的说法正确的是
(
)
-
33
-
命题热点一
命题热点二
命题热点三
命题热点四
-
34
-
命题热点一
命题热点二
命题热点三
命题热点四
(3)
关于离子浓度大小比较的题目中
,
等量关系中出现分子浓度时
,
如何解题
?
等量关系中出现分子浓度时
,
只有两种情况
,
一是依据原子守恒解题
,
二是依据质子守恒解题。对于依据质子守恒解题的题目
,
运用电荷守恒和原子守恒的等量关系
,
消去金属离子得到质子守恒的等量关系比较好理解。如
C
项
,0.2
mol
·
L
-1
的
CH
3
COOH
溶液与
0.1
mol
·
L
-1
的
NaOH
溶液等体积混合后
,
得到等浓度的
CH
3
COOH
和
CH
3
COONa
的混合液
,
所以有
2
c
(Na
+
)=
c
(CH
3
COOH)+
c
(CH
3
COO
-
)
……
①
c
(Na
+
)+
c
(H
+
)=
c
(CH
3
COO
-
)+
c
(OH
-
)
……
②
,
将
②
×2-
①
,
得到
c
(CH
3
COO
-
)+2
c
(OH
-
)=
c
(CH
3
COOH)+2
c
(H
+
)
。
-
35
-
命题热点一
命题热点二
命题热点三
命题热点四
(4)
对于酸式盐
,
如何判断水解和电离的关系
?
25
℃
时
,
若
pH<7,
则酸式盐的电离大于水解
;
若
pH>7,
则酸式盐的水解大于电离。对于
D
项
,
由于电离大于水解
,
所以
c
( )>
c
(H
2
C
2
O
4
)
。
答案
C
-
36
-
命题热点一
命题热点二
命题热点三
命题热点四
对点训练
3
某酸性溶液中只有
Na
+
、
CH
3
COO
-
、
H
+
、
OH
-
四种离子。则下列描述正确的是
(
)
A.
该溶液可由
pH=3
的
CH
3
COOH
溶液与
pH=11
的
NaOH
溶液等体积混合而成
B.
该溶液由等物质的量浓度、等体积的
NaOH
溶液和
CH
3
COOH
溶液混合而成
C.
加入适量的
NaOH,
溶液中离子浓度为
c
(CH
3
COO
-
)>
c
(Na
+
)>
c
(OH
-
)>
c
(H
+
)
D.
加入适量氨水
,
c
(CH
3
COO
-
)
一定大于
c
(Na
+
)
、
c
( )
之和
A
-
37
-
命题热点一
命题热点二
命题热点三
命题热点四
-
38
-
命题热点一
命题热点二
命题热点三
命题热点四
难溶电解质的沉淀溶解平衡
沉淀溶解平衡解题思维路径
-
39
-
命题热点一
命题热点二
命题热点三
命题热点四
问题探究
1
.
怎样判断沉淀能否生成或溶解
?
通过比较溶度积与非平衡状态下溶液中有关离子浓度幂的乘积
——
离子积
Q
c
的相对大小
,
可以判断难溶电解质在给定条件下沉淀生成或溶解的情况
:
Q
c
>
K
sp
,
溶液有沉淀析出
;
Q
c
=
K
sp
,
溶液饱和
,
沉淀的生成与溶解处于平衡状态
;
Q
c
<
K
sp
,
溶液未饱和
,
无沉淀析出。
2
.
如何理解溶度积
(
K
sp
)
与溶解能力的关系
?
溶度积
(
K
sp
)
反映了电解质在水中的溶解能力
,
对于阴阳离子个数比相同的电解质
,
K
sp
的数值越大
,
难溶电解质在水中的溶解能力越强
;
但对于阴阳离子个数比不同的电解质
,
不能通过直接比较
K
sp
数值的大小来判断难溶电解质的溶解能力。
-
40
-
命题热点一
命题热点二
命题热点三
命题热点四
3
.
沉淀溶解平衡有哪些常考的知识点
?
(1)
沉淀生成的两大应用
:
①
分离离子
:
对于同一类型的难溶电解质
,
如向含有等浓度的
Cl
-
、
Br
-
、
I
-
的混合溶液中滴加
AgNO
3
溶液
,AgCl
、
AgBr
、
AgI
中溶度积小的物质先析出
,
溶度积大的物质后析出。
②
控制溶液的
pH
来分离物质
,
如除去
CuCl
2
中的
FeCl
3
就可向溶液中加入
CuO
或
Cu(OH)
2
等物质
,
将
Fe
3+
转化为
Fe(OH)
3
而除去。
-
41
-
命题热点一
命题热点二
命题热点三
命题热点四
(2)
沉淀溶解的三种常用方法
:
①
盐溶解法
:
加入盐溶液
,
与沉淀溶解平衡体系中某种离子反应生成弱电解质
,
从而减小离子浓度使沉淀溶解
,
如
Mg(OH)
2
溶于
NH
4
Cl
溶液。
②
配位溶解法
:
加入适当的配合剂
,
与沉淀溶解平衡体系中的某种离子生成稳定的配合物
,
从而减小离子浓度使沉淀溶解
,
如
AgCl
溶于氨水。
③
氧化还原法
:
通过发生氧化还原反应使平衡体系中的离子浓度降低
,
从而使沉淀溶解
,
如
Ag
2
S
溶于硝酸。
-
42
-
命题热点一
命题热点二
命题热点三
命题热点四
(3)
溶度积计算的两大类型
:
①
已知溶度积求溶液中的某种离子的浓度
,
如
K
sp
=
a
的饱和
AgCl
溶液中
②
已知溶度积、溶液中某离子的浓度
,
求溶液中的另一种离子的浓度
,
如某温度下
AgCl
的
K
sp
=
a
,
在
0.1 mol·L
-1
的
NaCl
溶液中加入过量的
AgCl
固体
,
达到平衡后
c
(Ag
+
)=10
a
mol·L
-1
。
-
43
-
命题热点一
命题热点二
命题热点三
命题热点四
-
44
-
命题热点一
命题热点二
命题热点三
命题热点四
分析推理
(1)
根据题意分析
,p
值大小与离子浓度大小有何关系
?
p
值越小
,
离子浓度越大
,
由图示可知
K
sp
(CaSO
4
)>
K
sp
(PbSO
4
)>
K
sp
(BaSO
4
)
。
答案
D
-
45
-
命题热点一
命题热点二
命题热点三
命题热点四
D
-
46
-
-
47
-
答案
解析
解析
关闭
答案
解析
关闭
-
48
-
答案
解析
解析
关闭
由①④时刻溶液加入盐酸酸化的氯化钡溶液
,
④产生白色沉淀较多
,
说明升温过程中亚硫酸钠被空气中的氧气氧化为硫酸钠
,
导致亚硫酸根浓度减小。
A
项
,
亚硫酸钠为强碱弱酸盐
,
在溶液中水解使溶液显碱性
,A
正确
;B
项
,
④与①的
pH
不同是因为亚硫酸根浓度减小
,
溶液
pH
减小
,
正确
;C
项
,
升高温度
,
水解平衡右移
,
减小亚硫酸根浓度
,
平衡左移
,
错误
;D
项
,
①与④的温度相同
,
则水的离子积常数
K
W
相同
,
正确。
答案
解析
关闭
C