- 337.33 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专项提能特训5 含氯化合物的制备
一、选择题:每小题有一个或两个选项符合题意。
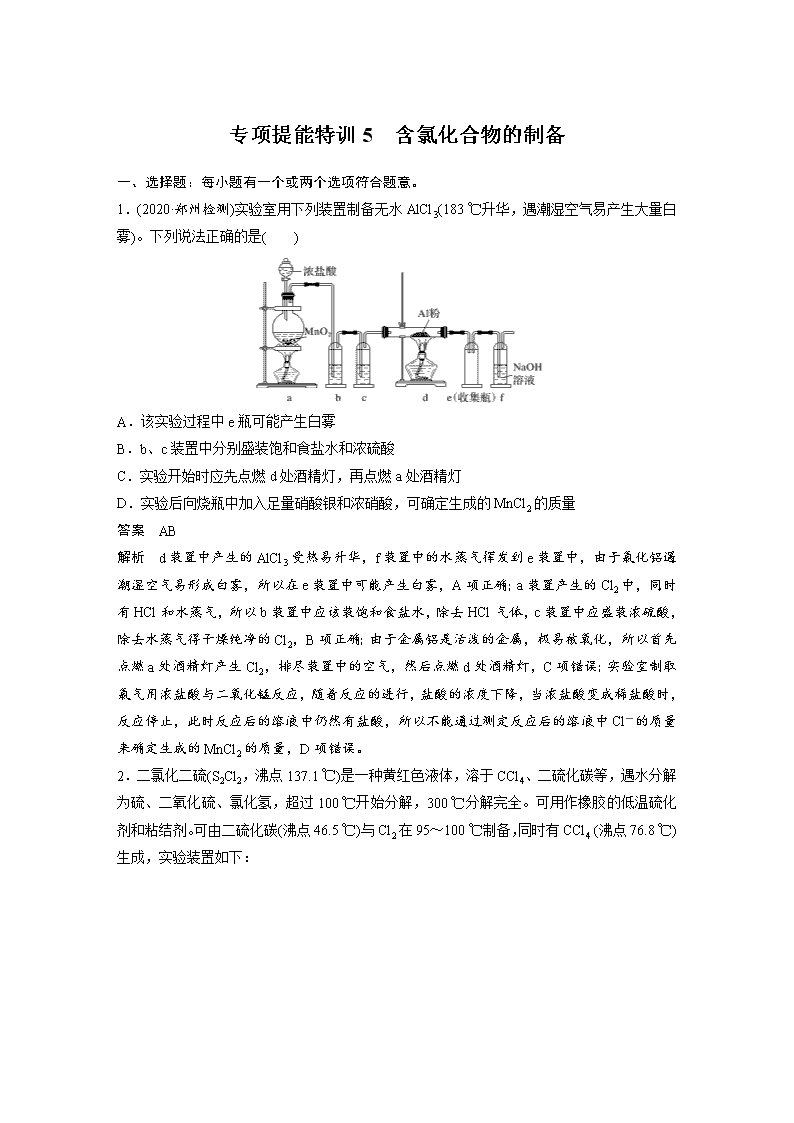
1.(2020·郑州检测)实验室用下列装置制备无水AlCl3(183 ℃升华,遇潮湿空气易产生大量白雾)。下列说法正确的是( )
A.该实验过程中e瓶可能产生白雾
B.b、c装置中分别盛装饱和食盐水和浓硫酸
C.实验开始时应先点燃d处酒精灯,再点燃a处酒精灯
D.实验后向烧瓶中加入足量硝酸银和浓硝酸,可确定生成的MnCl2的质量
答案 AB
解析 d装置中产生的AlCl3受热易升华,f装置中的水蒸气挥发到e装置中,由于氯化铝遇潮湿空气易形成白雾,所以在e装置中可能产生白雾,A项正确;a装置产生的Cl2中,同时有HCl和水蒸气,所以b装置中应该装饱和食盐水,除去HCl气体,c装置中应盛装浓硫酸,除去水蒸气得干燥纯净的Cl2,B项正确;由于金属铝是活泼的金属,极易被氧化,所以首先点燃a处酒精灯产生Cl2,排尽装置中的空气,然后点燃d处酒精灯,C项错误;实验室制取氯气用浓盐酸与二氧化锰反应,随着反应的进行,盐酸的浓度下降,当浓盐酸变成稀盐酸时,反应停止,此时反应后的溶液中仍然有盐酸,所以不能通过测定反应后的溶液中Cl-的质量来确定生成的MnCl2的质量,D项错误。
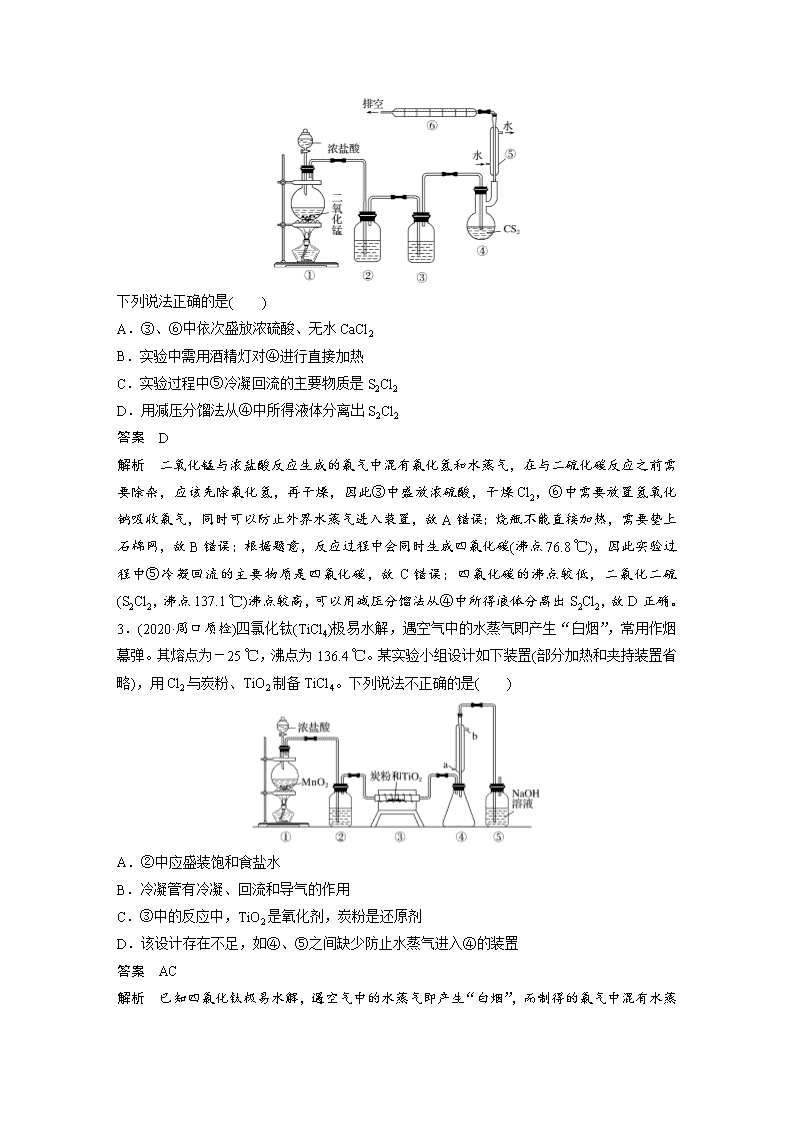
2.二氯化二硫(S2Cl2,沸点137.1 ℃)是一种黄红色液体,溶于CCl4、二硫化碳等,遇水分解为硫、二氧化硫、氯化氢,超过100 ℃开始分解,300 ℃分解完全。可用作橡胶的低温硫化剂和粘结剂。可由二硫化碳(沸点46.5 ℃)与Cl2在95~100 ℃制备,同时有CCl4 (沸点76.8 ℃)生成,实验装置如下:
下列说法正确的是( )
A.③、⑥中依次盛放浓硫酸、无水CaCl2
B.实验中需用酒精灯对④进行直接加热
C.实验过程中⑤冷凝回流的主要物质是S2Cl2
D.用减压分馏法从④中所得液体分离出S2Cl2
答案 D
解析 二氧化锰与浓盐酸反应生成的氯气中混有氯化氢和水蒸气,在与二硫化碳反应之前需要除杂,应该先除氯化氢,再干燥,因此③中盛放浓硫酸,干燥Cl2,⑥中需要放置氢氧化钠吸收氯气,同时可以防止外界水蒸气进入装置,故A错误;烧瓶不能直接加热,需要垫上石棉网,故B错误;根据题意,反应过程中会同时生成四氯化碳(沸点76.8 ℃),因此实验过程中⑤冷凝回流的主要物质是四氯化碳,故C错误;四氯化碳的沸点较低,二氯化二硫(S2Cl2,沸点137.1 ℃)沸点较高,可以用减压分馏法从④中所得液体分离出S2Cl2,故D正确。
3.(2020·周口质检)四氯化钛(TiCl4)极易水解,遇空气中的水蒸气即产生“白烟”,常用作烟幕弹。其熔点为-25 ℃,沸点为136.4 ℃。某实验小组设计如下装置(部分加热和夹持装置省略),用Cl2与炭粉、TiO2制备TiCl4。下列说法不正确的是( )
A.②中应盛装饱和食盐水
B.冷凝管有冷凝、回流和导气的作用
C.③中的反应中,TiO2是氧化剂,炭粉是还原剂
D.该设计存在不足,如④、⑤之间缺少防止水蒸气进入④的装置
答案 AC
解析 已知四氯化钛极易水解,遇空气中的水蒸气即产生“白烟”,而制得的氯气中混有水
蒸气,所以②中应盛装浓硫酸,故A错误;TiCl4的熔、沸点较低,制得的TiCl4应经过冷凝处理,则该装置中冷凝管具有冷凝、回流和导气的作用,故B正确;因四氯化钛极易水解,所以应在装置④和⑤之间增加一个防止水蒸气进入④的装置,故D正确。
4.(2019·日照一模)ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示。
下列说法不正确的是( )
A.步骤a的操作包括过滤、洗涤和干燥
B.吸收器中生成NaClO2的离子方程式:2ClO2+H2O2===2ClO+O2↑+2H+
C.工业上可将ClO2制成NaClO2固体,便于贮存和运输
D.通入空气的目的是驱赶出ClO2,使其被吸收器充分吸收
答案 B
解析 冷却结晶得到的固体需过滤,洗涤固体表面吸附的离子、干燥,A项正确;反应在碱性条件下发生,正确的离子方程式为2ClO2+H2O2+2OH-===2ClO+O2↑+2H2O,B项错误;通入空气可以使ClO2与溶液充分接触,D项正确。
二、非选择题
5.(2018·广东茂名二模)ICl(氯化碘)是红棕色液体,熔点为13.9 ℃,沸点为974 ℃,易水解,接触空气时能形成五氧化二碘,能与许多单质发生作用,溶于乙醇、乙醚等。某校研究性学习小组的同学拟用下列仪器制备氯化碘。回答下列问题:
(1)检查A装置气密性的方法为_______________________________________________
__________________________________________________________________________
__________________________________________________________________________。
(2)上述装置,按气流方向连接的顺序为____________(装置可重复使用),A装置中发生反应的离子方程式为
__________________________________________________________________________。
(3)C装置的作用是__________________________________________________________。
(4)E装置中的物质反应时需放在水中,控制温度大约40 ℃,其目的是_______________。
(5)按上述连接好的装置进行实验,实验步骤如下:
①检查装置气密性后,装入药品 ②打开分液漏斗活塞 ③关闭分液漏斗活塞 ④停止加热E,充分冷却 ⑤水浴加热E
请按正确的顺序填入上述步骤的序号____________。
(6)在A装置后可连接下图所示装置,当反应结束关闭分液漏斗活塞后,关闭K,该装置的作用是________________________________________________________________________。
(7)ICl和水反应的化学方程式为_________________________________________________
________________________________________________________________________。
答案 (1)从A装置的导管口连接一个导管伸入水中,关闭分液漏斗活塞,手握圆底烧瓶,若导管口有气泡冒出,手放开烧瓶后,有一段水柱倒吸入导管,说明A装置气密性良好
(2)ACBEBD MnO2+4H++2Cl-Mn2++Cl2↑+2H2O
(3)除去Cl2中混有的HCl
(4)减少I2的升华和ICl的挥发
(5)①②⑤④③
(6)储存多余的Cl2
(7)ICl+H2OHIO+HCl
解析 (2)利用二氧化锰与浓盐酸加热制备氯气,氯气中含有氯化氢、水蒸气,因此混合气体先通过饱和食盐水除去氯化氢,再通过浓硫酸除去水蒸气,得到干燥纯净的氯气,氯气进入装置E中,与碘进行反应,由于ICl(氯化碘)是红棕色液体,易水解,所以还必须连接装置B,最后多余的尾气被碱液吸收,按气流方向装置的连接顺序为ACBEBD;A装置中发生反应的离子方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O。
(5)装置连接好后,首先检查装置的气密性,不漏气后,加入药品,打开分液漏斗活塞,反应开始进行,水浴加热装置E,反应结束后,停止加热E,充分冷却,待温度降到室温后,关闭分液漏斗活塞,正确的实验步骤为①②⑤④③。