- 419.00 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2017-2018学年辽宁省沈阳市东北育才学校高二下学期期中考试化学科试卷
答题时间:90分钟 满分:100分
命题人:高二化学组 校对人:高二化学组
相对原子质量: H-1 C-12 O-16 N-14 Br-80
(提示:请将所有试题的答案写在化学答题卡上!)
一.选择题(单选,1~5题每小题2分,6~16题每小题3分,共43分)
1.下列有机物命名正确的是( )
A.CH3CH2CH2CH2OH 1-丁醇
B.2-乙基丙烷
CH3—
—CH3
C. 二甲苯
D. 2—甲基—2—丙烯
2.苯乙烯的结构如右图。该物质在一定条件下能和氢气完全加成,加成产物的一溴取代物有
A.7种 B.6种 C.5种 D.4种
3.得重感冒之后,常吃一种抗生素——头孢氨苄,分子式:C16H17N3O4S·H2O,其化学结构如图。有关其说法正确的是( )
A.在一定条件下,能发生水解反应生成氨基酸
B.1 mol该分子最多能与7 mol H2反应
C.该分子能与碳酸钠反应,不能与盐酸反应
D.头孢氨苄易溶于水,能使溴水褪色
4.除去下列物质中所含少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是
混合物
试剂
分离方法
A
苯(苯酚)
溴水
过滤
B
甲烷(甲醛)
水、浓硫酸
洗气
C
乙酸乙酯(乙酸)
氢氧化钠溶液
蒸馏
D
淀粉胶体(氯化钠溶液)
蒸馏水
萃取
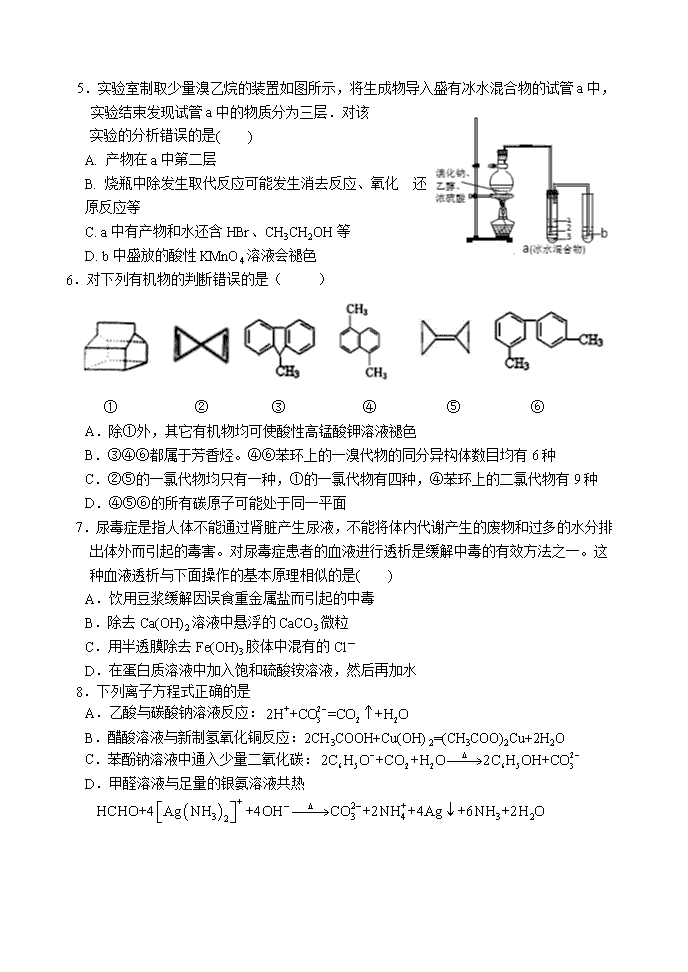
5.实验室制取少量溴乙烷的装置如图所示,将生成物导入盛有冰水混合物的试管a中,实验结束发现试管a中的物质分为三层.对该
实验的分析错误的是( )
A. 产物在a中第二层
B. 烧瓶中除发生取代反应可能发生消去反应、氧化 还原反应等
C. a中有产物和水还含HBr、CH3CH2OH等
D. b中盛放的酸性KMnO4溶液会褪色
6.对下列有机物的判断错误的是( )
① ② ③ ④ ⑤ ⑥
A.除①外,其它有机物均可使酸性高锰酸钾溶液褪色
B.③④⑥都属于芳香烃。④⑥苯环上的一溴代物的同分异构体数目均有6种
C.②⑤的一氯代物均只有一种,①的一氯代物有四种,④苯环上的二氯代物有9种
D.④⑤⑥的所有碳原子可能处于同一平面
7.尿毒症是指人体不能通过肾脏产生尿液,不能将体内代谢产生的废物和过多的水分排出体外而引起的毒害。对尿毒症患者的血液进行透析是缓解中毒的有效方法之一。这种血液透析与下面操作的基本原理相似的是( )
A.饮用豆浆缓解因误食重金属盐而引起的中毒
B.除去Ca(OH)2溶液中悬浮的CaCO3微粒
C.用半透膜除去Fe(OH)3胶体中混有的Cl-
D.在蛋白质溶液中加入饱和硫酸铵溶液,然后再加水
8.下列离子方程式正确的是
A.乙酸与碳酸钠溶液反应:
B.醋酸溶液与新制氢氧化铜反应:2CH3COOH+Cu(OH)2=(CH3COO)2Cu+2H2O
C.苯酚钠溶液中通入少量二氧化碳:
D.甲醛溶液与足量的银氨溶液共热
9.某种橡胶分解产物为碳氢化合物,对这种碳氢化合物作如下实验:
①若取一定量完全燃烧,使燃烧后的气体通过干燥管,干燥管增重0.72 g,再通过石灰水,石灰水增重2.2 g。
②经测定,该碳氢化合物(气体)的密度是相同条件下氢气密度的34倍。
③该碳氢化合物0.1 mol能和32 g溴起加成反应.
④经分析,在③的生成物中,溴原子分布在不同的碳原子上,且溴代物中有一个碳原子在支链上。
下列说法正确的是
A.该碳氢化合物为2-甲基-1,3-戊二烯
B.该碳氢化合物与溴单质1:1加成时可以生成3种不同的产物
C.该碳氢化合物与溴单质1:1加成时可以生成2种不同的产物
D.该碳氢化合物与足量氢气加成时可以生成正戊烷
10.食品香精菠萝酯的生产路线(反应条件略去)如下:
下列叙述错误的是 ( )
A.步骤(1)产物中残留的苯酚可用FeCl3溶液检验
B.苯酚和菠萝酯均可与酸性KMnO4溶液发生反应
C.苯氧乙酸和菠萝酯均可与NaOH溶液发生反应
D.步骤(2)产物中残留的烯丙醇可用溴水检验
11.下列叙述中正确的是
A.牛油是纯净物,它不属于高分子化合物
B.牛油是高级脂肪酸的高级醇酯
C.牛油可以在碱性条件下加热水解
D.工业上可将牛油加氢制成硬化油
12.下列物质的主要成分不属于酯类物质的是
① 醋酸纤维 ②TNT ③ 胶棉 ④ 橄榄油 ⑤生物柴油
⑥ 酚醛树脂 ⑦氯仿 ⑧ 有机玻璃 ⑨润滑油
A.①②④⑥⑦⑧ B.②⑥⑦⑨ C. ①②⑤⑥⑦⑨ D.②⑤⑦⑨
13.聚乙炔导电聚合物的合成使高分子材料进入了“合成金属”和塑料电子学时代,当聚乙炔分子带上药物、氨基酸等分子片段后,就具有了一定的生物活性。以下是我国化 学家近年来合成的聚乙炔衍生物分子M的结构式及M在稀硫酸作用下的水解过程
下列有关说法中不正确的是( )
A.M与A均能使酸性高锰酸钾溶液和溴水褪色
B.B中含有羧基和羟基两种官能团,B能发生消去反应和酯化反应
C.1molM与热的烧碱溶液反应,可消耗2n mol的NaOH
D.A、B、C各1mol分别与金属钠反应,放出的气体的物质的量之比为1:2:2
14.下列说法正确的是:
A.用纤维素酶作催化剂,使纤维素发生水解反应时,生成葡萄糖的速率会随着温度的升高而加快
B.可以采用多次盐析或多次渗析的方法分离、提纯蛋白质
C.取淀粉和稀硫酸共热后的溶液,加入新制银氨溶液共热,没有银镜产生,证明淀粉尚未水解成葡萄糖
D.油脂的水解反应又叫皂化反应
15.下列说法正确的是
A.两种烃相对分子质量相同,但结构不同,性质也不同,一定是同分异构体。
B.有机物和无机物之间不可能出现同分异构体。
C.两种有机物若互为同分异构体,则它们一定不互为同系物。
D.两种烃所含有碳元素的质量分数相同,一定互为同分异构体。
16.有机物A是一种常用的内服止痛解热药。1molA水解得到1molB和1mol醋酸,A溶液具有酸性,不能使FeCl3溶液显色。A的相对分子质量不超过200。B分子中碳元素和氢元素的质量分数和为0.652。A、B都是有碳、氢、氧三种元素组成的芳香族化合物。则下列推断中,正确的是
A.A、B的相对分子质量之差为42
B.1个B分子中应当有2个氧原子
C.A的分子式是C7H6O3
D.B能与NaOH溶液、FeCl3溶液等物质反应,但不与溴水反应
二.填空题及简答题(共5小题,共57分)
17.(16分)由化合物A 制备一种医药合成中间体G和可降解环保塑料PHB的合成路线如下:
己知: (-R1、-R2、-R3 均为烃基)
回答下列问题:
(1) A的结构简式____________________,G中含氧官能团的名称____________________。
(2) 反应①和③的反应类型分别是_____________________、____________________________。
(3) C存在多种同分异构体,其中分别与足量的NaHCO3溶液和Na反应产生气体的物质的量相同的同分异构体的数目为______种。
(4)写出反应③的化学方程式
(5)写出满足下列条件的B的同分异构体
①能发生银镜反应 ②分子中烃基上的氢原子被取代后的一氯代物只有一种
(6)写出用B为起始原料制备高分子化合物的合成路线(其
他试剂任选)。
(7)上述合成路线中最后一步反应的化学方程式为:
18.(12分) 阿司匹林的有效成分是乙酰水杨酸()。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
操作流程如下:
已知:水杨酸和乙酰水杨酸均微溶于水,但其钠盐易溶于水,醋酸酐遇水分解生成醋酸。
回答下列问题:
(1)合成过程中最合适的加热方法是 。
(2)制备过程中,水杨酸会形成聚合物的副产物。写出该聚合物的结构简式 。
(3)粗产品提纯:
① 分批用少量饱和NaHCO3溶解粗产品,目的是 。判断该过程结束的方法是 。
② 滤液缓慢加入浓盐酸中,看到的现象是 。
③ 检验最终产品中是否含有水杨酸的化学方法是 。
(4)阿司匹林药片中乙酰水杨酸含量的测定步骤(假定只含乙酰水杨酸和辅料,辅料不参与反应):
Ⅰ.称取阿司匹林样品m g;Ⅱ.将样品研碎,溶于V1 mL a mol·L-1NaOH(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;Ⅲ.向锥形瓶中滴加几滴酚酞,用浓度为b mol·L-1的标准盐酸到滴定剩余的NaOH,消耗盐酸的体积为V2mL。
① 写出乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式
。
② 阿司匹林药片中乙酰水杨酸质量分数的表达式为 。
19.(12分)某化学小组以苯甲酸为原料,制取苯甲酸甲酯。已知有关物质的沸点如下表:
物质
甲醇
苯甲酸
苯甲酸甲酯
沸点/℃
64.7
249
199.6
I.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g 苯甲酸和20 mL 甲醇(密度约0.79g · mL-1) ,再小心加入3 mL 浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)浓硫酸的作用是_________;若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式:__________________。
(2)甲和乙两位同学分别设计了如上图两套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点,最好采用_________装置(填“甲”或“乙”)。理由是___________________。
(3)反应物CH3 OH 应过量,理由是__________________________________。
II.粗产品的精制
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现按下列流程图进行精制,请在流程图中方括号内填入恰当操作方法的名称。
(5)通过计算,苯甲酸甲酯的产率为_________________________。
20.(7分)已知两个羟基同时连在同一碳原子上的结构是不稳定的,它要发生脱水反应:
现有分子式为C9H8O2X2(X为一未知元素)的物质M,可在一定条件下发生上述一系列反应
试回答下列问题:
⑴ X为 (填元素符号);
⑵上述转化中其中属于氧化反应的共有 步(填数字);M与NaOH溶液共热反应的所属类型是 反应。
⑶ M的结构简式为
⑷写出下列反应的化学方程:
E和银氨溶液反应的化学方程式:
21.(10分)A、B、C、D、E、F都是链状有机物,它们的转化关系如图所示。A是一种氯代烃,只含有一种官能团,D中含有两种官能团,D分子中不含甲基,且与碳原子相连的氢原子取代所得的一氯代物只有1种。请回答下列问题:
(1)D的分子式 。
(2)写出D的结构简式 ,A的结构简式 。
(3)写出B生成C的化学方程式 。
(4)写出C与新制氢氧化铜悬浊液反应的化学方程式
2017—2018学年度下学期期中考试
高二年级化学科试卷
参考答案
1A 2B 3A 4B 5A 6B 7C 8D 9B 10D 11C 12B 13D 14B 15C 16A
17.(16分)
(1) ,醚键、酯基 (4分)(2)氧化反应、缩聚反应、(2分)(3)4 ( 2分)
(4) (2分)
(5) 或
(2分)
(6)
(7)
(2分)
18.(12分)
(1)水浴加热(1分);(2) (2分)
(3)①使乙酰水杨酸转化为易溶于水的乙酰水杨酸钠,便于与聚合物分离(1分);
无气泡产生(1分)。
②有浑浊产生(1分)。
③取少量结晶于试管中,加蒸馏水溶解,滴加FeCl3溶液,若呈紫蓝色则含水杨酸。(2分)
(4)①+3NaOHCH3COONa+2H2O+ (2分)
②0.060 (aV1-bV2) /m(2分)
19.(12分)
(1)催化剂、吸水剂 (1分)
(2分)
(2)甲(1分);甲采用冷凝回流装置,减少了CH3OH 的挥发,产率高(或由于苯甲酸和苯甲酸甲酯的沸点远高于甲醇,蒸出酯的温度在200 ℃ 左右,此时甲醇会大量蒸发,不利于合成反应,所以应冷凝回流)(2分)
(3)该反应是可逆反应,增加CH3OH 的量,使平衡向右移动,有利于提高苯甲酸的转化率(2分)
(4)分液;蒸馏 (2分 各一分)
(5) 65 % (2分)
20.(7分) ⑴Br (1分)
⑵ 4步(1分);取代(或水解)(1分)
⑶ (2分)
⑷ HCOOH+2Ag(NH3)2OH (2分) (NH4)2CO3+2Ag↓+2NH3↑+H2O (2分)
(每个反应式全对各得2分,条件不写扣1分。第⑷②反应中氧化产物写成CO2、H2CO3或NH4HCO3 (HOCOONH4)均可以,只要反应式写对且配平都给分)
21.(10分) ⑴ C7H10O7(2分)
⑵ (2分) (2分)
⑶
(2分)
⑷
+9H2O
(2分)