- 368.00 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
7.《本草纲目》中有“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”的记载。下列说法正确的是
A.“薪柴之灰”可与铵态氮肥混合施用 B.“以灰淋汁”的操作是萃取
C.“取碱”得到的是一种碱溶液 D.“浣衣”过程有化学变化
8.用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.电解精炼铜时,若转移了NA个电子,则阳极溶解32 g铜
B.标准状态下,33.6 L氟化氢中含有1.5 NA个氟化氢分子
C.在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4 mol Cl2转移的电子数为8NA
D.25 ℃时,1 L pH=13的氢氧化钡溶液中含有0.1NA个氢氧根离子
9.下列有关有机化合物的说法正确的是
A.糖类、油脂、蛋白质都是仅由碳、氢、氧元素组成的物质
B.甲烷光照条件下能与Cl2发生加成反应
C.分枝酸的结构简式为,分枝酸可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
D.甲基环己烷的一氯代物有4种(不考虑立体异构)
10.下列离子方程式正确的是
A.Cl2通入水中:Cl2+H2O = 2H++Cl-+ClO-
B.双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O
C.用铜做电极电解CuSO4溶液:2Cu2++2H2O2Cu+O2↑+4H+
D.Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O
11.短周期元素W、X、Y、Z的原子序数依次增加,W的原子中只有1个电子,X2-和Y+ 离子的电子层结构相同,X与Z同族。下列叙述正确的是
A.原子半径:Z > Y > W B.X 的简单氢化物的稳定性比Z的弱
C.Y的氢化物为共价化合物 D.Z的最高价氧化物对应的水化物是一种强酸
12.探索二氧化碳在海洋中转移和归宿,是当今海洋科学研究的前沿领域。研究表明,溶于海水的二氧化碳主要以无机碳形式存在,其中HCO3-占95%。科学家利用下图所示装置从海水中提取CO2,有利于减少环境温室气体含量。
下列说法不正确的是
A.a室中OH-在电极板上被氧化
B.b室发生反应的离子方程式为:H+ + HCO3- = CO2↑ + H2O
C.电路中每有0.2mol 电子通过时,就有0.2mol阳离子从c室移至b室
D.若用氢氧燃料电池供电,则电池负极可能发生的
反应为:H2 + 2OH- - 2e- =2H2O
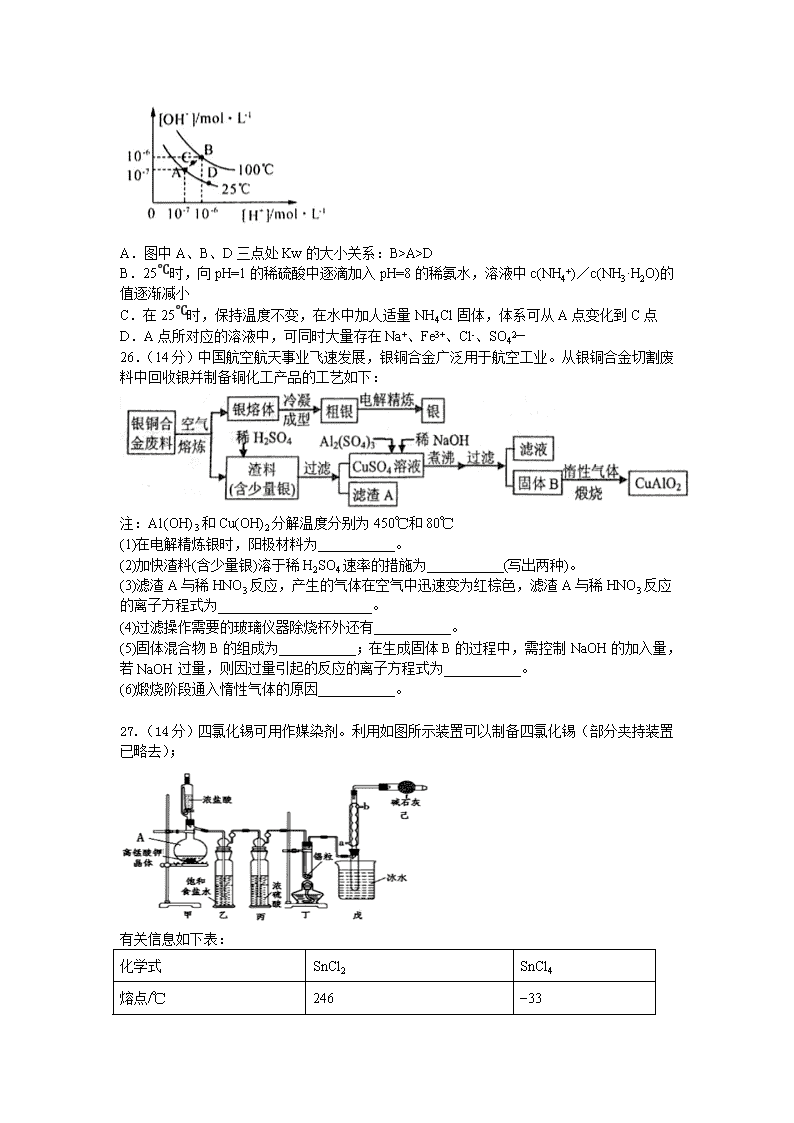
13.水的电离平衡曲线如图所示,下列说法中,正确的是
A.图中A、B、D三点处Kw的大小关系:B>A>D
B.25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,溶液中c(NH4+)/c(NH3·H2O)的值逐渐减小
C.在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系可从A点变化到C点
D.A点所对应的溶液中,可同时大量存在Na+、Fe3+、Cl-、SO42—
26.(14分)中国航空航天事业飞速发展,银铜合金广泛用于航空工业。从银铜合金切割废料中回收银并制备铜化工产品的工艺如下:
注:A1(OH)3和Cu(OH)2分解温度分别为450℃和80℃
(1)在电解精炼银时,阳极材料为___________。
(2)加快渣料(含少量银)溶于稀H2SO4速率的措施为___________(写出两种)。
(3)滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,滤渣A与稀HNO3反应的离子方程式为______________________。
(4)过滤操作需要的玻璃仪器除烧杯外还有___________。
(5)固体混合物B的组成为___________;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为___________。
(6)煅烧阶段通入惰性气体的原因___________。
27.(14分)四氯化锡可用作媒染剂。利用如图所示装置可以制备四氯化锡(部分夹持装置已略去);
有关信息如下表:
化学式
SnCl2
SnCl4
熔点/℃
246
−33
沸点/℃
652
144
其他性质
无色晶体,易氧化
无色液体,易水解
回答下列问题:
(1)甲装置中仪器A的名称为_______。
(2)用甲装置制氯气,MnO4− 被还原为Mn2+,该反应的离子方程式为________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到_______(填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:
①促进氯气与锡反应;②__________。
(4)如果缺少乙装置,丁装置中可能产生SnCl2杂质,产生SnCl2杂质的化学方程式为______,以下试剂中可用于检测是否产生SnCl2的有_____
A.H2O2溶液 B.FeCl3溶液(滴有KSCN) C.AgNO3溶液 D.溴水
(5)己装置的作用是_____。
A.除去未反应的氯气,防止污染空气 B.防止空气中CO2气体进入戊装置
C.防止水蒸气进入戊装置的试管中使产物水解 D.防止空气中O2进入戊装置的试管中使产物氧化
(6)反应中用去锡粒1.19g,反应后在戊装置的试管中收集到2.35gSnCl4,则SnCl4的产率为____(保留3位有效数字)。
28.(15分)某同学在实验室进行铁盐与亚铁盐相互转化实验。
实验I:将Fe3+转化为Fe2+
(1)Fe3+与Cu粉发生反应的离子方程式为:__________。
某同学如下图所示进行试验,发现产生白色沉淀。现就白色沉淀进行相关实验探究,如下:
(2)探究白色沉淀产生的原因,请填写实验方案:
实验方案
现象
结论
步骤1:取4mL____mol/LCuSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液
产生白色沉淀
CuSO4溶液与KSCN溶液反应产生了白色沉淀
步骤2:取4mL_____mol/L_______溶液,向其中滴加________________溶液
无明显现象
查阅资料,已知:
①SCN-的化学性质与I-相似②2Cu2++4I-=2CuI↓+I2
请写出Cu2+与SCN-反应的离子方程式:_________________________________。
实验II:将Fe2+转化为Fe3+
实验方案
现象
向3mL0.lmol/LFeSO4溶液中加入1mL稀硝酸
溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色
探究上述现象出现的原因:
查阅资料:Fe2++NOFe(NO)2+(棕色)
(3)用离子方程式解释NO产生的原因_____________________________________。
(4)从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应I:Fe2+与HNO3反应; 反应II:Fe2+与NO反应
①依据实验现象,可推知反应I的速率比反应II的速率___________(填“快”或“慢”)。
②反应I是一个不可逆反应,设计实验方案加以证明_________________________。
③请用化学平衡移动原理解释溶液由棕色变为黄色的原因___________________________。
35.(15分)原子序数依次增大的四种元素X、Y、Z、W分别处于第一至第四周期,自然界中存在多种X的化合物,Y原子核外电子有6种不同的运动状态,Y与Z可形成正四面体形分子,W的基态原子的最外能层只有一个电子,其他能层均已充满电子。请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布图为_________。
(2)Z所在主族的四种元素分别与X形成的化合物,沸点由高到低的顺序是______(填化学式),呈现如此递变规律的原因是________________________________。
(3)Y元素可形成多种单质,一种晶体结构如图一所示,其原子的杂化类型为___,另一种的晶胞如图二所示,该晶胞的空间利用率为________________(保留两位有效数字)。()
(4)W元素形成的单质,其晶体的堆积模型为___________,W的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是____________(填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向W的硫酸盐溶液中滴加过量氨水,观察到的现象是____________。请写出上述过程的离子方程式___________________________ ,___________________________________。
36.(15分)由化合物A 合成黄樟油(E)和香料F的路线如下(部分反应条件已略去):
请回答下列问题:
(1)下列有关说法正确的是______(填选项字母)。
a.化合物A核磁共振氢谱为两组峰b.CH2Br2只有一种结构
c.化合物E能发生加聚反应得到线型高分子d.化合物B能发生银镜反应,也能与NaOH溶液反应
(2)由B转化为D所需的试剂为______。
(3)D含有的官能团名称为________,C的同分异构体中具有顺反异构的名称是________(不必注明“顺”“反”)。
(4)写出A→B的化学反应方程式:__________。
(5)满足下列条件的E的同分异构体W有________种(不含立体异构),其中核磁共振氢谱为五组峰且峰面积之比是1:2:2:2:3的结构简式为_______。
① lmolW与足量NaOH溶液反应,能消耗2molNaOH
② 能发生银镜反应
③ 苯环上只有两个取代基,能发生聚合反应
(6)参照上述合成路线,写出以、丙酮为主要原料(无机试剂任选),设计制备的合成路线________
化学参考答案
7.D 8.D 9.C 10.B 11.D 12.C 13.B
26.粗银 拌、渣料粉碎、适当升温、适当增大H2SO4的浓度或其它合理答案 3Ag + 4H+ + NO3- = 3Ag+ + NO↑ + 2H2O 漏斗、玻璃棒 Al(OH)3和CuO的混合物 Al(OH)3+OH-=AlO2—+2H2O 保护气(或防止铜被氧化)
27.蒸馏烧瓶 2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O 丁装置内充满黄绿色气体 使SnCl4气化,利于从混合物中分离出来 Sn+2HCl=SnCl2+H2↑ BD AC 90.0%
28.2Fe3++Cu=2Fe2++Cu2+ 0.1 4mL0.2mol/LFeSO4溶液,向其中滴加3滴0.1mol/LKSCN溶液 2Cu2++4SCN-=2CuSCN↓+(SCN)2 3Fe2++4H++NO3-=3Fe3++ NO↑+ 2H2O 慢 取少量反应I的溶液于试管中,向其中加入几滴K3[Fe(CN)6]溶液,溶液无明显变化,说明反应I是一个不可逆反应 Fe2+被硝酸氧化为Fe3+,溶液中Fe2+浓度降低,导致干衡Fe2++NOFe(NO)2+逆向移动,最终Fe(NO)2+完全转化为Fe3+,溶液由综色变为黄色
35. HF>HI>HBr>HCl HF分子之间形成氢键,使其沸点较高,HCl、HBr、HI,分子间以分子间作用力结合,相对分子质量越大,范德华力越大,沸点越高 sp2 34% 面心立方最密堆积 ①②③ 先生成蓝色沉淀,继续加氨水,沉淀溶解,得到深蓝色透明溶液 Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+ Cu(OH)2+4NH3══ [Cu(NH3)4]2++2OH-
36.bc 液溴、Fe(或液溴、FeBr3) 醚键、溴原子 1-溴丙烯 9