- 103.00 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课后优化训练
基 础 强 化
1.除去MgO中的Al2O3可选用的试剂是( )
A. NaOH溶液 B. 硝酸
C. 浓硫酸 D. 稀盐酸
解析 Al2O3为两性氧化物,可溶于NaOH溶液中,而MgO不溶解,过滤即可得到MgO。
答案 A
2.以Al2O3为原料制取氢氧化铝,最好的方法是( )
A. 将Al2O3溶于水
B. 将Al2O3先溶于盐酸中,之后滴加氢氧化钠溶液
C. 将Al2O3先溶于盐酸中,之后滴加氨水
D. 将Al2O3先溶于NaOH溶液中,之后滴加盐酸
解析 Al2O3不溶于水,A不能制Al(OH)3,B、C、D中方法均能制得Al(OH)3,但B中加NaOH、D中加盐酸的量不好控制,过量后均能使Al(OH)3溶解,而C中氨水不能使Al(OH)3溶解,是制Al(OH)3的最好方法。
答案 C
3.由Al3+→Al(OH)3→AlO→→Al3+系列变化中,中应填写的是( )
A. Al(OH)3 B. AlCl3
C. HCl D. NaOH
解析 Al3+→Al(OH)3→AlO→→Al3+,前两步是加入了OH-,后两步是加入了H+。
答案 A
4.下列化学反应的离子方程式错误的是( )
A.Al(OH)3与盐酸反应:Al(OH)3+3H+===Al3++
3H2O
B.Al2O3溶于过量NaOH溶液:Al2O3+2OH-===2AlO+H2O
C.铁溶于稀H2SO4:Fe+2H+===Fe2++H2↑
D.Al(OH)3溶于NaOH溶液:Al(OH)3+3OH-===AlO+3H2O
解析 D中离子方程式电荷不守恒,正确的离子方程式为:Al(OH)3+OH-===AlO+2H2O。
答案 D
5.镁、铝、铜三种金属粉末混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量烧碱溶液,再过滤,滤液中存在的离子有( )
A. AlO B. Cu2+
C. Al3+ D. Mg2+
解析 向镁、铝、铜三种金属粉末中加入过量盐酸,只有铜不反应,过滤可除去,镁、铝溶解,加入过量烧碱溶液,铝离子转化成AlO,镁离子生成沉淀Mg(OH)2,经过滤可除去。
答案 A
6.相同质量的下列物质分别与等浓度的NaOH溶液反应,至体系中均无固体物质,消耗碱量最多的是( )
A. Al B. Al(OH)3
C. AlCl3 D. Al2O3
解析 四种物质与NaOH反应的化学方程式分别为:
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
Al(OH)3+NaOH===NaAlO2+2H2O
AlCl3+4NaOH===NaAlO2+3NaCl+2H2O
Al2O3+2NaOH===2NaAlO2+H2O
可得关系式
Al ~ NaOH Al(OH)3 ~ NaOH
27 40 78 40
AlCl3~NaOH Al2O3~NaOH
33.375 40 51 40
所以等质量的四种物质分别与等浓度的NaOH溶液反应至体系中无固体物质时,消耗碱量最多的是Al。
答案 A
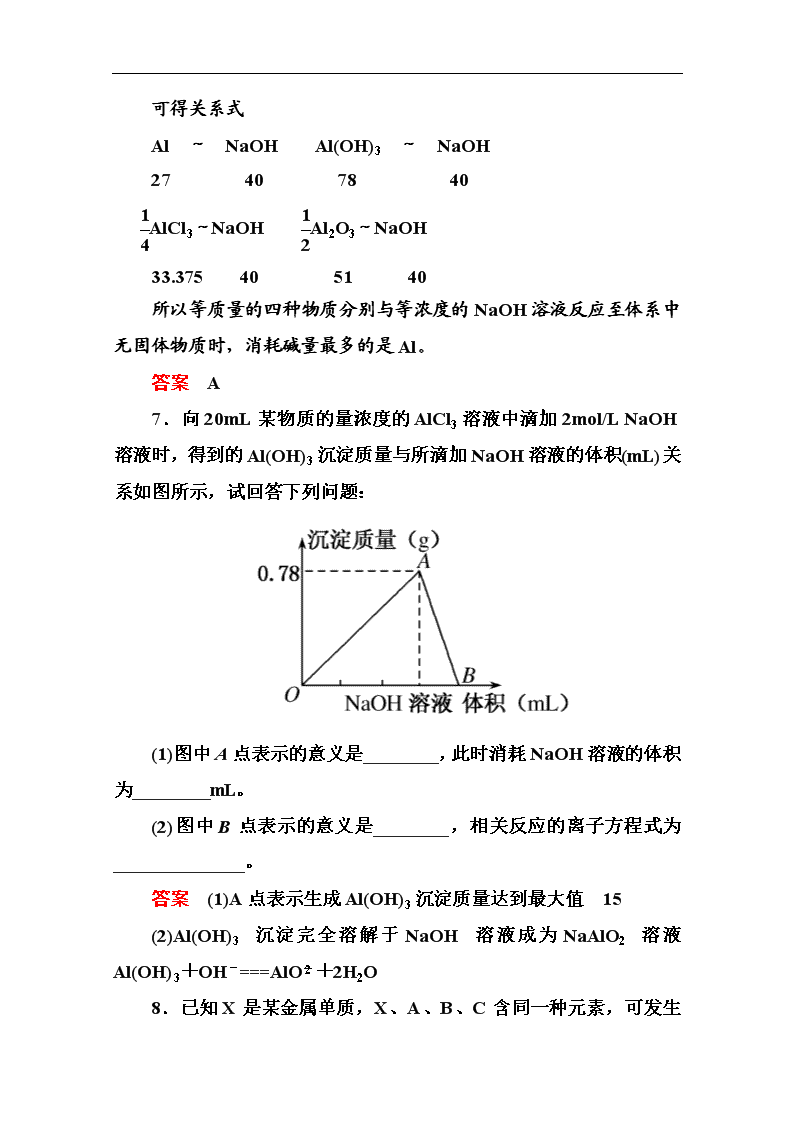
7.向20mL某物质的量浓度的AlCl3溶液中滴加2mol/L NaOH溶液时,得到的Al(OH)3沉淀质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
(1)图中A点表示的意义是________,此时消耗NaOH溶液的体积为________mL。
(2)图中B点表示的意义是________,相关反应的离子方程式为______________。
答案 (1)A点表示生成Al(OH)3沉淀质量达到最大值 15
(2)Al(OH)3沉淀完全溶解于NaOH溶液成为NaAlO2溶液 Al(OH)3+OH-===AlO+2H2O
8.已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
(1)写出下列物质的化学式:X________,A________,B________,C________。
(2)写出以下反应的离子方程式:
②___________________________________________________。
④___________________________________________________。
解析 由X可和酸碱反应且其为金属,则X为Al。
答案 (1)Al Al2O3 NaAlO2 AlCl3
(2)2Al+2OH-+2H2O===2AlO+3H2↑
Al2O3+2OH-===2AlO+H2O
能 力 提 升
1.某无色溶液中,已知含有H+、Mg2+、Al3+等阳离子,逐滴加入NaOH溶液,则消耗NaOH溶液的体积(x轴)和生成沉淀量(y轴)之间的函数关系,可用下图表示,则下列图像中正确的是( )
解析 滴入NaOH溶液,首先发生:H++OH-===H2
O,即开始时不会产生沉淀,C不符合;随后发生:Mg2++2OH-===Mg(OH)2↓,3OH-+Al3+===Al(OH)3↓,沉淀生成且量不断增多,当Mg2+、Al3+完全沉淀时,沉淀量最大;继续滴加NaOH溶液,发生:Al(OH)3+OH-===AlO+2H2O,沉淀溶解一部分,Mg(OH)2不溶解,只有B项满足。
答案 B
2.美、德两国成功合成具有化学特性的氢铝化合物(AlH3)n,关于氢铝化合物的推测不正确的是( )
A. 氢铝化合物与水反应生成氢氧化铝和氢气
B. 氢铝化合物中铝显+3价,H显-1价
C. 铝与水蒸气高温下反应生成氢铝化物
D. 氢铝化合物具有强还原性
解析 氢铝化合物(AlH3)n与NaH类似,Al显+3价,H显-1价,氢铝化合物具有强还原性,与水反应可生成Al(OH)3和H2。铝在高温下与水蒸气不会生成(AlH3)n,C错。
答案 C
3.向100mL 0.25mol/L AlCl3溶液中加入金属钠,完全反应,恰好生成只含NaCl和NaAlO2的澄清溶液,则加入金属钠的质量是( )
A. 3.45g B. 1.15g
C. 2.3g D. 无法计算
解析 根据质量守恒解答本题,可快速准确的得到答案。
根据氯原子守恒得n(NaCl)=3n(AlCl3),根据铝原子守恒得n(NaAlO2)=n(AlCl3)。金属钠的物质的量为n(Na)=n(NaCl)+n(NaAlO2)=0.25mol/L×0.1L×3+0.25mol/L×0.1L=0.1mol,金属钠的质量为:m(Na)=0.1mol×23g/mol=2.3g。
答案 C
4.A是一种无色透明的晶体,进行如下实验:①取少量A晶体做焰色反应实验,透过蓝色钴玻璃观察,火焰呈紫色。②取少量A晶体溶于水可以得到无色溶液。③取少量A的溶液加过量氨水,有白色沉淀B生成。④过滤除去③中的B后,在滤液中滴加BaCl2溶液,有白色沉淀C生成,C不溶于稀HNO3。⑤取少量B滴加NaOH溶液,得无色溶液D。⑥取少量B滴加盐酸,得无色溶液E。⑦将47.4gA晶体在120℃下加热脱水,剩余物的质量为25.8g。
(1)根据上述实验现象和结果确定A、B、C、D、E,写出它们的化学式:
A________B________C________
D________E________
(2)a.写出A溶于水后溶质的电离方程式:
_____________________________________________________;
b.写出③的离子方程式:
_____________________________________________________。
解析 由①可推知A中含有钾元素,②推知该晶体能溶于水,④推知其中有SO,由③和⑤推知其中有Al3+,由⑦知该固体含有结晶水,设化学式为KAl(SO4)2·nH2O
n[KAl(SO4)2]:n(H2O)=:=1:12=1:n
即可判断n=12,该晶体为KAl(SO4)2·12H2O。
答案 (1)KAl(SO4)2·12H2O Al(OH)3 BaSO4 NaAlO2 AlCl3
(2)a.KAl(SO4)2===K++Al3++2SO
b.Al3++3NH3·H2O===Al(OH)3↓+3NH