- 521.90 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
泉港一中2019-2020学年上学期第二次月考试卷
高二化学
考试时间:90分钟 试卷满分:100分
一、选择题(每小题只有1个正确答案,每小题2分,共20分)
1. 下列有关燃料的说法错误的是( )
A.燃料燃烧产物CO2是温室气体之一
B.化石燃料完全燃烧不会造成大气污染
C.以液化石油气代替燃油可减少大气污染
D.燃料不完全燃烧排放的CO是大气污染物之一
2. 下列食品添加剂中,其使用目的与反应速率有关的是( )
A.抗氧化剂 B.调味剂 C.着色剂 D.增稠剂
3. 若要在铜片上镀银时,下列叙述中错误的是( )
①将铜片接在电源的正极 ②将银片接在电源的正极
③在铜片上发生的反应是:Ag+ +e-=Ag ④在银片上发生的反应是:4OH- -4e-=O2↑+2H2O
⑤可用CuSO4溶液作电解质 ⑥可用AgNO3溶液作电解质
A.①③⑥ B.②③⑥ C.①④⑤ D.②③④⑥
4. 下列图示与对应的叙述不相符合的是( )
A.图甲表示燃料燃烧反应的能量变化
B.图乙表示酶催化反应的反应速率随反应温度的变化
C.图丙表示弱电解质在水中建立电离平衡的过程
D.图丁表示强碱滴定强酸的滴定曲线
5. 下列说法正确的是( )
A.若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023
B.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液pH>7
C.钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀
D.一定条件下反应N2+3H22NH3达到平衡时,3v正(H2)=2v逆(NH3)
6. 下列有关电解质溶液的说法正确的是
A.向0.1molCH3COOH溶液中加入少量水,溶液中减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中增大
C.向盐酸中加入氨水至中性,溶液中
D.将0.1mol/L的NaOH的温度提高至80℃,溶液的pH变小
7. 下列事实能说明亚硝酸是弱电解质的是
①25 ℃时亚硝酸钠溶液的pH大于7 ②用HNO2溶液做导电试验,灯泡很暗
③HNO2溶液不与Na2SO4溶液反应 ④0.1 mol·L-1 HNO2溶液的pH=2.1
A. ①②③ B. ②③④ C. ①④ D. ①②④
8. 10mL浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的是( )
A.KNO3 B.CH3COONa C.CuSO4 D.Na2CO3
9. 羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
10. 二甲醚是一种绿色、可再生的新能源。如图是绿色电源“二甲醚燃料电池”的工作原理示意图(a、b均为多孔性Pt电极)。该电池工作时,下列说法正确的是( )
A. a电极为该电池正极
B. O2在b电极上得电子,被氧化
C. 电池工作时,a电极反应式:
CH3OCH3-12e-+3H2O===2CO2↑+12H+
D. 电池工作时,燃料电池内部H+从b电极移向a电极
二、选择题(每小题只有1个正确答案,每小题4分,共20分)
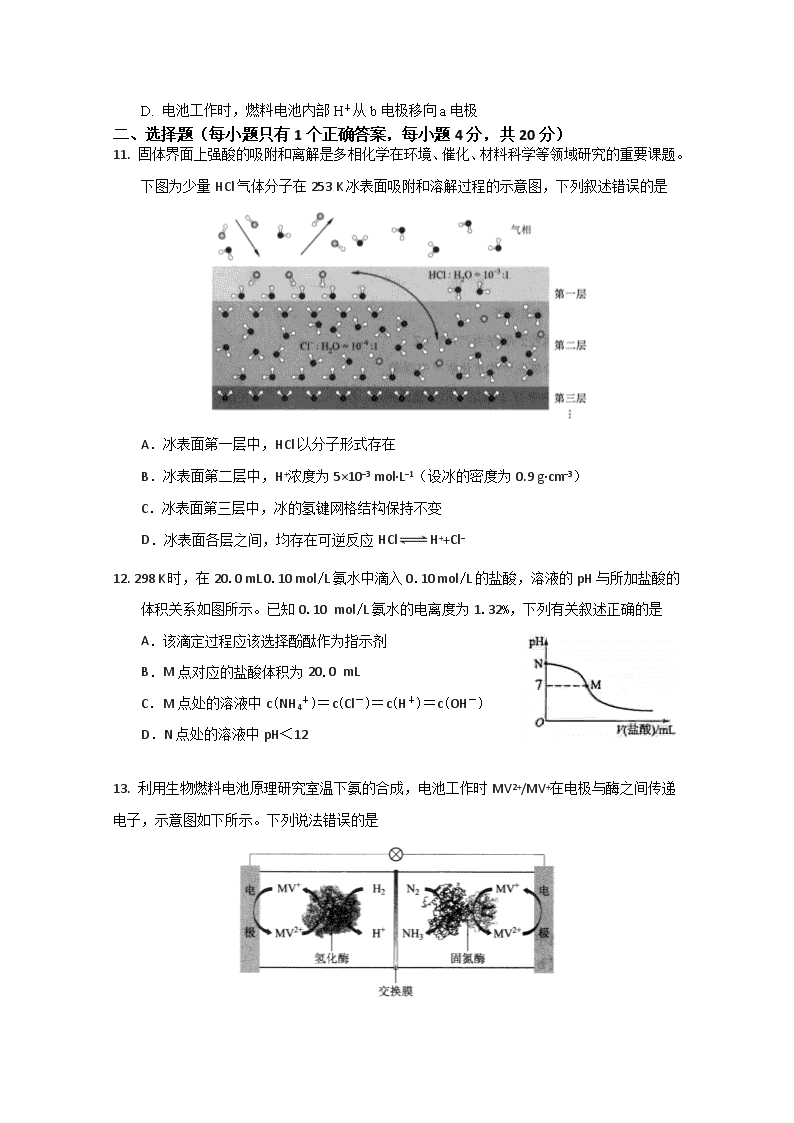
11. 固体界面上强酸的吸附和离解是多相化学在环境、催化、材料科学等领域研究的重要课题。下图为少量HCl气体分子在253 K冰表面吸附和溶解过程的示意图,下列叙述错误的是
A.冰表面第一层中,HCl以分子形式存在
B.冰表面第二层中,H+浓度为5×10−3 mol·L−1(设冰的密度为0.9 g·cm−3)
C.冰表面第三层中,冰的氢键网格结构保持不变
D.冰表面各层之间,均存在可逆反应HClH++Cl−
12. 298 K时,在20.0 mL 0.10 mol/L氨水中滴入0.10 mol/L的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol/L氨水的电离度为1.32%,下列有关叙述正确的是
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0 mL
C.M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
13. 利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
A.相比现有工业合成氨,该方法条件温和,同时还可提供电能
B.阴极区,在氢化酶作用下发生反应H2+2MV2+2H++2MV+
C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D.电池工作时质子通过交换膜由负极区向正极区移动
14. 在不同浓度(c)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表。下列判断不正确的是
A.a=6.00 B.同时改变反应温度和蔗糖的浓度,v可能不变
C.b<318.2 D.不同温度时,蔗糖浓度减少一半所需的时间相同
15.羟胺的电离方程式为: NH2OH+H2O NH3OH++OH-( 25℃时, Kb=9.0×l0-9)。用 0.l mol·L-1 盐酸滴定 20 mL 0.l mol·L-1 羟胺溶液,恒定 25℃时,滴定过程中由水电离出来的 H+浓度的负对数与盐酸体积的关系如图所示(己知: lg3=0.5)。下列说法正确的是( )
A. 图中 V1>10
B. A 点对应溶液的 pH=9.5
C. B、 D 两点对应的溶液均为中性
D. E 点对应溶液中存在:c(H+)=c (OH-)+c (NH3OH+)+c (NH2OH)
三、非选择题(共60分)
16. (14分)弱电解质的电离平衡、盐类的水解平衡均属于化学平衡。根据要求回答问題。
(1)生活中明矾常作净水剂,其净水的原理是_____________(用离子方程式表示)。
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5,则pH=13的MOH溶液的浓度_______0.1mol/L(填“<”、“>”或“=”)。
(3)某二元酸H2A的电离方程式为:Ka1=5.9×10-2;Ka2=6.4×10-5,往20mL1mol/L的H2A滴加10mL1mol/L的NaOH溶液。
①滴加过程中水的电离程度 (填“变大”、“不变”或“变小”,下同),溶液的导电能力 。
②反应后溶液呈 (填“酸性”、“中性”或“碱性”),溶液
中离子浓度大小关系是
③某一时刻溶液的pH=5,则此时c(A2-)/c(HA-)=
17. (14分)碳及其化合物在化工生产中有着广泛的应用。
I.为解决大气中CO2的含量增大的问题,某科学家提出如下构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,在合成塔中经化学反应使废气中的CO2转变为燃料甲醇。部分技术流程如下:
(1)合成塔中反应的化学方程式为K2CO3+CO2+H2O=2KHCO3,△H<0。该反应为可逆反应,从平衡移动原理分析,低温有利于提高原料气的平衡转化率。而实际生产中采用300℃的温度,其原因是 ____________________,
(2)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=-890.3kJ/mol
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ/mol
如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4。写出CO2(g)与H2(g)反应生CH4(g)与液态水的热化学方程式_________________________________________。
II.某兴趣小组模拟工业合成甲醇的反应:CO(g)+2H2(g)CH3OH(g),在容积固定为2L的密闭容器中充入1mol CO和2mol H2,加入合适的催化剂(催化剂体积忽略不计)后开始反应。测得容器内的压强随时间变化如下:
时间/min
0
5
10
15
20
25
压强/Mpa
12.6
10.8
9.5
8.7
8.4
8.4
(1)从反应开始到20min时,以CO表示反应速率为_____ ___
(2)下列描述能说明反应达到平衡是_______
A.装置内CO和H2的浓度比值不再改变 B.容器内气体的平均摩尔质量保持不变
C.容器内气体的压强保持不变 D.容器内气体密度保持不变
(3)该温度下平衡常数K=_______,若达到平衡后加入少量CH3OH(g),此时平衡常数K值将_________ (填“增大”、“减小”或“不变”)
(4)该反应达到平衡后,再向容器中充入1mol CO和2mol H2,此时CO的转化率将_____(填“增大”、“减小”或“不变”)
18.(16分) 氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱,以及生产ClO2 和氯的含氧酸盐(NaClO、NaClO3)等系列化工产品。
(1)写出氯碱工业中电解饱和食盐水的离子方程式:_______________________________;某学习小组为了测定电解后所得溶液NaOH的浓度,设计了如下实验操作步骤:
①取电解后的溶液10.00mL,加水稀释至100mL;
②量取20.00mL于洁净的锥形瓶,滴加2~3滴酚酞试剂;
③用浓度为0.1010mo/L的标准HCl滴定至终点并记录滴定管的读数为25.00mL
请回答有关问题
①步骤①可能用到的仪器除移液管外,还有
②滴定终点的现象是 ,此溶液中c(Na+) c(Cl-)(填“<”、“>”或“=”)
③下列操作可能导致所得浓度偏大的是
a. 锥形瓶用待测溶液润洗 b.碱性滴定管用待测液润洗
c. 滴定管滴定前有气泡,滴定后无气泡 d. 滴定终点俯视读数
④该实验设计存在的明显不足的是
(2)已知:H2SO3的Ka1=1.54×10–2,Ka2=1.02×10–7;HClO的Ka=2.95×10–8
①室温下,0.1 mol·L–1 NaClO溶液的pH 0.1 mol·L–1 Na2SO3溶液的pH。(填“大于”、“小于”或“等于”)
②写出一种可以证明NaHSO3溶液中HSO3–的电离程度大于HSO3–水解程度的方法:
____________________________________________________________
(3)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
电解时发生反应的化学方程式为 ,溶液X的溶质主要是
19. (16分)水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答下列问题:
(1)Shibata曾做过下列实验:①使纯H2缓慢地通过处于721℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴Co(s),平衡后气体中H2的物质的量分数为0.0250。
②在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192。
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO_________H2(填“大于”或“小于”)。
(2)721 ℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为_________(填标号)。
A.<0.25 B.0.25 C.0.25~0.50 D.0.50 E.>0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用标注。
可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=_________eV,写出该步骤的化学方程式_______________________。
(4)Shoichi研究了467 ℃、489 ℃时水煤气变换中CO和H2分压随时间变化关系(如下图所示),催化剂为氧化铁,实验初始时体系中的PH2O和PCO相等、PCO2和PH2相等。
计算曲线a的反应在30~90 min内的平均速率(a)=___________kPa·min−1。467 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。489 ℃时PH2和PCO随时间变化关系的曲线分别是___________、___________。
参考答案及评分标准
1-10题每题2分,11-15题每题4分
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
答案
B
A
C
A
C
D
C
B
C
C
D
D
B
D
B
16.(14分,每空2分)
(1)Al3+ +3H2O=Al(OH)3(胶体)+ 3H+
(2)>
(3)①变大;变大
②酸性;c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
③6.4
17. Ⅰ(1)提高反应速率 增大催化剂催化活性 每空1分
(2)CO2(g) +4H2(g)=CH4(g) +2H2O(l) △H=-252.9kJ·mol-1 2分
Ⅱ(1)0.0125mol·L-1·min-1 2分
(2)BC 2分
(3)4 不变 每空2分
(4)增大 2分
通电
18. (16分)
(1)2Cl- +2H2O===2OH- +H2↑+Cl2↑ 2分
①100mL容量瓶、玻璃棒、胶头滴管 2分
②滴加最后一滴溶液,锥形瓶溶液由红色变为无色,并30s保持不变; 2分
> 1分
③ac 2分,多选不得分,少选得1分
④未进行平行实验 2分
(2)①大于 1分
②测得溶液pH<7 (或其它合理答案) 2分
通电
(3)
NH4Cl +2HCl=====NCl3 +3H2↑ 2分
NaCl和NaOH 2分
19(16分)
(1)大于 2分
(2)C 2分
(3)<;2.02;COOH*+H*+H2O*=COOH*+2H*+OH* (或H2O*= H*+OH*) 每空2分
(4)4.4×10-3 2分
d a b c 每空1分