- 1.29 MB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1.了解化学实验室常用仪器的主要用途和使用方法。 2.掌握化学实验的基本操作。能识别化学品标志。了解实验室一般事故的预防和处理方法。 3.掌握常见物质检验、分离和提纯的方法。 4.掌握常见离子的检验。 5.根据实验目的和要求评价“操作—现象—结论”和评价实验装置等实验评价。
1.(2019·全国卷Ⅱ)下列实验现象与实验操作不相匹配的是( )
实验操作
实验现象
A.
向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置
溶液的紫色逐渐褪去,静置后溶液分层
B.
将镁条点燃后迅速伸入集满CO2的集气瓶
集气瓶中产生浓烟并有黑色颗粒产生
C.
向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸
有刺激性气味气体产生,溶液变浑浊
D.
向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液
黄色逐渐消失,加KSCN后溶液颜色不变
A [乙烯中含有双键,可以使高锰酸钾酸性溶液褪色,静置后溶液不分层,A不匹配;镁条与二氧化碳在点燃条件下反应的化学方程式为2Mg+CO22MgO+C,所以集气瓶中产生浓烟,并有黑色颗粒产生,B匹配;根据反应Na2S2O3+2HCl===2NaCl+S↓+SO2↑+H2O,SO2为有刺激性气味的气体,硫是淡黄色沉淀,可使溶液变浑浊,C匹配;根据反应2Fe3++Fe===3Fe2+,可得随Fe3+逐渐消耗,黄色逐渐消失,加KSCN溶液后,溶液颜色不变,D匹配。]
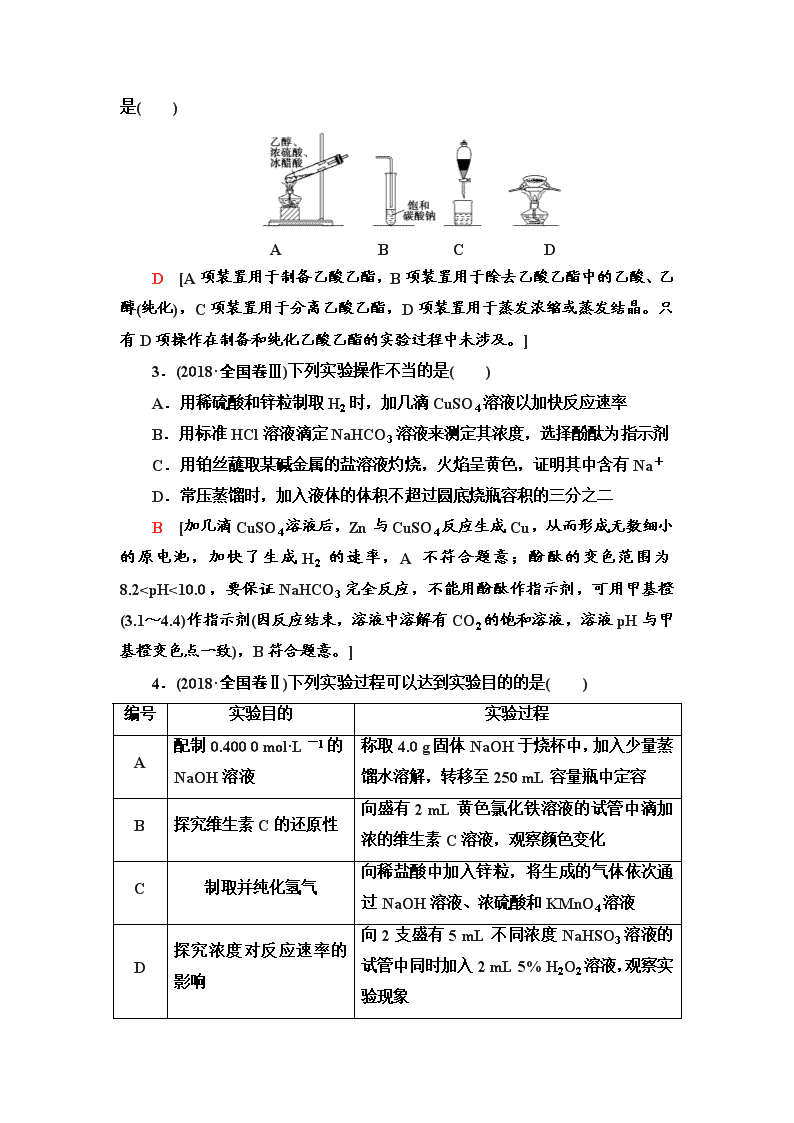
2.(2018·全国卷Ⅰ)
在生成和纯化乙酸乙酯的实验过程中,下列操作未涉及的是( )
A B C D
D [A项装置用于制备乙酸乙酯,B项装置用于除去乙酸乙酯中的乙酸、乙醇(纯化),C项装置用于分离乙酸乙酯,D项装置用于蒸发浓缩或蒸发结晶。只有D项操作在制备和纯化乙酸乙酯的实验过程中未涉及。]
3.(2018·全国卷Ⅲ)下列实验操作不当的是( )
A.用稀硫酸和锌粒制取H2时,加几滴CuSO4溶液以加快反应速率
B.用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择酚酞为指示剂
C.用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有Na+
D.常压蒸馏时,加入液体的体积不超过圆底烧瓶容积的三分之二
B [加几滴CuSO4溶液后,Zn与CuSO4反应生成Cu,从而形成无数细小的原电池,加快了生成H2的速率,A不符合题意;酚酞的变色范围为8.2Fe2+
B
将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶
集气瓶中产生大量白烟,瓶内有黑色颗粒产生
CO2具有氧化性
C
加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸
石蕊试纸变蓝
NH4HCO3
显碱性
D
向2支盛有2 mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液
一支试管中产生黄色沉淀,另一支中无明显现象
Ksp(AgI)Fe2+,A能推出相应结论。发生的反应为4Na+2CO2C+2Na2CO3,CO2中C元素化合价降低,被还原,所以CO2有氧化性,B能推出相应结论。发生的反应为NH4HCO3NH3↑+H2O+CO2↑,由于NH3与水反应生成NH3·H2O,NH3·H2
O显碱性,所以石蕊试纸变蓝,C不能推出相应结论。在相同实验条件下(等体积、等浓度),生成了AgI沉淀,没有生成AgCl沉淀,所以Ksp(AgI) Ksp(Ag2S)
B
浓硫酸
蔗糖
KMnO4溶液
浓硫酸具有脱水性、氧化性
C
稀盐酸
Na2SO3
Ba(NO3)2溶液
SO2与可溶性钡盐均可生成白色沉淀
D
浓硝酸
Na2CO3
Na2SiO3溶液
酸性:硝酸>碳酸>硅酸
B [③中有AgNO3,H2S可与AgNO3反应生成Ag2S,不能说明AgCl是否转化为Ag2S,A错;SO2通入Ba(NO3)2溶液中,H+、NO可将其氧化为SO,产生BaSO4沉淀,不能由此推断其它可溶性钡盐(如BaCl2)能与SO2反应,C错;HNO3易挥发,进入③中,不能证明结论正确,D错。]
“实验目的——实验装置”的评价
3.(2019·沈阳模拟)下列实验装置不能达到实验目的的是( )
A.图A装置Cu和浓硝酸制取NO
B.图B装置实验室制备Cl2
C.图C装置实验室制取乙酸乙酯
D.图D装置实验室分离CO和CO2
C [乙酸乙酯不能用NaOH溶液作吸收剂,应用饱和Na2CO3溶液,C不能达到实验目的。]
4.分析下述实验所得结论正确的是( )
① ② ③ ④
A.①中所示实验可证明元素的非金属性:Cl>C>Si
B.②中产生红棕色气体,说明木炭与浓硝酸发生反应
C.③与碳酸氢钠相连的a试管先浑浊,说明热稳定性:Na2CO3>NaHCO3
D.④中产生红棕色气体,则产生的气体一定是混合气体
D [①中现象可以得酸性HCl>H2CO3>H2SiO3(并非最高价含氧酸HClO4),但不能说明Cl的非金属性强弱,A错;HNO3受热分解也产生NO2等气体,B错;放NaHCO3处的温度高,NaHCO3分解,不能说明Na2CO3与NaHCO3的稳定性强弱,C错。]
“五查法”速解装置图评价题
(1)查实验装置中仪器的使用和连接是否正确;
(2)查所用反应试剂是否符合实验原理;
(3)查气体收集方法是否正确;
(4)查尾气吸收装置、安全装置是否正确;
(5)查相应操作与实验目的是否相符,现象、结论是否统一。
综合实验装置的问题分析
5.(2019·河北名校模拟)对实验室制得的粗溴苯[含溴苯(不溶于水,易溶于有机溶剂,沸点156.2 ℃)、Br2和苯(沸点80 ℃)]进行纯化,未涉及的装置是( )
A B
C D
C [除去Br2可以用SO2,原理是:Br2+ SO2+2H2O===H2SO4+2HBr,A正确;苯和溴苯的混合液与酸溶液互不相溶,分液可得苯和溴苯的混合液,B正确;由分析可知,不涉及到过滤操作,C错误。]
6.(2019·山西名校模拟)“侯氏制碱法”是我国化工专家候德榜为世界制碱工业作出的突出贡献。某实验小组模拟“侯氏制碱法”的工艺流程及实验装置(部分夹持装置省略)如下:
下列叙述错误的是( )
A.实验时先点燃装置①的酒精灯,过一段时间后再打开装置③中分液漏斗的旋塞
B.装置②的干燥管中可盛放蘸稀硫酸的脱脂棉,作用是吸收多余的NH3
C.向步骤Ⅰ所得滤液中通入氨气,加入细小的食盐颗粒并降温,可析出NH4Cl
D.用装置④加热碳酸氢钠可实现步骤Ⅱ的转化,所得CO2可循环使用
D [固体NaHCO3加热不能用烧杯,D错误。]
“操作—现象—结论”实验评价
7.(2019·许昌模拟)下列实验中根据现象得出的结论错误的是( )
选项
实验操作
现象
结论
A
相同条件下,用1 mol·L-1的CH3COOH和1 mol·L-1的HCl分别做导电性实验
CH3COOH溶液对应的灯泡较暗
CH3COOH是弱电解质
B
向某溶液中加铜和浓硫酸
试管口有红棕色气体产生
原溶液中可能含有NO
C
向某钠盐中滴加浓盐酸,将产生的气体通入品红溶液
品红溶液褪色
该钠盐为Na2SO3或NaHSO3
D
向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水
先出现蓝色沉淀
Ksp[Mg(OH)2]> Ksp[Cu(OH)2]
C [使品红溶液褪色的气体可能为氯气或二氧化硫,则盐可能为NaClO与浓盐酸反应生成氯气,也可能为Na2SO3或NaHSO3
与浓盐酸反应生成二氧化硫,C错误。]
8.(2019·江西名校模拟)下列实验操作、实验现象和实验结论均正确的是( )
选项
实验操作
实验现象
实验结论
A
将Fe(NO3)2样品溶于稀硫酸,滴加KSCN溶液
溶液变红
稀硫酸能氧化Fe2+
B
向KMnO4酸性溶液中滴加乙二酸
溶液褪色
乙二酸具有氧化性
C
向AgNO3溶液中滴加过量氨水
得到澄清溶液
Ag+与NH3·H2O能大量共存
D
分别向盛有KI3溶液(显黄色)的a、b试管中滴加淀粉溶液、AgNO3溶液
a中溶液变蓝,b中产生黄色沉淀
溶液中存在:II2+I-
D [酸性条件下Fe2+、NO、H+会发生氧化还原反应生成Fe3+,再滴加KSCN溶液,溶液变红,但稀硫酸不能氧化Fe2+,A错误;KMnO4酸性溶液中滴加乙二酸,会发生氧化还原反应,使溶液褪色,则乙二酸具有还原性,B错误;AgNO3溶液中滴加过量氨水,生成银氨溶液,故Ag+与NH3·H2O不能大量共存,C错误。]
9.(2019·攀枝花模拟)下列根据实验操作和实验现象所得出的结论不正确的是( )
选项
实验操作
实验现象
结论
A
将FeCl2样品溶于盐酸后,滴加KSCN溶液
溶液变成红色
原FeCl2样品已变质
B
将Na2SO3样品溶于水,滴加稀盐酸酸化的Ba(NO3)2溶液
产生白色沉淀
原Na2SO3样品已变质
C
滴入稀硫酸未见溶液变蓝;加入H2O2
酸性条件下,H2O2氧化性强于I2
向淀粉KI溶液中滴入3滴稀硫酸,再加入10%的H2O2溶液
溶液后,溶液立即变蓝
D
向5 mL 0.5 mol·L-1 NaHCO3溶液中滴入2 mL 1 mol·L-1 BaCl2溶液
产生白色沉淀,且有无色气体生成
反应的化学方程式为2NaHCO3+BaCl2 ===BaCO3↓+ 2NaCl+CO2↑+H2O
B [若Na2SO3不变质,酸性条件下NO氧化SO生成SO,也能产生白色沉淀,B不正确。]
“操作—现象—结论”评价的思路分析