- 458.00 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第四节 离子晶体
课时演练·促提升
A组
1.仅由下列各组元素所组成的化合物,不可能形成离子晶体的是( )
A.H、O、S B.Na、H、O
C.K、Cl、O D.H、N、Cl
解析:强碱、活泼金属氧化物、绝大多数盐等是离子晶体。B项如NaOH、C项如KClO、D项如NH4Cl。
答案:A
2.下列变化过程中需克服相同类型作用力的是( )
A.碘和干冰的升华
B.硅和C60的熔化
C.氯化氢和氯化钠的溶解
D.溴和汞的汽化
解析:A选项中两物质均属于分子晶体,升华过程中需克服范德华力,正确;B选项,硅属于原子晶体,熔化过程中需破坏共价键,C60属于分子晶体,熔化过程中需克服范德华力;C选项,HCl溶解过程中需破坏共价键,NaCl溶解过程中需破坏离子键;D选项,溴、汞的汽化分别克服范德华力、破坏金属键。
答案:A
3.下列排序正确的是( )
A.酸性:H2CO3PH3>AsH3
D.某非金属元素从游离态变成化合态时,该元素一定被还原
解析:CO2分子内含极性键,但分子为直线形分子,是非极性分子,A项错误;稀有气体形成的晶体属于分子晶体,由单原子分子构成,不存在化学键,B项错误;非金属元素由游离态变为化合态,可能发生氧化反应(C→CO2),也可能发生还原反应(Cl2→Cl-),D项错误。
答案:C
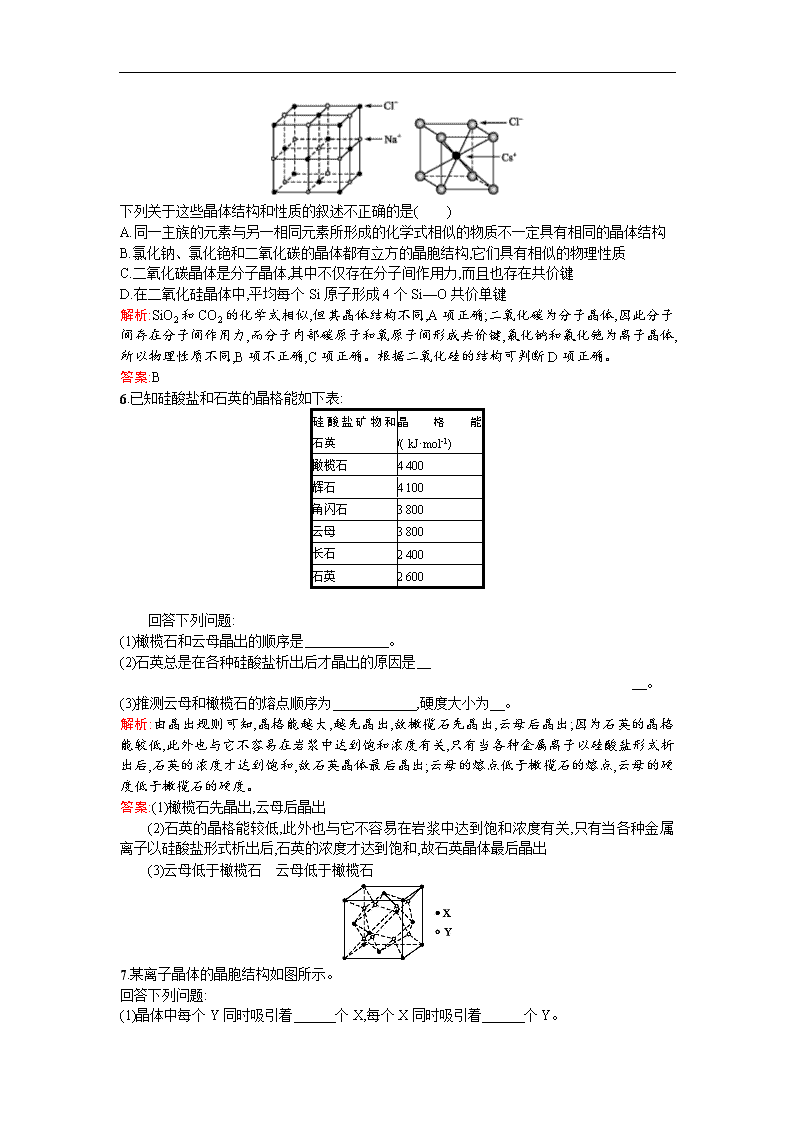
5.通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如图所示:
下列关于这些晶体结构和性质的叙述不正确的是( )
A.同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同的晶体结构
B.氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似的物理性质
C.二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键
D.在二氧化硅晶体中,平均每个Si原子形成4个Si—O共价单键
解析:SiO2和CO2的化学式相似,但其晶体结构不同,A项正确;二氧化碳为分子晶体,因此分子间存在分子间作用力,而分子内部碳原子和氧原子间形成共价键,氯化钠和氯化铯为离子晶体,所以物理性质不同,B项不正确,C项正确。根据二氧化硅的结构可判断D项正确。
答案:B
6.已知硅酸盐和石英的晶格能如下表:
硅酸盐矿物和石英
晶格能/( kJ·mol-1)
橄榄石
4 400
辉石
4 100
角闪石
3 800[来源:学科网]
云母
3 800
长石
2 400
石英
2 600
回答下列问题:
(1)橄榄石和云母晶出的顺序是 。
(2)石英总是在各种硅酸盐析出后才晶出的原因是
。
(3)推测云母和橄榄石的熔点顺序为 ,硬度大小为 。
解析:由晶出规则可知,晶格能越大,越先晶出,故橄榄石先晶出,云母后晶出;因为石英的晶格能较低,此外也与它不容易在岩浆中达到饱和浓度有关,只有当各种金属离子以硅酸盐形式析出后,石英的浓度才达到饱和,故石英晶体最后晶出;云母的熔点低于橄榄石的熔点,云母的硬度低于橄榄石的硬度。
答案:(1)橄榄石先晶出,云母后晶出
(2)石英的晶格能较低,此外也与它不容易在岩浆中达到饱和浓度有关,只有当各种金属离子以硅酸盐形式析出后,石英的浓度才达到饱和,故石英晶体最后晶出
(3)云母低于橄榄石 云母低于橄榄石
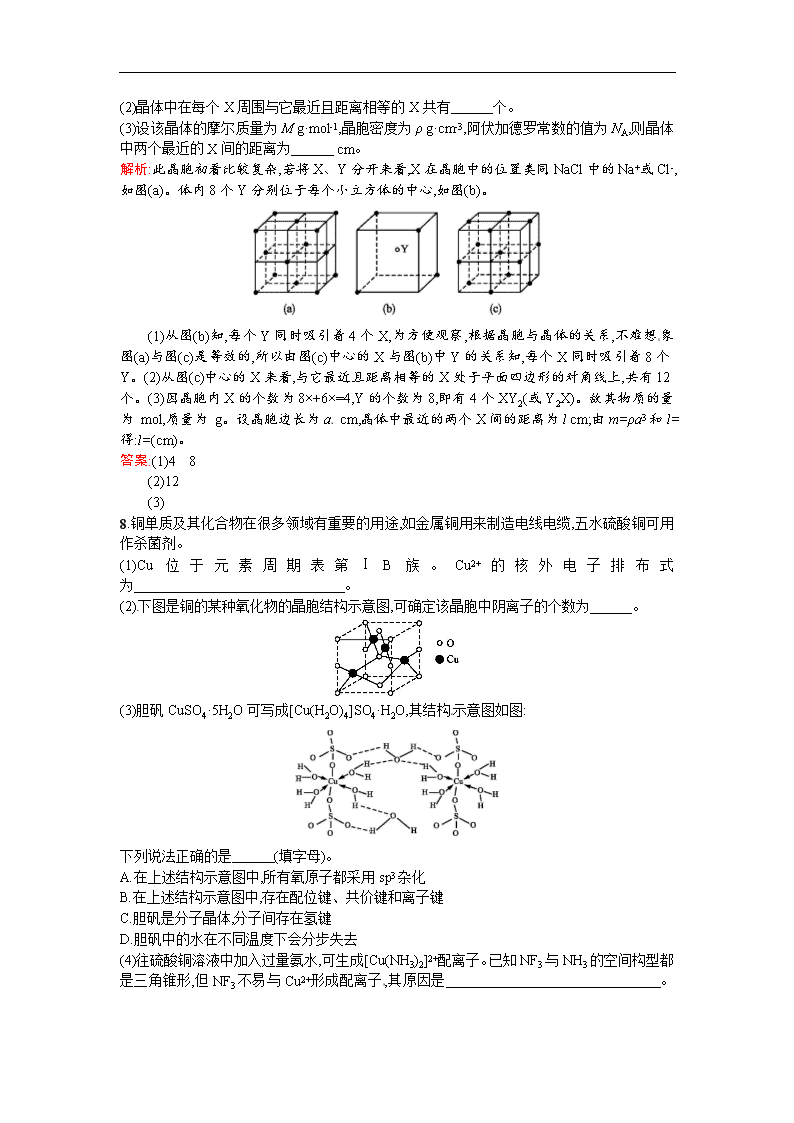
7.某离子晶体的晶胞结构如图所示。
回答下列问题:
(1)晶体中每个Y同时吸引着 个X,每个X同时吸引着 个Y。
(2)晶体中在每个X周围与它最近且距离相等的X共有 个。
(3)设该晶体的摩尔质量为M g·mol-1,晶胞密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则晶体中两个最近的X间的距离为 cm。
解析:此晶胞初看比较复杂,若将X、Y分开来看,X在晶胞中的位置类同NaCl中的Na+或Cl-,如图(a)。体内8个Y分别位于每个小立方体的中心,如图(b)。
(1)从图(b)知,每个Y同时吸引着4个X,为方便观察,根据晶胞与晶体的关系,不难想象图(a)与图(c)是等效的,所以由图(c)中心的X与图(b)中Y的关系知,每个X同时吸引着8个Y。(2)从图(c)中心的X来看,与它最近且距离相等的X处于平面四边形的对角线上,共有12个。(3)因晶胞内X的个数为8×+6×=4,Y的个数为8,即有4个XY2(或Y2X)。故其物质的量为 mol,质量为 g。设晶胞边长为a cm,晶体中最近的两个X间的距离为l cm;由m=ρa3和l=得:l=(cm)。
答案:(1)4 8
(2)12
(3)
8.铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂。
(1)Cu位于元素周期表第ⅠB族。Cu2+的核外电子排布式为 。
(2)下图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。
(3)胆矾CuSO4·5H2O可写成[Cu(H2O)4]SO4·H2O,其结构示意图如图:
下列说法正确的是 (填字母)。
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)2]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是 。
(5)Cu2O的熔点比Cu2S的 (填“高”或“低”),请解释原因 。
解析:(2)用均摊法可知含阴离子数为8×+4×+2×+1=4。[来源:学_科_网Z_X_X_K]
(3)端点的原子不杂化,而图示结构的SO4单元中含有端点氧原子,所以A项不正确。铜离子与S之间存在离子键,B项正确。胆矾是离子晶体,C项不正确。由图结构可知,胆矾中有1个水分子与其他粒子靠氢键结合,易失去,有4个水分子与Cu2+以配位键结合,较难失去,所以D项正确。
(4)对比NH3与NF3结构可知,F的电负性比N大,N—F成键电子对向F偏移,使NF3中N原子上显正电性,难以形成配位键。
答案:(1)[Ar]3d9或1s22s22p63s23p63d9
(2)4
(3)BD
(4)F的电负性比N大,N—F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子
(5)高 Cu2O与Cu2S相比,阳离子相同,阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu2O的晶格能更大,熔点更高
B组
1.下列性质中,可证明某晶体是离子晶体的是( )
A.易溶于水
B.晶体不导电,熔化时能导电
C.熔点较高
D.晶体不导电,水溶液能导电
解析:A项,离子晶体易溶于水,许多分子晶体也易溶于水,故错误;C项,有的金属晶体的熔点也较高,故错误;D项,许多离子晶体、分子晶体的水溶液都能导电,故错误。常温下固态不导电,但熔融状态能导电的只有离子晶体,故只有B项正确。
答案:B
2.离子晶体一般不具有的特征是( )
A.熔点较高,硬度较大
B.易溶于水而难溶于有机溶剂
C.固体时不能导电
D.离子间距离较大,其密度较小
解析:离子晶体的结构决定着离子晶体具有一系列特性,这些特性包括A、B、C三项;而离子间的距离取决于离子半径的大小及晶体的密堆积形式等。
答案:D
3.下列有关晶格能的叙述正确的是( )
A.晶格能是气态离子形成1 mol离子晶体吸收的能量
B.晶格能通常取正值,但是有时也取负值
C.晶格能越大,形成的离子晶体越稳定
D.晶格能越大,物质的硬度反而越小
解析:晶格能是气态离子形成1 mol离子晶体释放的能量,故A项错误;晶格能通常取正值,而不取负值,故B项错误;晶格能越大,形成的离子晶体越稳定,物质的硬度越大,故C项正确,D项错误。
答案:C
4.离子晶体熔点的高低取决于晶格能的大小,下列物质的熔点不是由大到小排列的是( )
A.NaF>NaCl>NaBr>NaI
B.Na2O>Na2S>NaCl>NaI
C.NaCl>CaCl2>MgCl2>AlCl3
D.MgCO3>CaCO3>SrCO3>BaCO3
解析:晶格能的大小与离子晶体的离子半径和所带的电荷数有关。A项,F-、Cl-、Br-、I-的离子半径依次增大,故其熔点依次降低,即晶格能按由大到小的顺序排列;同理可得出B项、D项的晶格能均按由大到小的顺序排列。C项,因为Ca2+的离子半径大于Mg2+离子半径,故晶格能大小为MgCl2>CaCl2,则C项明显错误。
答案:C
5.下面是从NaCl或CsCl晶体结构中分割出来的部分结构图,其中属于从NaCl晶体中分割出来的结构图是( )
A.①和③ B.②和③
C.①和④ D.④
解析:NaCl晶体是简单立方体结构,每个Na+周围有6个Cl-,每个Cl-周围有6个Na+;与每个Na+等距离的Cl-有6个,且构成正八面体,同理,与每个Cl-等距离的6个Na+也构成正八面体,由此可知①和④是属于NaCl晶体结构中分割出来的部分,故C项正确。
答案:C
6.某离子晶体的晶胞结构如图所示。试求:
(1)晶体中每个Y同时吸引着 个X,每个X同时吸引着 个Y,该晶体的化学式是 。
(2)晶体中在每个X周围与它最近且距离相等的X共有 个。
(3)设该晶体的摩尔质量为M g·mol-1,晶胞密度为ρ g·cm-3,阿伏加德罗常数为NA,则晶体中两个最近的X间的距离为 cm。
解析:此晶胞初看比较复杂,若将X、Y分开来看,X在晶胞中的位置类同NaCl中的Na+或Cl-,如图(a)。体内8个Y分别位于每个小立方体的中心,如图(b)。
根据(a)(b)图,即可得出答案。[来源:学|科|网]
答案:(1)4 8 XY2(或Y2X)
(2)12
(3)
7.金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为 。
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO (填“<”或“>”)FeO。
(3)NiO晶胞中Ni和O的配位数分别为 、 。
[来源:学科网]
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如右图所示。该合金的化学式为 。
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟与Ni2+反应可生成鲜红色沉淀,其结构如下图所示。
①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是 ,氮镍之间形成的化学键是 ;
②该结构中,氧氢之间除共价键外还可存在 ;
③该结构中,碳原子的杂化轨道类型有 。
解析:(2)晶格能与离子半径有关,其他因素相同时,离子半径越大,晶格能越小。(3)由信息可知NiO晶体结构与氯化钠晶体结构相似,所以Ni和O的配位数均为6。(4)La在8个顶点,所以La的数目为=1;Ni有4个位于面心,有一个位于体心,有4个在上、下两个面上,所以Ni的数目为+1=5。(5)①碳、氮原子之间为双键,所以有一个σ键和一个π键;③有的碳原子与其他3个原子结合,属于sp2杂化,有的碳原子与其他4个原子结合,属于sp3杂化。
答案:(1)[Ar]3d84s2或1s22s22p63s23p63d84s2
(2)> (3)6 6 (4)LaNi5
(5)①σ键、π键 配位键 ②氢键 ③sp2杂化、sp3杂化
8.晶胞是晶体中最小的重复单位,数目巨大的晶胞无隙并置构成晶体。NaCl晶体是一个正六面体(如图一)。我们把阴、阳离子看成不等径的圆球,并彼此相切(已知a为常数)。
图一
图二
请计算下列问题:
(1)每个晶胞平均分摊 个Na+, 个Cl-。
(2)NaCl晶体中阴、阳离子的最短距离为 (用a表示)。
(3)NaCl晶体为“巨分子”,在高温下(≥1 413 ℃时)晶体转变成气态团簇分子。现有1 mol NaCl晶体,加强热使其变为气态团簇分子,测得气体体积为11.2 L(已折算为标准状况)。则此时氯化钠气体的分子式为 。
解析:(1)该晶胞中钠离子个数=12×+1=4,氯离子个数=8×+6×=4;(2)根据图二知,NaCl晶体中阴、阳离子的最短距离为a的一半即;(3)1 mol氯化钠的质量=1 mol×58.5 g·mol-1=58.5 g,标准状况下,气体体积为11.2 L的氯化钠的物质的量==0.5 mol,M==117 g·mol-1,所以氯化钠气体的分子式为Na2Cl2。
答案:(1)4 4 (2) (3)Na2Cl2