- 299.08 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时规范练26 水溶液 酸碱中和滴定
一、选择题(本题共9小题,每小题6分,共54分。每小题只有一个选项符合题目要求)
1.(2019湖北部分重点中学高三上学期起点考试)下列有关滴定操作的说法正确的是( )
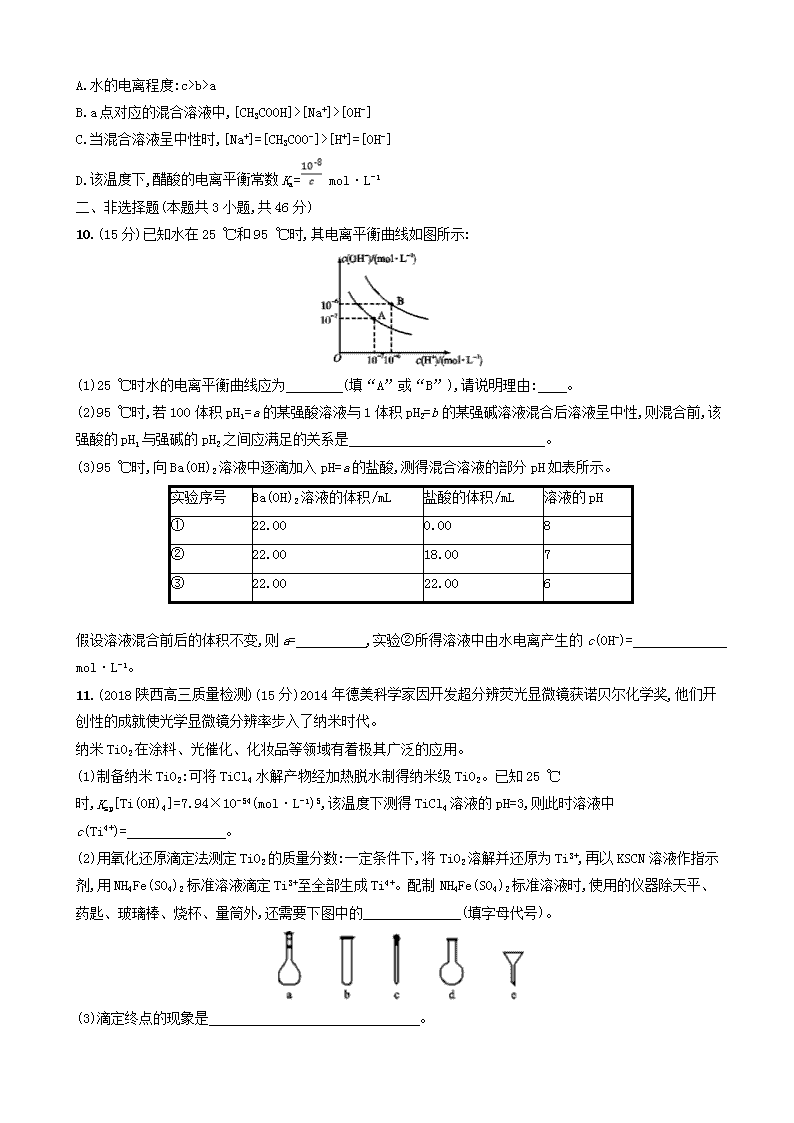
A.用25 mL滴定管进行中和滴定时,用去标准液的体积为21.7 mL
B.用标准的KOH溶液滴定未知浓度的盐酸,洗净碱式滴定管后直接取标准KOH溶液进行滴定,则测定结果偏低
C.用标准的KOH溶液滴定未知浓度的盐酸,配制标准溶液的固体KOH中含有NaOH杂质,则测定结果偏高
D.用未知浓度的盐酸滴定标准的KOH溶液时,若读取读数时,滴定前仰视,滴定到终点后俯视,会导致测定结果偏高
2.(2018贵州七校联考)下列说法不正确的是( )
A.将pH均为a的氢氧化钠溶液和氨水分别加水稀释100倍,pH变为b和c,则a、b、c的大小关系是a>c>b
B.常温下,浓度均为0.1 mol·L-1的①醋酸溶液、②盐酸、③醋酸钠溶液,水的电离程度的顺序为③>①>②
C.常温下,将相同体积的pH=3的硫酸和pH=11的一元碱BOH溶液混合,所得溶液可能为中性,也可能为酸性
D.物质的量浓度相同的①氯化铵溶液、②硫酸铵溶液、③碳酸氢铵溶液,pH的顺序为③>①>②
3.已知NaHSO4在水中的电离方程式为NaHSO4Na++H++S。某温度下,向[H+]=1×10-6mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的[H+]=1×10-2mol·L-1。下列对该溶液的叙述不正确的是( )
A.该温度高于25 ℃
B.由水电离出来的H+的浓度为1×10-10mol·L-1
C.加入NaHSO4晶体抑制水的电离
D.取该溶液加水稀释100倍,溶液中的[OH-]减小
4.(2018河北唐山统考)不同温度下,水溶液中[H+]与[OH-]的关系如图所示。下列有关说法不正确的是 ( )
A.d点对应的食盐水pH=6,呈中性
B.向a点对应的CH3COOH溶液中滴加NaOH溶液至b点,此时[Na+]=[CH3COO-]
C.温度为T ℃时,0.05 mol·L-1Ba(OH)2溶液的pH=11
D.a点对应的稀硫酸与c点对应的CH3COONa溶液中水的电离程度相同
5.(2019深圳市高级中学高三月考)室温下,下列说法正确的是( )
A.将pH=2的盐酸和pH=4的硫酸等体积混合,所得溶液pH=3
B.HF比HCN易电离,则NaF溶液的pH比同浓度NaCN溶液的pH大
C.将10 mL pH=3的HA溶液稀释到100 mL,若溶液的pH<4,则HA为弱酸
D.向0.1 mol·L-1氨水中加入少量硫酸铵固体,溶液中[OH-]/[NH3·H2O]增大
6.(2018河南郑州一中测试)常温下,用0.10 mol·L-1NaOH溶液滴定20.00 mL稀醋酸(CH3COOH),下列说法中正确的是( )
A.当混合溶液的pH>7时,其中不可能存在CH3COOH分子
B.当混合溶液的pH<7时,混合液中[Na+]>[CH3COO-]
C.判断该滴定过程的终点,最好选择甲基橙作为指示剂
D.达到滴定终点时,混合液中[Na+]和[CH3COO-]一定不相等
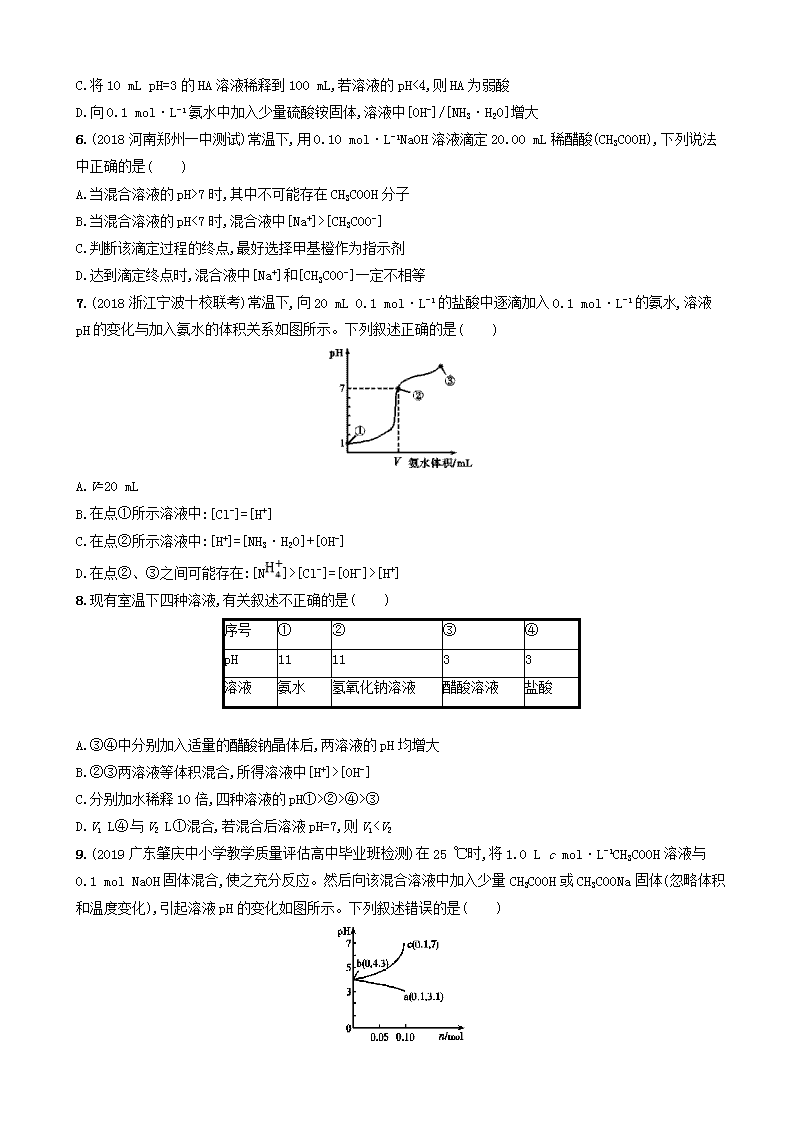
7.(2018浙江宁波十校联考)常温下,向20 mL 0.1 mol·L-1的盐酸中逐滴加入0.1 mol·L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示。下列叙述正确的是( )
A.V=20 mL
B.在点①所示溶液中:[Cl-]=[H+]
C.在点②所示溶液中:[H+]=[NH3·H2O]+[OH-]
D.在点②、③之间可能存在:[N]>[Cl-]=[OH-]>[H+]
8.现有室温下四种溶液,有关叙述不正确的是( )
序号
①
②
③
④
pH
11
11
3
3
溶液
氨水
氢氧化钠溶液
醋酸溶液
盐酸
A.③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B.②③两溶液等体积混合,所得溶液中[H+]>[OH-]
C.分别加水稀释10倍,四种溶液的pH①>②>④>③
D.V1 L④与V2 L①混合,若混合后溶液pH=7,则V1b>a
B.a点对应的混合溶液中,[CH3COOH]>[Na+]>[OH-]
C.当混合溶液呈中性时,[Na+]=[CH3COO-]>[H+]=[OH-]
D.该温度下,醋酸的电离平衡常数Ka= mol·L-1
二、非选择题(本题共3小题,共46分)
10.(15分)已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示:
(1)25 ℃时水的电离平衡曲线应为 (填“A”或“B”),请说明理由: 。
(2)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
(3)95 ℃时,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH如表所示。
实验序号
Ba(OH)2溶液的体积/mL
盐酸的体积/mL
溶液的pH
①
22.00
0.00
8
②
22.00
18.00
7
③
22.00
22.00
6
假设溶液混合前后的体积不变,则a= ,实验②所得溶液中由水电离产生的c(OH-)= mol·L-1。
11.(2018陕西高三质量检测)(15分)2014年德美科学家因开发超分辨荧光显微镜获诺贝尔化学奖,他们开创性的成就使光学显微镜分辨率步入了纳米时代。
纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
(1)制备纳米TiO2:可将TiCl4水解产物经加热脱水制得纳米级TiO2。已知25 ℃时,Ksp[Ti(OH)4]=7.94×10-54(mol·L-1)5,该温度下测得TiCl4溶液的pH=3,则此时溶液中c(Ti4+)= 。
(2)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。配制NH4Fe(SO4)2标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要下图中的 (填字母代号)。
(3)滴定终点的现象是 。
(4)滴定分析时,称取TiO2试样1.80 g,消耗0.400 mol·L-1NH4Fe(SO4)2标准溶液45.00 mL,则试样中TiO2的质量分数为 。
12.(2018河南洛阳期中)(16分)常温下,向浓度为0.1 mol·L-1、体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
(1)该温度时NH3·H2O的电离常数K= 。
(2)比较b、c、d三点时的溶液中,由水电离出的c(OH-)大小顺序为 。
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的是 (填字母,下同)。
A.[H+][OH-]
B.
C.
D.
(4)根据以上滴定曲线判断下列说法正确的是 (溶液中N元素只存在N和NH3·H2O两种形式)。
A.点b所示溶液中:[N]+[H+]=[OH-]+[NH3·H2O]
B.点c所示溶液中:[Cl-]=[NH3·H2O]+[N]
C.点d所示溶液中:[Cl-]>[H+]>[N]>[OH-]
D.滴定过程中可能有:[NH3·H2O]>[N]>[OH-]>[Cl-]>[H+]
(5)滴定过程中所用盐酸的pH= ,d点之后若继续加入盐酸至图像中的e点(此时不考虑N水解的影响),则e点对应的横坐标为 。
课时规范练26 水溶液 酸碱中和滴定
1.D 滴定管精确值为0.01 mL,读数应保留小数点后2位,A项错误;用标准KOH溶液滴定未知浓度的盐酸,洗净碱式滴定管后直接取标准KOH溶液进行滴定,由于没有润洗,标准液浓度减小,消耗标准液体积增大,则测定结果偏高,B项错误;所用的固体KOH中混有NaOH,由于相同质量的氢氧化钠和氢氧化钾,氢氧化钠的物质的量大于氢氧化钾的物质的量,故所配的溶液的OH-浓度偏大,导致消耗标准液的体积偏小,则测定结果偏低,C项错误;用未知浓度的盐酸滴定标准的KOH溶液时,若滴定前仰视读数,滴定至终点后俯视读数,导致消耗的盐酸体积偏小,依据c(酸)=可知测定结果偏高,D项正确。
2.C 稀释碱溶液时,pH逐渐变小,稀释相同倍数时,氢氧化钠溶液的pH变化幅度较大,氨水继续发生电离,pH变化幅度较小,A项正确;醋酸钠为强碱弱酸盐,发生水解反应,促进水的电离,醋酸溶液和盐酸抑制水的电离,由于盐酸是强酸,完全电离,氢离子浓度大,对水的电离的抑制程度大,B项正确;常温下,将相同体积的pH=3的硫酸和pH=11的一元强碱BOH溶液混合,所得溶液呈中性,常温下,将相同体积的pH=3的硫酸和pH=11的一元弱碱BOH溶液混合,碱过量,所得溶液呈碱性,C项错误;(NH4)2SO4和NH4Cl水解,使溶液呈酸性,(NH4)2SO4溶液中H+较多,pH较小,D项正确。
3.D A项,KW=1×10-6mol·L-1×1×10-6mol·L-1=1×10-12(mol·L-1)2,温度高于25 ℃;B、C项,NaHSO4电离出的H+抑制H2O电离,[H+=[OH-]=1×10-10mol·L-1;D项,加H2O稀释,[H+]减小,而[OH-]增大。
4.D 由题给图像可知,d点[H+]=[OH-]=1×10-6mol·L-1,溶液pH=6,呈中性,A项正确;25 ℃时,向a点对应的CH3COOH溶液中滴加NaOH溶液至b点,溶液pH=7,由电荷守恒得[Na+]+[H+]=[OH-]+[CH3COO-],因为[H+]=[OH-],所以[Na+]=[CH3COO-],B项正确;温度为T ℃时,由d点知KW=1×10-12(mol·L-1)2,0.05 mol·L-1的Ba(OH)2溶液中[OH-]=0.1 mol·L-1,[H+]==1×10-11mol·L-1,Ba(OH)2溶液的pH=11,C项正确;a点对应的稀硫酸中[H+]=1×10-6mol·L-1,[OH-]=1×10-8mol·L-1,水电离出的[H+]=[OH-]=1×10-8mol·L-1,水的电离受到抑制,c点对应的CH3COONa溶液中水的电离得到促进,水电离出的[H+]=[OH-]=1×10-6mol·L-1,D项错误。
5.C 混合后[H+]= mol·L-1≈0.5×10-2mol·L-1,pH=2.3,故A项错误;根据越弱越水解的原则,HF比HCN易电离,则NaF溶液的pH比同浓度NaCN溶液的pH小,故B项错误;将10 mLpH=3的HA溶液稀释到100 mL,如pH=4,则HA为强酸,如pH<4,加水促进弱酸的电离,则HA为弱酸,故C项正确;向0.1 mol·L-1氨水中加入少量硫酸铵固体,加入少量硫酸铵固体,平衡向逆方向移动,溶液中减小,故D项错误。
6.D 当混合溶液的pH>7时,溶质主要是CH3COONa,要发生水解,生成CH3COOH分子,故A项错误;当混合溶液的pH<7时,[H+]>[OH-],又溶液中存在电荷守恒:[Na+]+[H+]=[CH3COO-]+[OH-],故[Na+]<[CH3COO-],故B项错误;甲基橙的变色范围是pH<3.1时变红,pH>4.4时变黄,3.1~4.4时呈橙色,该反应生成物是CH3COONa,水溶液呈碱性,应选用酚酞作指示剂,故C项错误;达到滴定终点时,溶液呈碱性,由电荷守恒:[Na+]+[H+]=[CH3COO-]+[OH-],故[Na+]>[Ac-],D项正确。
7.D NH3·H2O属于弱碱,HCl属于强酸,②点pH=7溶液显中性,氨水稍过量,即V略大于20 mL,故A项错误;根据电荷守恒,有[H+]=[Cl-]+[OH-],故B项错误;②点pH=7,因此[H+]=[OH-],故C项错误;②和③之间溶质为NH3·H2O和NH4Cl,因此可能存在[N]>[Cl-]=[OH-]>[H+],故D项正确。
8.D 从平衡移动角度分析,CH3COONa电离出的CH3COO-:a.与盐酸中的H+结合生成CH3COOH;b.使醋酸溶液中电离平衡CH3COOHCH3COO-+H+左移,两溶液中H+浓度均减小,所以pH均增大,A项正确;假设均是强酸强碱,且物质的量浓度相同,等体积混合后溶液呈中性,但③醋酸是弱酸,其浓度远远大于②,即混合后醋酸过量,溶液显酸性,[H+]>[OH-],B项正确;分别加水稀释10倍,假设平衡不移动,那么①②溶液的pH均为10,但稀释氨水使电离平衡NH3·H2ON+OH-右移,使①pH>10,同理稀释醋酸溶液后pH<4,C项正确;假设均是强酸强碱,混合后溶液呈中性,V1=V2,但①氨水是弱碱,其浓度远远大于④盐酸,所以需要的①氨水少,即V1>V2,D项错误。
9.D 由图可得,25 ℃时c点pH=7,所以c点水电离出的[H+]水=[OH-]水=10-7mol·L-1,b点pH=4.3,所以b点溶液中[H+]=10-4.3mol·L-1,则由水电离出的[H+]水=[OH-]水=10-(14-4.3)mol·L-1=10-9.7mol·L-1,a点pH=3.1,所以a点溶液中[H+]=10-3.1mol·L-1,则由水电离出的[H+]水==10-(14-3.1)mol·L-1=10-10.9mol·L-1,因此水的电离程度:c>b>a,A项叙述正确;b点时溶液呈酸性,说明加入0.1 mol NaOH固体后CH3COOH有剩余,[Na+]=0.1 mol·L-1,混合前CH3COOH溶液浓度c应比0.1 mol·L-1大,a点时又加入0.1 mol CH3COOH,因为CH3COOH电离程度很小,所以此时溶液中的[CH3COOH]一定大于[Na+],又根据前面的分析a点[OH-]=10-10.9mol·L-1,所以a点对应的混合溶液中,[CH3COOH]>[Na+]>[OH-],故B项叙述正确;由题意混合溶液中阳离子有Na+和H+,阴离子有CH3COO-和OH-,根据电荷守恒[Na+]+[H+]=[CH3COO-]+[OH-],25 ℃当混合溶液呈中性时,[H+]=[OH-]=10-7mol·L-1,则[Na+]=[CH3COO-],结合图像可得[Na+]=0.2 mol·L-1,所以[Na+]=[CH3COO-]>[H+]=[OH-],故C项叙述正确;由前面的分析并结合图像可得,25 ℃当混合溶液呈中性时,[H+]=10-7mol·L-1,[CH3COO-]=0.2 mol·L-1,[CH3COOH]=(c+0.1-0.2)mol·L-1=(c-0.1)mol·L-1,所以该温度下,醋酸的电离平衡常数Ka= mol·L-1= mol·L-1,故D项叙述错误。
10.答案 (1)A 水的电离是吸热过程,温度较低时,电离程度较小,[H+]、[OH-]均较小
(2)a+b=14(或pH1+pH2=14) (3)4 1.0×10-7
解析 (1)温度升高,促进水的电离,水的离子积增大,水中氢离子浓度、氢氧根离子浓度都增大,水的pH减小,但溶液仍然呈中性。因此结合图像中A、B曲线变化情况及氢离子浓度、氢氧根离子浓度可以判断,25 ℃时水的电离平衡曲线应为A。
(2)要注意95 ℃时,水的离子积为1×10-12,即[H+][OH-]=1×10-12,则等体积强酸、强碱反应至中性时,有pH(酸)+pH(碱)=12。根据95 ℃时混合后溶液呈中性,pH2=b的某强碱溶液中[OH-]=1mol·L-1;由100V×10-amol·L-1=V×1mol·L-1,可得1=1,得a+b=14或pH1+pH2=14。
(3)95 ℃,pH=6时溶液呈中性,根据表中实验①数据可得[OH-]=1.0×10-4mol·L-1,根据表中实验③的数据可以判断,盐酸中的[H+]与Ba(OH)2溶液中[OH-]相等,所以a=4,即pH=4;实验②溶液呈碱性,其[OH-]= mol·L-1=1.0×10-5mol·L-1,由水电离出的[OH-]=1.0×10-7mol·L-1。
11.答案 (1)7.94×10-10mol·L-1 (2)ac (3)溶液变为红色,且半分钟内不变色 (4)80%
解析 (1)TiCl4溶液的pH=3,[OH-]=10-11mol·L-1,Ksp[Ti(OH)4]=7.94×10-54(mol·L-1)5,则[Ti4+][OH-]4=[Ti4+]×(10-11)4=7.94×10-54(mol·L-1)5,[Ti4+]=7.94×10-10 mol·L-1;(2)配制NH4Fe(SO4)2标准溶液时,使用的仪器有天平、药匙、玻璃棒、烧杯、量筒、容量瓶、胶头滴管等,故选ac;(3)达到滴定终点时,Fe3+不再被还原为Fe2+,所以滴定终点的现象是溶液变为红色,且半分钟内不变色;
(4)设TiO2的质量分数为a,
TiO2 ~ NH4Fe(SO4)2;
80 g 1 mol
1.80 g×a 0.400 mol·L-1×0.045 L
,a=0.8=80%。
12.答案 (1)10-5mol·L-1 (2)d>c>b (3)ACD (4)D (5)1
解析 (1)未加入盐酸前,0.1 mol·L-1氨水的pH=11,则溶液中[OH-]= mol·L-1=0.001 mol·L-1;由于水的电离程度较小,可忽略水的电离,则溶液中[N]≈[OH-]=0.001 mol·L-1;NH3·H2O的电离程度较小,则[NH3·H2O]≈0.1 mol·L-1,故该温度时NH3·H2O的电离常数K=mol·L-1=10-5mol·L-1。(2)b、c两点溶液中都含有NH3·H2O,抑制水的电离,且[NH3·H2O]越大,对水的电离的抑制程度越大,d点氨水与盐酸恰好完全反应生成NH4Cl,N发生水解而促进水的电离,故三点水电离出的[OH-]大小顺序为d>c>b。(3)滴定时,由b点到c点的过程中,[H+][OH-]=KW,由于温度不变,则KW不变,A项正确;随着反应的进行,溶液的碱性减弱,溶液中[OH-]减小而[H+]增大,故的值增大,B项错误;NH3·H2O的电离常数Kb=,温度不变,则Kb不变,即保持不变,C项正确;,温度不变,则KW、Kb均不变,即不变,D项正确。(4)b点溶液为等浓度NH4Cl和NH3·H2O的混合液,溶液呈碱性,说明NH3·H2O的电离程度大于N的水解程度,据电荷守恒可得[N]+[H+]=[OH-]+[Cl-],据物料守恒可得2[Cl-]=[N]+[NH3·H2O],综合上述两式可得[N]+2[H+]=[NH3·H2O]+2[OH-],A项错误;c点溶液的pH=7,则有[H+]=[OH-],结合电荷守恒式可得[N]=[Cl-]>[H+]=[OH-],B项错误;d点盐酸与氨水恰好完全反应生成NH4Cl,N发生水解而使溶液呈酸性,但其水解程度较小,故离子浓度关系为[Cl-]>[N]>[H+]>[OH-],C项错误;当加入盐酸的量较少时,氨水中[NH3·H2O]较大,生成的NH4Cl较少,溶液中[NH3·H2O]远大于[NH4Cl],可能出现[NH3·H2O]>[N]>[OH-]>[Cl-]>[H+],D项正确。(5)由题图可知,d点盐酸与氨水恰好完全反应生成NH4Cl,由NH3·H2O~HCl可知,[HCl]=0.1 mol·L-1×=0.1 mol·L-1,故滴定过程中所用盐酸的pH=1。设e点加入盐酸的体积为x L,则剩余盐酸的量n余(HCl)=0.1 mol·L-1×x L-0.1 mol·L-1×V L=0.1(x-V) mol,此时溶液的pH=2,则有0.1(x-V) mol=10-2mol·L-1×(x+V) L,解得x=。
相关文档
- 2020鲁科版高考化学复习规范练 (242021-08-238页
- 2020鲁科版高考化学复习规范练 (4)2021-08-237页
- 2020鲁科版高考化学复习规范练 (322021-08-238页
- 2020鲁科版高考化学复习规范练 (3)2021-08-236页
- 2020鲁科版高考化学复习规范练 (102021-08-067页
- 2020鲁科版高考化学复习规范练 (142021-08-067页
- 2020鲁科版高考化学复习规范练 (382021-08-068页
- 2020鲁科版高考化学复习规范练 (372021-07-089页
- 2020鲁科版高考化学复习规范练 (222021-07-086页
- 2020鲁科版高考化学复习规范练 (8)2021-07-077页