- 2.90 MB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
10
讲 金属及其化合物
知识网络构建
热点考点突破
热点题源预测
知识网络构建
热点考点突破
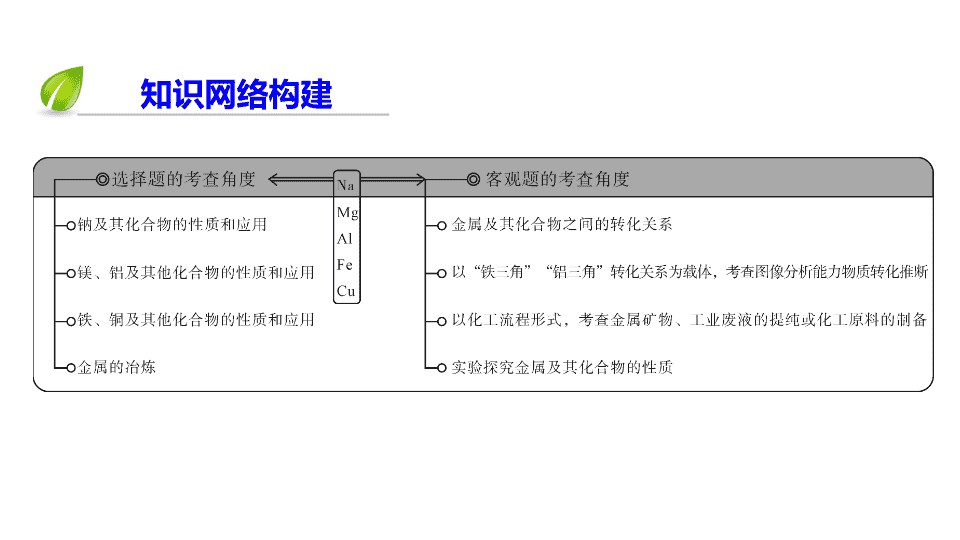
考点一 常见金属及其重要化合物的性质和应用
命题规律
:
1
.
题型:
选择题
(
主
)
,填空题。
2
.
考向:
选择题主要是考查金属及其化合物的主要性质及应用,
Ⅱ
卷主要结合具体工艺流程及实验探究,考查金属及其重要化合物性质。同时,兼顾考查了氧化还原反应原理,离子方程式的书写,化学计算及化工工艺等知识。
方法点拨
:
1
.下列说法中正确的是
__________________
。
(1)
碳酸钠可用于去除餐具的油污
(2)
氢氧化铝可用于中和过多胃酸
(3)
NaHCO
3
受热易分解,所以可用于制胃酸中和剂
(4)
KAl(SO
4
)
2
·
12H
2
O
溶于水可形成
Al(OH)
3
胶体
(5)
CaO
能与水反应,所以可用作食品干燥剂
(6)
Al
2
O
3
是两性氧化物,所以可用作耐高温材料
(7)
商代后期铸造出工艺精湛的后
(
司
)
母戊鼎,该鼎属于铜合金制品
(8)
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来,原因是金属铝的熔点较低
(9)
将铁屑放入稀
HNO
3
中证明
Fe
比
H
2
活泼
(10)
将氯化铝溶液滴入到浓氢氧化钠溶液,立即产生大量白色沉淀
(11)
为了除去
NaHCO
3
固体中的
Na
2
CO
3
,可将固体加热至恒重
(12)
根据铁比铜活泼,在实际应用中可用
FeCl
3
溶液腐蚀铜刻制印刷电路板
答案
(1)(2)(4)(5)(7)
突破点拨
记住常见物质的用途,而且关键点是:该用途所对应的物质的性质。
解析
(1)
碳酸钠水解显碱性,能使油污发生水解反应而除去,正确;
(2)
氢氧化铝可与胃酸盐酸反应,从而可作胃药,正确;
(3)NaHCO
3
是因为可以消耗胃酸而作胃酸中和剂,错误;
(4)
明矾溶于水水解产生氢氧化铝胶体,正确;
(5)
生石灰能消耗水,从而可作食品干燥剂,正确;
(6)Al
2
O
3
用作来高温材料是因为其熔点高,错误;
(7)
司母戊鼎是青铜器,属于铜合金,正确;
(8)
熔化后的液态铝不能滴落下来,原因是产生的氧化铝熔点比铝的熔点高,错误;
(9)
铁与稀硝酸反应不能产生氢气而是
NO
,错误;
(10)
将氯化铝溶液滴入浓氢氧化钠溶液,开始时产物为偏铝酸钠,而不是氢氧化铝,错误;
(11)
加热时
NaHCO
3
分解转化为
Na
2
CO
3
,错误;
(12)FeCl
3
溶液腐蚀铜的反应不能说明铁比铜活泼,错误。
【变式考法】
下列说法中正确的是
_____________________
。
(1)
用热的烧碱溶液洗去油污,是因为
Na
2
CO
3
可直接与油污反应
(2)
海水中提取金属镁所有的反应均为氧化还原反应
(3)
越活泼的金属制品,在空气中一定越容易被腐蚀,金属在空气中久置均变成氧化物
(4)
工业上冶炼铝和镁,均电解其熔融的氯化物
(5)
向
CuSO
4
溶液中加入镁条时有气体生成,该气体是
H
2
(6)
已知反应:
BeCl
2
+
Na
2
BeO
2
+
2H
2
O=== 2NaCl
+
2Be(OH)
2
↓
能完全进行,所以
Be(OH)
2
为两性氢氧化物
(7)
Fe
3
O
4
可用作红色油漆和涂料,
Na
2
O
2
可用作呼吸面具
(8)
高铁酸钠可进行水体处理,既可消毒又可以净水
(9)
铁生锈及高温下与水蒸气反应均生成
Fe
2
O
3
(10)
细铁粉可作食品抗氧剂
(11)
中国古代利用明矾溶液的酸性清除铜镜表面的铜锈,现在也经常用硫酸铜进行游泳池水体消毒
解析
(1)
热的烧碱溶液洗去油污不是碳酸钠直接与油脂反应,而是其水解产生的碱性使油脂水解,错误;
(2)
海水中提取金属镁其中有些是复分解反应,错误;
(3)
铝和镁比铁活泼,但是因为易形成致密的氧化膜,所以反而不易腐蚀;钠在空气中久置产物为碳酸钠,铜转化为碱式碳酸铜,错误;
(4)
工业上用氧化铝制备铝,因为氯化铝不是离子化合物,熔化不导电,错误;
(5)CuSO
4
溶液显酸性,加入镁条时生成气体是
H
2
,正确;
(6)
由方程式可知
Be(OH)
2
既可以生成
BeCl
2
,又可以生成
Na
2
BeO
2
,所以与氢氧化铝相似为两性氢氧化物,正确;
答案
(5)(6)(8)(10)(11)
(7)
作红色油漆和涂料的物质不是
Fe
3
O
4
,是
Fe
2
O
3
,错误;
(8)
高铁酸钠有强氧化性,所以可以杀菌消毒,其还原产生的铁离子可以水解产生氢氧化铁胶体,所以可以净水,正确;
(9)
铁在高温下与水蒸气反应均生成
Fe
3
O
4
,错误;
(10)
细铁粉有还原性能与氧气反应,从而可作食品的抗氧化剂,正确;
(11)
明矾水解显酸性,可与碱式碳酸铜反应;硫酸铜为重金属盐,能使蛋白质变性,常用作游泳池水体消毒 ,正确。
2
.
在给定条件下,下列选项所示的物质间转化均能实现的是
(
)
A
解析
Al
与
NaOH
溶液反应生成
NaAlO
2
和
H
2
,
NaAlO
2
与过量盐酸反应生成
NaCl
、
AlCl
3
和
H
2
O
,选项
B
错误;
AgNO
3
中加入氨水可获得银氨溶液,蔗糖中不含醛基,蔗糖不能发生银镜反应,选项
C
错误;
Al
与
Fe
2
O
3
高温发生铝热反应生成
Al
2
O
3
和
Fe
,
Fe
与
HCl
反应生成
FeCl
2
和
H
2
,选项
D
错误。
3
.
以高硫铝土矿
(
主要成分为
Al
2
O
3
、
Fe
2
O
3
、
SiO
2
,少量
FeS
2
和金属硫酸盐
)
为原料,生产氧化铝并获得
Fe
3
O
4
的部分工艺流程如下:
(1)
焙烧过程均会产生
SO
2
,用
NaOH
溶液吸收过量
SO
2
的离子方程式为
________________________
__
__
。
(2)
添加
1%CaO
和不添加
CaO
的矿粉焙烧,其硫去除率随温度变化曲线如图所示。
硫元素转化为
CaSO
4
而留在矿粉中
FeS
2
NaAlO
2
Al(OH)
3
1∶16
考点二 生产及实验中金属离子推断与检验应用
命题规律
:
1
.
题型:
选择题,填空题。
2
.
考向:
选择题主要考查常见金属离子的性质,常将金属离子的特性作为推断的题眼。
Ⅱ
卷主要是在工艺流程中根据目标产物与金属离子的性质差异考查检验与除杂方式的选择。
(2)
特殊检验法
同时存在
Fe
3
+
和
Fe
2
+
时检验
Fe
2
+
:加入酸性
KMnO
4
溶液,酸性
KMnO
4
溶液褪色。
(3)
焰色反应
2
.
常见阳离子的净化方法
主要离子
杂质离子
除杂试剂和方法
Fe
3
+
Fe
2
+
加入
H
2
O
2
Fe
2
+
Fe
3
+
加入过量铁粉,过滤
Fe
2
+
Cu
2
+
加入过量铁粉,过滤
Mg
2
+
Fe
3
+
加入
MgO
或
MgCO
3
或
Mg(OH)
2
,过滤
Mg
2
+
Fe
2
+
先加入
H
2
O
2
,再加入
MgO
或
MgCO
3
或
Mg(OH)
2
,过滤
Cu
2
+
Fe
3
+
加入
CuO
或
Cu(OH)
2
或
CuCO
3
或
Cu
2
(OH)
2
CO
3
,过滤
Cu
2
+
Fe
2
+
先加入
H
2
O
2
,再加入
CuO
或
Cu(OH)
2
或
CuCO
3
或
Cu
2
(OH)
2
CO
3
,过滤
1
.
(1)
下列说法中正确的是
______
。
A
.
用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有
Na
+
B
.
某溶液中滴加
K
3
[Fe(CN)
6
]
溶液产生蓝色沉淀,则原溶液中有
Fe
2
+
,无
Fe
3
+
C
.
检验溶液中是否含有
Fe
2
+
:取少量待检验溶液,向其中加入少量新制氯水,再滴加
KSCN
溶液,观察实验现象
D
.
只滴加氨水鉴别
NaCl
、
AlCl
3
、
MgCl
2
、
Na
2
SO
4
四种溶液
A
3FeC
2
O
4
+
2K
3
[Fe(CN)
6
]===Fe
3
[Fe(CN)
6
]
2
+
3K
2
C
2
O
4
(3)
工业上利用硫铁矿烧渣
(
主要成分为
Fe
2
O
3
、
FeO
、
SiO
2
等
)
为原料制备高档颜料铁红
(Fe
2
O
3
)
,具体生产流程如下:
试回答下列问题:
①
滤液
X
中含有的金属阳离子是
______________(
填离子符号
)
。
②
步骤
Ⅲ
中可选用
______
调节溶液的
pH(
填字母
)
。
A
.稀硝酸
B
.氨水
C
.氢氧化钠溶液
D
.高锰酸钾溶液
③
步骤
Ⅳ
中,
FeCO
3
沉淀完全后,溶液中含有少量
Fe
2
+
,检验
Fe
2
+
的方法是
____________________________________________ __________________________
。
Fe
2
+
、
Fe
3
+
B
取少量溶液,加入硫氰化钾溶液,不显红色,然后滴加氯水,溶液变为红色
突破点拨
熟悉各反应现象才能确定某些离子的存在。例如:加碱产生的使红色石蕊试纸变蓝色的气体必是
NH
3
。要特别注意信息所给出的反应,重视
Fe
2
+
的特征反应现象检验。
解析
(1)
钠的焰色反应为黄色,选项
A
正确;滴加
K
3
[Fe(CN)
6
]
溶液产生蓝色沉淀证明有
Fe
2
+
,
Fe
3
+
无法确定,选项
B
错误;检验
Fe
2
+
应该先加
KSCN
溶液,再加少量新制氯水,选项
C
错误;
NaCl
、
AlCl
3
、
MgCl
2
、
Na
2
SO
4
四种溶液滴加氨水时现象分别为:无明显现象、白色沉淀、白色沉淀、无明显现象,所以无法鉴别,选项
D
错误。
(2)
根据亚铁离子能与
K
3
[Fe(CN)
6
]
发生显色反应,分析反应物类别与成分的化合价;
(3)
①
硫铁矿烧渣
(
主要成分为
Fe
2
O
3
、
FeO
、
SiO
2
等
)
酸浸后过滤,
SiO
2
为滤渣,滤液中含有的金属阳离子是
Fe
2
+
、
Fe
3
+
。
②
步骤
Ⅲ
要把
pH
调高,步骤
Ⅳ
还要加
NH
4
HCO
3
,若使用氢氧化钠溶液,产品中容易混入
Na
+
,选项
B
正确。
【变式考法】
NH
4
Al(SO
4
)
2
·
12H
2
O
俗称铵明矾,其性质稳定,是化学实验常用的基准试剂,借助碳酸氢铵与硫酸钠可以制备纯净的铵明矾,制备过程如下图。下面相关说法错误的是
(
)
A
.为加快操作
Ⅰ
的速率实验时采用抽滤,常用玻璃纤维替代滤纸
B
.操作
Ⅰ
的基本过程为蒸发浓缩、冷却结晶、过滤、洗涤、干燥
C
.使用
NaOH
和
BaCl
2
试剂可以检验铵明矾的三种离子
D
.若气体
a
通入到饱和的纯碱溶液中会有晶体析出,该晶体与固体
a
相同
答案
C
解析
玻璃纤维性质稳定,且韧性比滤纸的韧性好,可以替代使用,加快抽滤速率, 选项
A
正确;碳酸氢铵饱和液与硫酸钠溶液混合反应后生成碳酸氢钠和硫酸铵,然后制成高温时的饱和液,进行蒸发浓缩、冷却结晶、过滤、洗涤、干燥操作,可以得到碳酸氢钠固体,选项
B
正确;氢氧化钠可以检验铵根离子和铝离子,但是仅用
BaCl
2
无法确定硫酸根根离子存在,应该还要使用盐酸,选项
C
错误;气体
a
为二氧化碳,通入到饱和的纯碱溶液中会有产生碳酸氢钠晶体析出,与固体
a
成分相同,选项
D
正确 。
2
.某班同学用如下实验探究
Fe
2
+
、
Fe
3
+
的性质。回答下列问题:
(1)
分别取一定量氯化铁、氯化亚铁固体,均配制成
0.1 mol
·
L
-
1
的溶液。在
FeCl
2
溶液中需加入少量铁屑,其目的是
__________________
。
(2)
甲组同学取
2 mL FeCl
2
溶液,加入几滴氯水,再加入
1
滴
KSCN
溶液,溶液变红,说明
Cl
2
可将
Fe
2
+
氧化。
FeCl
2
溶液与氯水反应的离子方程式为
____________________________
。
防止
Fe
2
+
被氧化
2Fe
2
+
+
Cl
2
===2Fe
3
+
+
2Cl
-
(3)
乙组同学认为甲组的实验不够严谨,该组同学在
2 mL FeCl
2
溶液中先加入
0.5 mL
煤油,再于液面下依次加入几滴氯水和
1
滴
KSCN
溶液,溶液变红,煤油的作用是
_____________________ ________________
。
隔绝空气
(
排除氧气对实验的影响
)
(4)
丙组同学取
10 mL 0.1 mol
·
L
-
1
KI
溶液,加入
6 mL 0.1 mol
·
L
-
1
FeCl
3
溶液混合。分别取
2 mL
此溶液于
3
支试管中进行如下实验:
①
第一支试管中加入
1 mL CCl
4
充分振荡、静置,
CCl
4
层显紫色;
②
第二支试管中加入
1
滴
K
3
[Fe(CN)
6
]
溶液,生成蓝色沉淀;
③
第三支试管中加入
1
滴
KSCN
溶液,溶液变红。
实验
②
检验的离子是
________(
填离子符号
)
;实验
①
和
③
说明:在
I
-
过量的情况下,溶液中仍含有
________(
填离子符号
)
,由此可以证明该氧化还原反应为
____________
。
Fe
2
+
Fe
3
+
可逆反应
热点题源预测
无机化工生产流程题突破
考向预测
无机化工生产流程题是将化工生产中的主要生产流程用框图形式表示出来,并根据其中涉及的化学知识步步设问,设计一系列问题,既能考查元素及其化合物的知识、基础实验,又能考查考生应用化学反应原理解决实际生产问题的能力
解题关键
(1)
明确原始物质及目标物质。
(2)
明确化工生产流程:原料
→
对原料的预处理
→
核心化学反应
→
产品的提纯分离
→
目标产物。
(3)
掌握主要的化工生产原理等。
(4)
掌握常见与化工生产有关的操作方法及作用。
①
对原料进行预处理的常用方法及其作用:
失分防范
(1)
明确整个流程及每一部分的目的
→
仔细分析每步反应发生的条件以及得到产物的物理或化学性质
→
结合基础理论与实际问题思考
→
注意答题的模式与要点;
(2)
抓住流程图中
“
每步转化的物质变化
”
与总过程目的的关系,分析某步转化试剂的选择及流程中加入某试剂的原因,得出转化后生成的所有物质,从问题中获取信息,帮助解题
【预测】
二氧化铈
(CeO
2
)
是一种重要的稀土化合物。以氟碳铈矿
(
主要含
CeFCO
3
)
为原料制备
CeO
2
的一种工艺流程如下:
回答下列问题:
(1)
“
氧化焙烧
”
前需将矿石粉碎成细颗粒,其目的是
____________________________
。
(2)
“
酸浸
”
中会产生大量黄绿色气体,写出
CeO
2
与盐酸反应的离子方程式:
__________
为避免产生上述污染,请提出一种解决方案:
__________
。
(4)
“
反萃取
”
中,在稀硫酸和
H
2
O
2
的作用下
CeO
2
转化为
Ce
3
+
。
H
2
O
2
在该反应中作
__________(
填
“
催化剂
”“
氧化剂
”
或
“
还原剂
”
)
,每有
1 mol H
2
O
2
参加反应,转移电子的物质的量为
__________
。
(5)
“
氧化
”
步骤的化学方程式为
__________
。
(6)
取上述流程中得到的
CeO
2
产品
0.450 0 g
,加硫酸溶解后,用
0.100 0 mol/L FeSO
4
标准溶液滴定至终点时
(
铈被还原为
Ce
3
+
,其他杂质均不反应
)
,消耗
25.00 mL
标准溶液。该产品中
CeO
2
的质量分数为
__________
。
【变式考法】
1
.
以含钴废催化剂
(
主要成分为
Co
、
Fe
、
SiO
2
)
为原料,制取氧化钴的流程如下:
(1)
溶解:溶解后过滤,将滤渣洗涤
2
~
3
次,洗液与滤液合并,其目的是
________________________
。所得滤渣的主要成分为
__________
。
提高钴等元素的利用率
SiO
2
取氧化后的溶液少许于试管中,滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则
Fe
2
+
已全部被氧化
3Fe
2
(SO
4
)
3
+
6H
2
O
+
6Na
2
CO
3
===Na
2
Fe
6
(SO
4
)
4
(OH)
12
↓
+
5Na
2
SO
4
+
6CO
2
↑
见解析
(5)
溶解:
CoCl
2
的溶解度曲线如图所示。向碱式碳酸钴中加入足量稀盐酸,边加热 边搅拌至完全溶解后,需趁热过滤,其原因是
_____________________________
。
(6)
灼烧:准确称取所得
CoC
2
O
4
1.470 g
,在空气中充分灼烧得
0.830 g
氧化钴,写出氧化钴的化学式
____________
。
Co
2
O
3
防止因温度降低,
CoCl
2
晶体析出
解析
(1)
由流程图以及各成分性质可知
“
溶解
”
时,
Co
、
Fe
被溶解成硫酸盐,而
SiO
2
不反应成为滤渣,而滤渣表面会残留滤液,所以洗涤的目的主要是减少钴元素的损失;
(2)
根据氧化还原反应的一般规律,
NaClO
3
将
Fe
2
+
氧化成
Fe
3
+
的同时,本身被还原为氯离子;根据提示信息,溶液中
Fe
2
+
加入铁氰化钾会生成蓝色沉淀,因此取氧化后的溶液少许于试管中,滴加几滴铁氰化钾溶液,若无蓝色沉淀生成,则
Fe
2
+
已全部被氧化。
(3)
根据氧化后的溶液中存在
Fe
2
(SO
4
)
3
,除铁时加入适量的
Na
2
CO
3
调节酸度,生成黄钠铁矾
[Na
2
Fe
6
(SO
4
)
4
(OH)
12
]
沉淀,同时应该生成二氧化碳气体,结合质量守恒定律,还有硫酸钠生成,因为产物中含
H
元素,反应物中需有水参加反应。
(4)
根据洗涤沉淀的一般方法,洗涤的操作是向漏斗中加入蒸馏水至浸没沉淀,静置使滤液流出。重复操作
2
~
3
次。
(5)CoCl
2
的溶解度受温度影响较大,趁热过滤的原因是防止温度降低后,
CoCl
2
晶体析出。