- 526.00 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
无机化工生产流程题(非选择题)
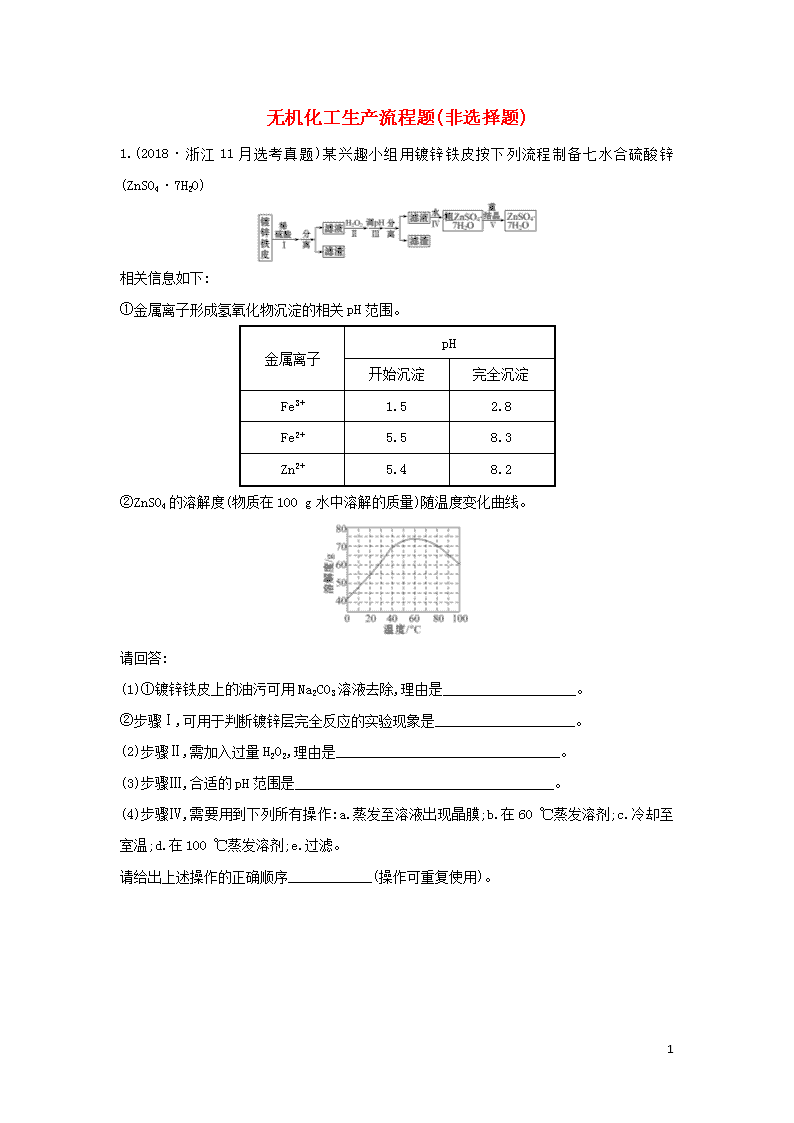
1.(2018·浙江11月选考真题)某兴趣小组用镀锌铁皮按下列流程制备七水合硫酸锌(ZnSO4·7H2O)
相关信息如下:
①金属离子形成氢氧化物沉淀的相关pH范围。
金属离子
pH
开始沉淀
完全沉淀
Fe3+
1.5
2.8
Fe2+
5.5
8.3
Zn2+
5.4
8.2
②ZnSO4的溶解度(物质在100 g水中溶解的质量)随温度变化曲线。
请回答:
(1)①镀锌铁皮上的油污可用Na2CO3溶液去除,理由是___________________。
②步骤Ⅰ,可用于判断镀锌层完全反应的实验现象是____________________。
(2)步骤Ⅱ,需加入过量H2O2,理由是________________________________。
(3)步骤Ⅲ,合适的pH范围是_____________________________________。
(4)步骤Ⅳ,需要用到下列所有操作:a.蒸发至溶液出现晶膜;b.在60 ℃蒸发溶剂;c.冷却至室温;d.在100 ℃蒸发溶剂;e.过滤。
请给出上述操作的正确顺序____________(操作可重复使用)。
8
(5)步骤Ⅴ,某同学采用不同降温方式进行冷却结晶,测得ZnSO4·7H2O晶体颗粒大小分布如图1所示。根据该实验结果,为了得到颗粒大小相对均一的较大晶粒,宜选择________方式进行冷却结晶。
A.快速降温 B.缓慢降温 C.变速降温
(6)ZnSO4·7H2O产品的纯度可用配位滴定法测定。
①下列关于滴定分析,正确的是________。
A.图2中,应将凡士林涂在旋塞的a端和旋塞套内的c端
B.滴定前,锥形瓶和滴定管均需用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
E.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得的体积比实际消耗的小
②图3中显示滴定终点时的读数是________mL。
【解析】(1)①碳酸钠水解,溶液显碱性,促进油污水解。②镀锌层完全反应后,无法形成锌铁原电池,产生气泡的速率会显著变慢。
(2)要使滤液中的Fe2+尽可能被氧化转化为Fe3+,需加入尽可能多的H2O2;另外,H2O2在 Fe3+催化下会加速分解产生氧气,所以需加入过量H2O2。
(3)步骤Ⅲ中,要使Fe3+沉淀完全,Zn2+不沉淀,故合适的pH范围是2.8~5.4。
(4)步骤Ⅳ中,需要蒸发掉水,得到粗ZnSO4·7H2O,由题中图可知,ZnSO4·7H2O的溶解度在60℃时最高,在100℃蒸发溶剂至溶液出现晶膜,冷却至60℃时晶膜消失,所以在60℃继续蒸发溶剂,至溶液出现晶膜,然后再冷却至室温,过滤。
(5)由图1所示,为了得到颗粒大小相对均一的ZnSO4·7H2O较大晶粒,宜选择变速降温方式进行冷却结晶。
8
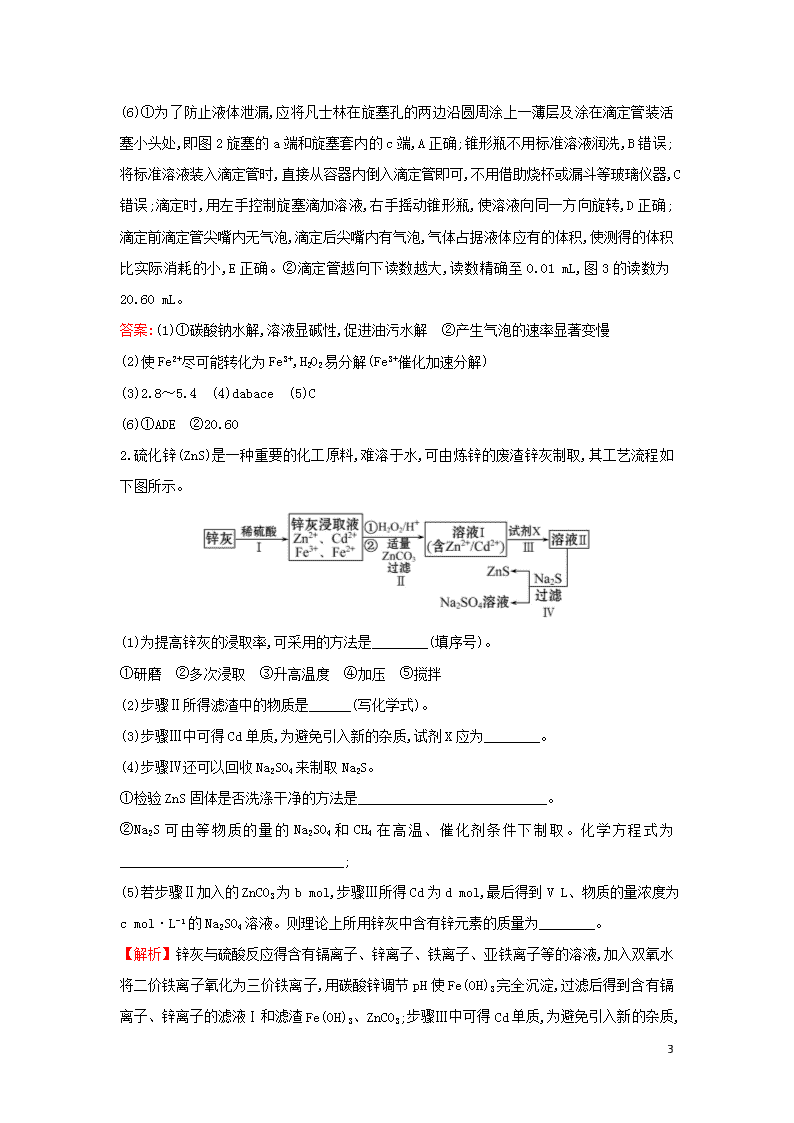
(6)①为了防止液体泄漏,应将凡士林在旋塞孔的两边沿圆周涂上一薄层及涂在滴定管装活塞小头处,即图2旋塞的a端和旋塞套内的c端,A正确;锥形瓶不用标准溶液润洗,B错误;将标准溶液装入滴定管时,直接从容器内倒入滴定管即可,不用借助烧杯或漏斗等玻璃仪器,C错误;滴定时,用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转,D正确;滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,气体占据液体应有的体积,使测得的体积比实际消耗的小,E正确。②滴定管越向下读数越大,读数精确至0.01 mL,图3的读数为20.60 mL。
答案:(1)①碳酸钠水解,溶液显碱性,促进油污水解 ②产生气泡的速率显著变慢
(2)使Fe2+尽可能转化为Fe3+,H2O2易分解(Fe3+催化加速分解)
(3)2.8~5.4 (4)dabace (5)C
(6)①ADE ②20.60
2.硫化锌(ZnS)是一种重要的化工原料,难溶于水,可由炼锌的废渣锌灰制取,其工艺流程如下图所示。
(1)为提高锌灰的浸取率,可采用的方法是________(填序号)。
①研磨 ②多次浸取 ③升高温度 ④加压 ⑤搅拌
(2)步骤Ⅱ所得滤渣中的物质是______(写化学式)。
(3)步骤Ⅲ中可得Cd单质,为避免引入新的杂质,试剂X应为________。
(4)步骤Ⅳ还可以回收Na2SO4来制取Na2S。
①检验ZnS固体是否洗涤干净的方法是___________________________。
②Na2S可由等物质的量的Na2SO4和CH4在高温、催化剂条件下制取。化学方程式为________________________________;
(5)若步骤Ⅱ加入的ZnCO3为b mol,步骤Ⅲ所得Cd为d mol,最后得到V L、物质的量浓度为c mol·L-1的Na2SO4溶液。则理论上所用锌灰中含有锌元素的质量为________。
【解析】锌灰与硫酸反应得含有镉离子、锌离子、铁离子、亚铁离子等的溶液,加入双氧水将二价铁离子氧化为三价铁离子,用碳酸锌调节pH使Fe(OH)3完全沉淀,过滤后得到含有镉离子、锌离子的滤液Ⅰ和滤渣Fe(OH)3、ZnCO3;步骤Ⅲ中可得Cd单质,为避免引入新的杂质,
8
试剂X应为锌,过滤后得溶液Ⅱ为硫酸锌溶液,硫酸锌溶液中加入硫化钠可得硫酸钠和硫化锌。
(1)搅拌、适当升温、将废渣碾细成粉末、搅拌、多次浸取等都可提高锌灰的浸取率,不采用的方法是⑤加压,答案选①②③⑤;
(2)根据上面的分析可知,步骤Ⅱ所得滤渣为Fe(OH)3、ZnCO3;
(3)根据上面的分析可知,试剂X应为锌;
(4)①ZnS固体是从硫酸钠溶液中析出的,所以检验ZnS固体是否洗涤干净的方法是取最后一次洗涤液少许于试管,滴加几滴BaCl2溶液,若出现浑浊则未洗净,反之则已洗净;②等物质的量的Na2SO4和CH4在高温、催化剂条件下生成Na2S,根据元素守恒可知,该化学反应方程式为Na2SO4+CH4Na2S+2H2O+CO2;
(5)步骤Ⅲ所得Cd为d mol,则用于置换镉的锌的物质的量为d mol,硫酸钠的物质的量为V L×c mol·L-1=cV mol,所以硫酸锌的物质的量为cV mol,根据锌元素守恒可知,样品中锌元素的物质的量为cV mol-d mol-b mol,所以锌灰中含有锌元素的质量为65 g·mol-1×(cV mol-d mol-b mol)=65(cV-b-d)g。
答案:(1)①②③⑤ (2)Fe(OH)3、ZnCO3
(3)Zn(或锌) (4)①取最后的洗涤液少许于试管,滴加几滴BaCl2溶液,出现浑浊则未洗净,反之则洗净 ②Na2SO4+CH4Na2S+2H2O+CO2 (5)65(cV-b-d)g
3.二硫化钨(WS2,其中W的化合价为+4)可用作润滑剂,还可以在石油化工领域中用作催化剂。由钨铁矿(其主要成分是FeWO4,还含少量Al2O3)制备二硫化钨的工艺流程如图所示:
回答下列问题:
(1)FeWO4中铁元素的化合价为________。
(2)FeWO4在“熔融”过程中发生反应的化学方程式为______________________;“熔融”过程中为了提高熔融速率,可采取的措施有________________________________(写出一条即可)。
8
(3)过量CO2通入粗钨酸钠溶液中发生反应的离子方程式为________________,
操作Ⅰ中用作引流的玻璃仪器是_____________________________________。
(4)生成二硫化钨的化学方程式为2(NH4)2WS4+3O22WS2+4NH3+2S+2SO2+2H2O,若反应中转移8 mol电子,则生成WS2的质量是________g。
【解析】(1)FeWO4中O、W分别为-2和+6,根据化合物中各元素化合价的代数和为0可求出Fe的化合价为+2。(2)结合题给流程图可知钨铁矿在熔融时与NaOH、O2反应生成Fe2O3和钨酸钠,根据得失电子守恒、原子守恒可写出反应的化学方程式为4FeWO4+O2+8NaOH2Fe2O3+4Na2WO4+4H2O。“熔融”时为了提高熔融速率,可采取的措施有将钨铁矿粉碎或搅拌等。(3)粗钨酸钠溶液中含有少量的NaAlO2溶液,通入过量CO2时,NaAlO2与CO2、H2O反应生成Al(OH)3和NaHCO3。操作Ⅰ为过滤操作,实验中需要用作引流的玻璃仪器是玻璃棒。(4)结合题给流程图可知(NH4)2WS4中W和S分别为+6和-2,根据化合价变化可知,每生成2 mol WS2时转移16 mol电子,则反应中转移8 mol电子时,生成1 mol WS2,其质量为(184+32×2)g·mol-1×1 mol=248 g。
答案:(1)+2
(2)4FeWO4+O2+8NaOH2Fe2O3+4Na2WO4+4H2O 粉碎钨铁矿(或搅拌等)
(3)Al+CO2+2H2OAl(OH)3↓+HC 玻璃棒 (4)248
4.(2020·嘉兴模拟)钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
(1)写出反应①的化学方程式:_______________________________。
(2)反应①的尾气可以再利用,写出应用该尾气制得的两种重要化学试剂________。
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有________。
(4)钼在空气中灼烧生成三氧化钼,三氧化钼溶于氢氧化钠溶液生成钼酸钠;三氧化钼不溶于盐酸或稀硫酸。钼酸钠的化学式为________。
8
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH42CO+2H2, CH4+H2OCO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为________。
【解析】(1)二硫化钼与氧气在高温下反应生成三氧化钼和二氧化硫。
(2)二氧化硫可收集再利用,制备硫酸和盐类等。
(3)操作1和操作2都是分离固体与液体混合物,都是过滤操作。
(4)钼酸是二元酸,可直接写出钼酸钠。
(5)根据反应方程式知,1 mol甲烷完全反应生成4 mol还原性气体,而:3CO+MoO3Mo+3CO2,3H2+MoO3Mo+3H2O,3 mol还原性气体理论上生成1 mol钼。n(CH4)=×80%,n(H2+CO)=×80%×90%×4 mol= mol, n(Mo)= mol×= mol,m(Mo)= mol×96 g·mol-1≈4.11a g。
答案:(1)2MoS2+7O22MoO3+4SO2
(2)H2SO4、Na2SO3[或Na2SO4、(NH4)2SO4等]
(3)烧杯、漏斗、玻璃棒 (4)Na2MoO4
(5)4.11a g
5.锑在工业上应用价值广泛,它的一种提取工艺流程如下,请回答下列问题:
(1)辉锑矿是含锑的重要矿物,其主要成分是Sb2S3,其中Sb元素的化合价是________。
(2)写出阳极区产物与辉锑矿粉主要成分发生反应的化学方程式________。
8
(3)电解池所用的“隔膜”宜采用________ (填“阳离子”“阴离子”或“质子”) 交换膜。为促使Sb3+向阳极迁移加快反应,通常要进行的操作是_________。
“电解”中阴极反应的产物之一X是__________(填化学式)。
(4)为除去操作1所得滤液中的Cu2+,可加入Na2S。若滤液中c(Cu2+)=
0.01 mol·L-1,当溶液中Cu2+恰好完全沉淀[c(Cu2+)=1×10-5 mol·L-1]时,c(S2-)= ________mol·L-1。 [已知Ksp(CuS)=8×10-45]
(5)除去废液中的 AsCl3,是用次磷酸钠(NaH2PO2)还原AsCl3,产生了棕色单质砷沉淀和H3PO3。该反应中氧化剂和还原剂的物质的量之比为________,氧化产物是________。
(6)若电解池阴极得到1 mol X气体,同时电路中转移6 mol e-,则阴极生成的m(Sb)=________g(Sb的相对原子质量为121.8)。
【解析】(1)Sb2S3中S的化合价为-2,根据化合价代数和为0,计算出Sb的化合价是+3。
(2)阳极区产物SbCl5与Sb2S3发生氧化还原反应,得到SbCl3,锑元素的化合价降低,则硫元素的化合价一定升高,结合流程图分析,滤液中不含硫元素,则氧化产物为硫单质,所以化学方程式为Sb2S3+3SbCl55SbCl3+3S。
(3)阴极发生还原反应生成锑和氢气,Cl-过剩,阳极缺Cl-,故采用阴离子交换膜。为促使Sb3+向阳极迁移加快反应,通常要进行的操作是在电解过程中不断搅拌。“电解”中阴极发生还原反应,产物之一X是H2。
(4)根据Ksp(CuS)=c(Cu2+)·c(S2-)=8×10-45可知,当溶液中Cu2+恰好完全沉淀时,c(S2-)= mol·L-1=8×10-40 mol·L-1。
(5)AsCl3与NaH2PO2反应生成单质砷沉淀和H3PO3。根据原子守恒,反应物有水参加,化学方程式为2AsCl3+3NaH2PO2+3H2O2As↓ +3H3PO3+3NaCl+3HCl,反应中氧化剂为AsCl3,还原剂为NaH2PO2,二者物质的量之比为2∶3,氧化产物是H3PO3。
(6)电解池阴极得到1 mol H2时,转移2 mol e-,电路中共转移6 mol e-,则生成Sb时转移4 mol e-,由Sb3++3e-Sb知,阴极生成的m(Sb)= mol×
121.8 g·mol-1=162.4 g。
答案:(1)+3
(2)Sb2S3+3SbCl55SbCl3+3S
8
(3)阴离子 电解过程中需要不断搅拌(或其他合理答案) H2
(4)8×10-40 (5)2∶3 H3PO3 (6)162.4
8