- 157.50 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
玉山一中2018—2019学年度第一学期高一期中考试
化学试卷(14—35班)
考试时间:90分钟 总分:100分
可能用到的相对原子质量:H-1 O-16 Al-27 S-32 Fe-56 Cu-64 Cl:35.5
一、选择题(每小题只有一个正确答案。每题3分,共48分。)
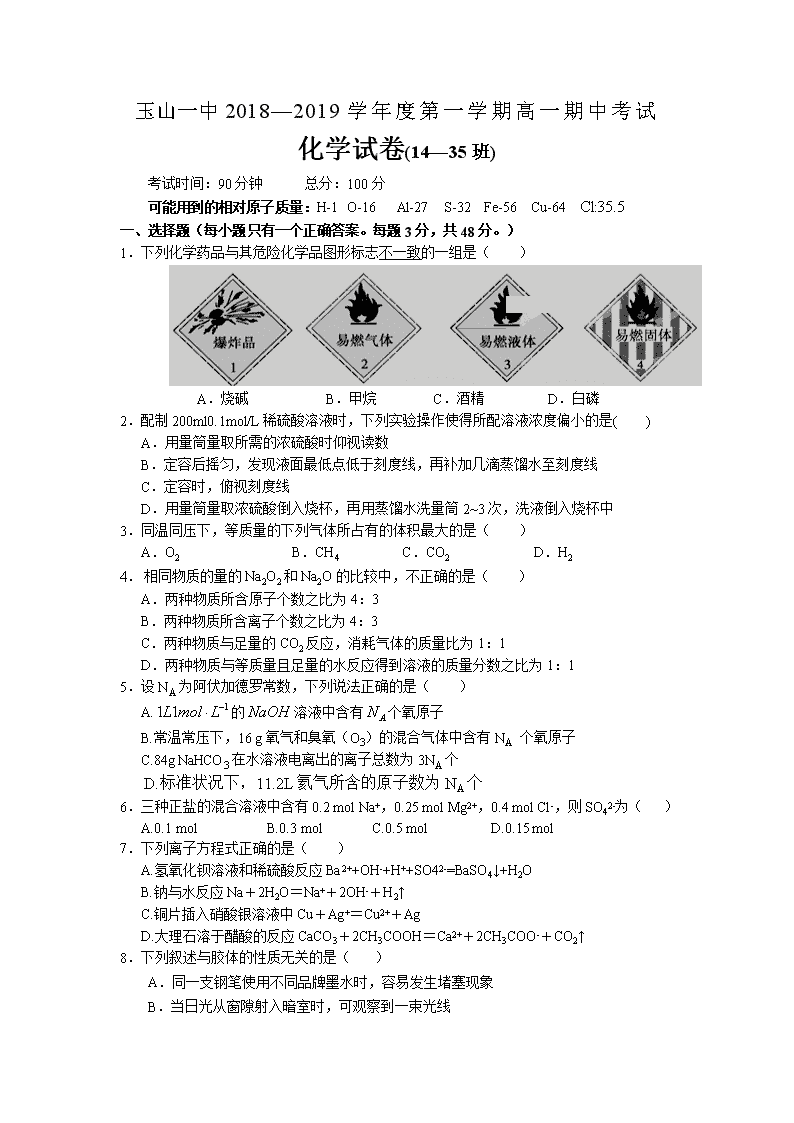
1.下列化学药品与其危险化学品图形标志不一致的一组是( )
A.烧碱 B.甲烷 C.酒精 D.白磷
2.配制200ml0.1mol/L稀硫酸溶液时,下列实验操作使得所配溶液浓度偏小的是( )
A.用量筒量取所需的浓硫酸时仰视读数
B.定容后摇匀,发现液面最低点低于刻度线,再补加几滴蒸馏水至刻度线
C.定容时,俯视刻度线
D.用量筒量取浓硫酸倒入烧杯,再用蒸馏水洗量筒2~3次,洗液倒入烧杯中
3.同温同压下,等质量的下列气体所占有的体积最大的是( )
A.O2 B.CH4 C.CO2 D.H2
4.相同物质的量的Na2O2和Na2O的比较中,不正确的是( )
A.两种物质所含原子个数之比为4:3
B.两种物质所含离子个数之比为4:3
C.两种物质与足量的CO2反应,消耗气体的质量比为1:1
D.两种物质与等质量且足量的水反应得到溶液的质量分数之比为1:1
5.设NA为阿伏加德罗常数,下列说法正确的是( )
A.的溶液中含有个氧原子
B.常温常压下,16 g氧气和臭氧(O3)的混合气体中含有NA 个氧原子
C.84g NaHCO3在水溶液电离出的离子总数为3NA个
D.标准状况下,11.2L氦气所含的原子数为NA个
6.三种正盐的混合溶液中含有0.2 mol Na+,0.25 mol Mg2+,0.4 mol Cl-,则SO42-为( )
A.0.1 mol B.0.3 mol C.0.5 mol D.0.15 mol
7.下列离子方程式正确的是( )
A.氢氧化钡溶液和稀硫酸反应Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.钠与水反应Na+2H2O=Na++2OH-+H2↑
C.铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag
D.大理石溶于醋酸的反应CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑
8.下列叙述与胶体的性质无关的是( )
A.同一支钢笔使用不同品牌墨水时,容易发生堵塞现象
B.当日光从窗隙射入暗室时,可观察到一束光线
C.向氢氧化铁与水形成的某分散系中插入正、负电极,通直流电一段时间后,一极附近颜色变深
D.向氯化铁溶液中加入氢氧化钠溶液,产生红褐色沉淀
9.下列类型的反应,一定发生电子转移的是( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
10.常温下,在溶液中可以发生反应:X+2Y3+===2Y2++X2+。对下列叙述的判断正确的是( )。
①X被氧化 ②X是氧化剂 ③X具有还原性 ④Y2+是氧化产物 ⑤Y2+具有还原性
⑥Y3+的氧化性比X2+的氧化性强
A.②④⑥ B.①③④ C.①③⑤⑥ D.②⑤
11.下列分散系中分散质粒子最大的是( )
A.蔗糖溶液 B.少量植物油和水的混合物 C.牛奶 D.硫酸溶液
12.若1gN2中含有x个原子,则阿伏加德罗常数是( )
A.mol-1 B.mol-1 C.14xmol-1 D.28xmol-1
13.在甲、乙两烧杯溶液中,共含有大量的Cu2+、Na+、H+、SO42﹣、CO32﹣、OH﹣等6种离子.已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是( )
A.Cu2+、H+、SO42﹣ B.Na+、OH﹣、CO32﹣
C.CO32﹣、OH﹣、SO42﹣ D.Na+、H+、SO42﹣
14.下列变化中,需要加入适当的还原剂才能完成的是( )
A.FeCl3→FeCl2 B.Cu→Cu2(OH)2CO3
C. SO3→H2SO4 D.HCl→Cl2
15.将少量金属钠放入下列盛有足量溶液的小烧杯中(忽略温度的变化),既有气体生成,又有白色沉淀产生的是( )
①MgSO4溶液 ②饱和NaCl溶液 ③Na2SO4溶液 ④Ca(HCO3)2溶液
⑤Al2(SO4)3溶液 ⑥CuSO4溶液.
A. ①②④⑤ B. ③④⑤⑥ C. ①②③④ D. ②④⑤⑥
16.为鉴别K2CO3和NaHCO3两种白色固体,有4位同学,分别设计了下列四种不同的方法,其中不可行的是( )
A.分别加入1 mol/L的盐酸溶液,看气泡产生的快慢
B.分别取样在试管中加热,将可能产生的气体通入澄清石灰水,观察有无白色浑浊
C.分别取样配成溶液,滴加Ba(OH)2溶液,观察有无白色沉淀
D.分别配成溶液,做焰色反应实验,观察火焰的颜色
二、填空题(共4小题,除特别注明每空2分)
17.(12分)I.下列两组物质中,均有一种物质的类别与其它三种不同:
A.MgO、Na2O、CO2、CuO B.NaOH、Na2CO3、KOH、Cu(OH)2
这两种物质依次是(填化学式):A_______________;B_______________
II.①NaCl(固态) ②HCl(液态) ③Cu ④酒精 ⑤液态醋酸⑥KNO3溶液
填空回答(填序号):以上物质中能导电的是 ;属于电解质的是 ;
属于非电解质的是 ;属于弱电解质的是 .
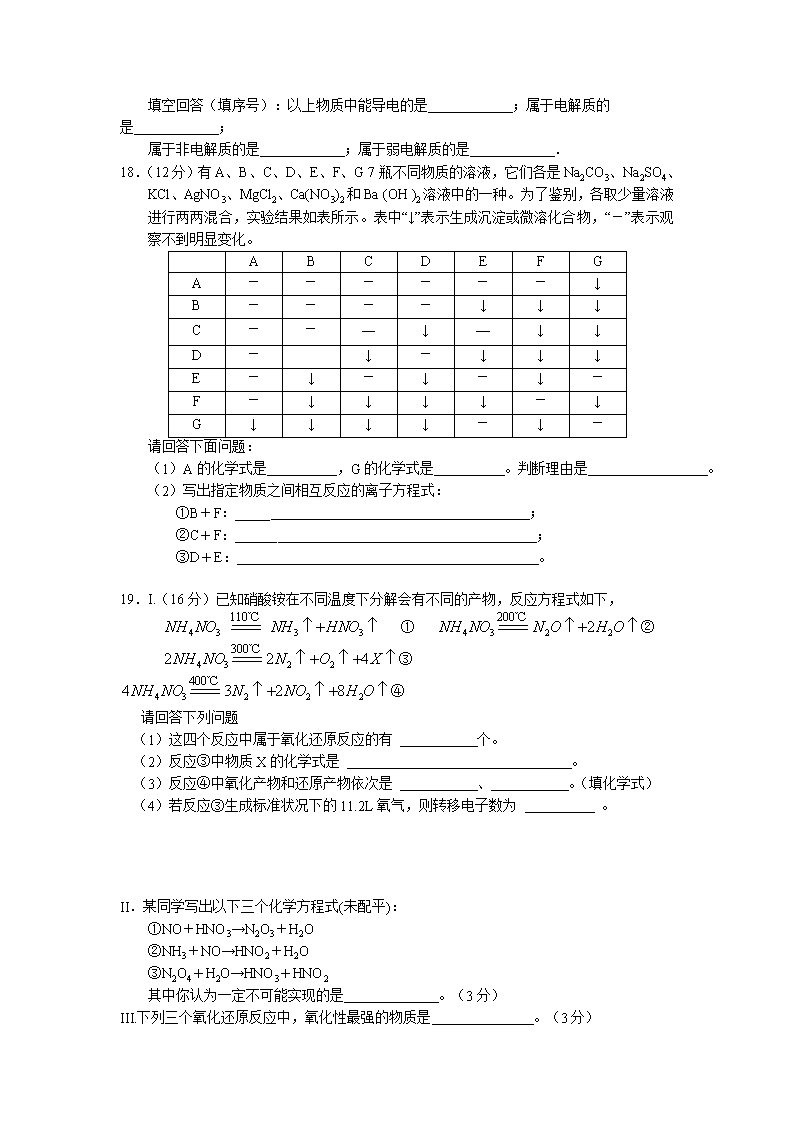
18.(12分)有A、B、C、D、E、F、G 7瓶不同物质的溶液,它们各是Na2CO3、Na2SO4、KCl、AgNO3、MgCl2、Ca(NO3)2和Ba (OH )2溶液中的一种。为了鉴别,各取少量溶液进行两两混合,实验结果如表所示。表中“↓”表示生成沉淀或微溶化合物,“-”表示观察不到明显变化。
A
B
C
D
E
F
G
A
-
-
-
-
-
-
↓
B
-
-
-
-
↓
↓
↓
C
-
-
―
↓
—
↓
↓
D
-
↓
-
↓
↓
↓
E
-
↓
-
↓
-
↓
-
F
-
↓
↓
↓
↓
-
↓
G
↓
↓
↓
↓
-
↓
-
请回答下面问题:
(1)A的化学式是 ,G的化学式是 。判断理由是 。
(2)写出指定物质之间相互反应的离子方程式:
①B+F:_____ ;
②C+F:______ ;
③D+E:_______ 。
19.I.(16分)已知硝酸铵在不同温度下分解会有不同的产物,反应方程式如下,
① ②
③ ④
请回答下列问题
(1)这四个反应中属于氧化还原反应的有 个。
(2)反应③中物质X的化学式是 。
(3)反应④中氧化产物和还原产物依次是 、 。(填化学式)
(4)若反应③生成标准状况下的11.2L氧气,则转移电子数为 。
II.某同学写出以下三个化学方程式(未配平):
①NO+HNO3→N2O3+H2O
②NH3+NO→HNO2+H2O
③N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是 。(3分)
III.下列三个氧化还原反应中,氧化性最强的物质是 。(3分)
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
20.(12分)已知物质A、B、C、D、E、F在一定条件下的关系如下图所示,该六种物质的焰色反应均
呈黄色。
(1)写出下列物质的化学式:A 、D 、F 。
(2)A、B、C、D四种物质分别长期暴露在空气中,其最终产物为 (化学式)。
(3)将C加入CuSO4溶液中,分步写出发生反应的化学方程式为
; 。
高一化学(14-35班)期中考试答案
答案:ABDBB DDDCC BCBAAC
17.答案:(12分,每空2分)
I.
II③⑥ ; ①②⑤ ; ④ ; ⑤ .
18.答案:(12分,每空2分)
(1) KCl、AgNO3 KCl溶液和AgNO3溶液混合才会产生AgCl沉淀,且只有一种沉淀
(2) Ba2++SO42-===BaSO4↓Mg 2++2OH―=== Mg(OH)2↓Ca2++CO32- === CaCO3↓
19. 答案:(16分)
I.(1)3 (2) (3) 和(4) 或者 3.01×
II.②(3分) III.KMnO4 (3分)
20. 答案:(12分,每空2分)
(1)Na NaOH NaHCO3(2)Na2CO3
(3)2Na2O2+2H2O====4NaOH+O2↑
(3)2NaOH +CuSO4====Cu(OH)2↓+Na2SO4