- 110.00 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第二课时
教学目标设定:
通过分析数据和信息,能说明晶格能的大小与离子晶体性质的关系。
教学重点、难点:
晶格能的定义和应用。
教学方法建议:
分析、归纳、应用
教学过程设计:
[复 习]:四种类型晶体的比较:
晶体类型
离子晶体
分子晶体
原子晶体
金属晶体
构成粒子
粒子间相互作用
硬度
熔沸点
导电性
溶解性
典型实例
[阅读与思考]:阅读下表,讨论、分析得出哪些结论?(小组讨论、交流、汇报)
表1:
F-
Cl-
Br-
I-
Li+
1036
853
807
757
Na+
923
786
747
704
K+
821
715
682
649
Cs+
785
689
660
630
Rb+
740
659
631
604
表2:
AB型离子晶体
离子电荷
晶格能(KJ/mol
熔点
摩氏硬度
NaF
1
923
993
3.2
NaCl
1
786
801
2.5
NaBr
1
747
747
<2.5
NaI
1
704
661
<2.5
MgO
2
3791
2852
6.5
CaO
2
3401
2614
4.5
SrO
2
3223
2430
3.5
BaO
2
3054
1918
3.3
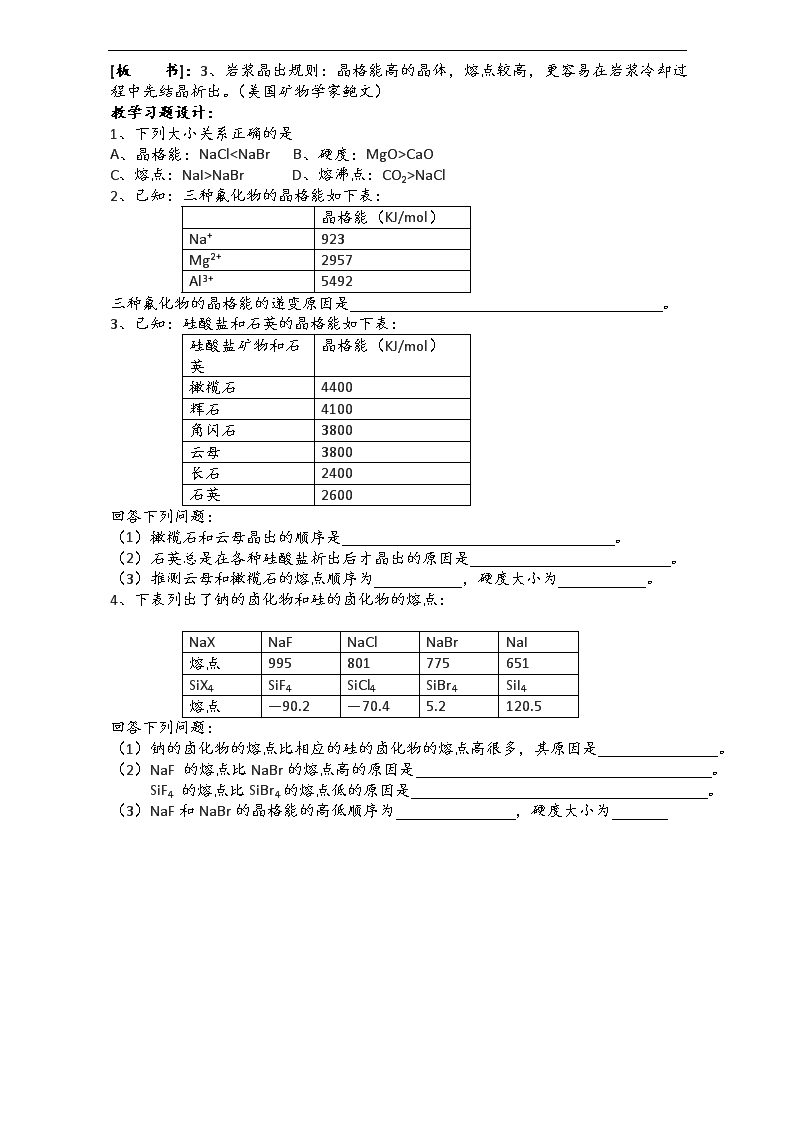
[板 书]:二、晶格能
1、定义:气态离子形成1mol离子晶体时释放的能量。
2、规律:
(1)离子电荷越大,离子半径越小的离子晶体的晶格能越大。
(2)晶格能越大,形成的离子晶体越稳定,熔点越高,硬度越大。
[科学视野]:阅读P84----科学视野,从中你知道了什么?
[板 书]:3、岩浆晶出规则:晶格能高的晶体,熔点较高,更容易在岩浆冷却过程中先结晶析出。(美国矿物学家鲍文)
教学习题设计:
1、下列大小关系正确的是
A、晶格能:NaClCaO
C、熔点:NaI>NaBr D、熔沸点:CO2>NaCl
2、已知:三种氟化物的晶格能如下表:
晶格能(KJ/mol)
Na+
923
Mg2+
2957
Al3+
5492
三种氟化物的晶格能的递变原因是 。
3、已知:硅酸盐和石英的晶格能如下表:
硅酸盐矿物和石英
晶格能(KJ/mol)
橄榄石
4400
辉石
4100
角闪石
3800
云母
3800
长石
2400
石英
2600
回答下列问题:
(1)橄榄石和云母晶出的顺序是 。
(2)石英总是在各种硅酸盐析出后才晶出的原因是 。
(3)推测云母和橄榄石的熔点顺序为 ,硬度大小为 。
4、下表列出了钠的卤化物和硅的卤化物的熔点:
NaX
NaF
NaCl
NaBr
NaI
熔点
995
801
775
651
SiX4
SiF4
SiCl4
SiBr4
SiI4
熔点
—90.2
—70.4
5.2
120.5
回答下列问题:
(1)钠的卤化物的熔点比相应的硅的卤化物的熔点高很多,其原因是 。
(2)NaF 的熔点比NaBr的熔点高的原因是 。
SiF4 的熔点比SiBr4的熔点低的原因是 。
(3)NaF和NaBr的晶格能的高低顺序为 ,硬度大小为
相关文档
- 人教版高中化学选修三教案1_2 原子2021-08-237页
- 人教版高中化学选修三教案2_2 分子2021-08-069页
- 人教版高中化学选修三教案2_3 分子2021-08-068页
- 人教版高中化学选修三教案3_3 金属2021-08-063页
- 人教版高中化学选修三教案3_2 分子2021-08-065页
- 人教版高中化学选修三教案3_3 金属2021-08-064页
- 人教版高中化学选修三教案1_2 原子2021-08-0612页
- 人教版高中化学选修三教案3_4 离子2021-07-083页
- 人教版高中化学选修三教案2_1 共价2021-07-066页
- 人教版高中化学选修三教案2_2 分子2021-07-0611页