- 232.50 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第一章测评(A)
(时间:90分钟 满分:100分)
一、选择题(本题包括14小题,每小题4分,共56分。每小题只有一个选项符合题意)
1.下列电子层中,包含有f能级的是( )
A.K电子层 B.L电子层
C.M电子层 D.N电子层
解析:K电子层是第一能层,只有1s能级;L电子层是第二能层,有两个能级,即2s和2p;M电子层是第三能层,有三个能级,即3s、3p、3d;N电子层是第四能层,有四个能级,即4s、4p、4d、4f。而根据能级数等于能层序数的关系规律,只有能层序数≥4的电子层中才有f能级。
答案:D
2.人们通常将在同一原子轨道上运动、自旋方向相反的2个电子,称为“电子对”,将在某一原子轨道上运动的单个电子,称为“未成对电子”。下列基态原子的电子排布式中,未成对电子数最多的是( )
A.1s22s22p63s23p6
B.1s22s22p63s23p63d54s2
C.1s22s22p63s23p63d54s1
D.1s22s22p63s23p63d104s1
解析:根据各基态原子的电子排布式可知,A项中未成对电子数为0;B项中未成对电子数为5;C项中未成对电子数为6;D项中未成对电子数为1。
答案:C
3.下列原子或离子原子核外电子排布不属于基态排布的是( )
A.N:1s22s22p3
B.S2-:1s22s22p63s23p6
C.Na:1s22s22p53s2
D.Si:1s22s22p63s23p2
解析:Na的基态电子排布式为1s22s22p63s1。
答案:C
4.某微粒的核外电子排布式为1s22s22p6,下列关于该微粒的说法一定正确的是( )
A.质子数为10 B.单质具有还原性
C.是单原子分子 D.电子数为10
解析:1s22s22p6为10电子微粒,可能为Ne、Na+、F-等,A、B、C项错误,D项正确。
答案:D
5.下列表达方式正确的是( )
A.Na+的电子排布图:
B.硫离子的核外电子排布式:1s22s22p63s23p4
C.碘化铵的电子式:[HH]+I-
D.H2O电子式:H∶∶H
解析:Na+的2p能级中每个轨道上的两个电子,自旋状态不能相同,A项错误;S2-的电子排布式3p能级应排6个电子,即1s22s22p63s23p6,B项错误;碘化铵的电子式中I-的电子式书写错误,C项错误。
答案:D
6.前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有( )
A.3种 B.4种
C.5种 D.6种
解析:第1周期有H:;第2周期有C:,O:,第3周期有P:,第4周期有Fe:,共5种。
答案:C
7.下列各组指定的元素,不能形成AB2型化合物的是( )
A.2s22p2和2s22p4
B.2s22p2和3s23p4
C.3s2和3s23p5
D.3s1和3s23p5
解析:A项为C和O,能形成CO2;B项为C和S,能形成CS2;C项为Mg和Cl,能形成MgCl2;D项为Na和Cl,能形成NaCl。
答案:D
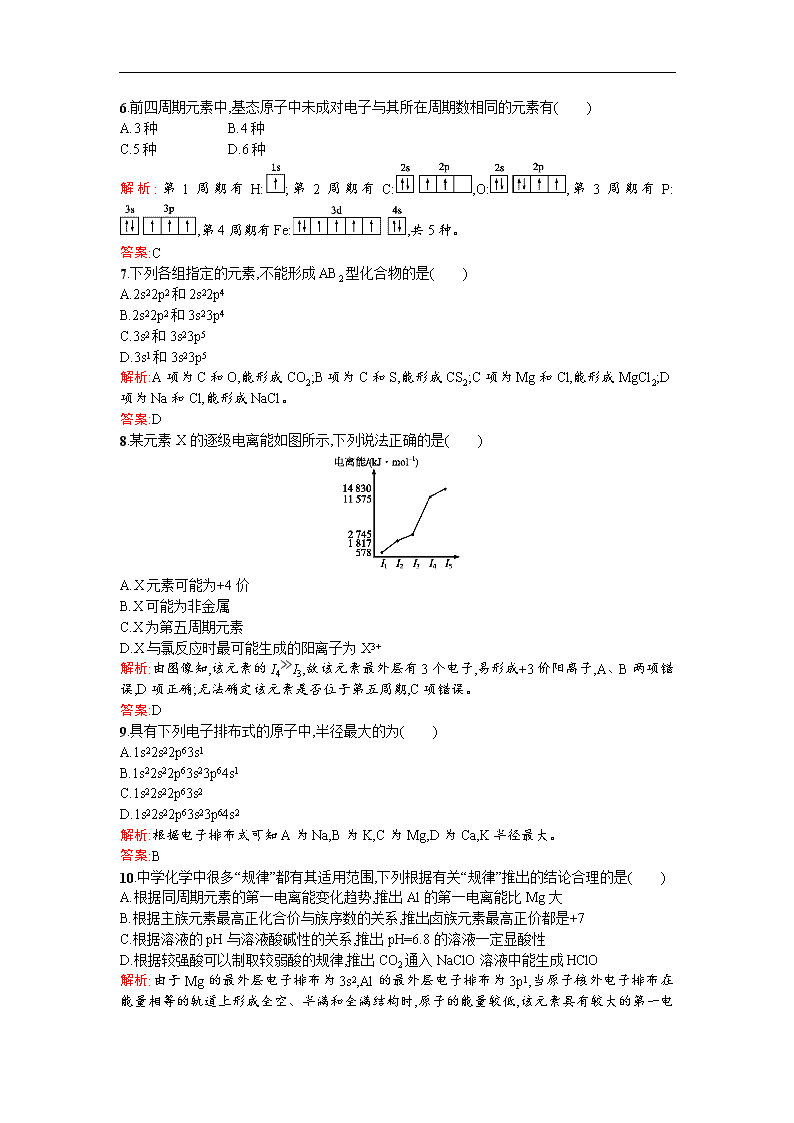
8.某元素X的逐级电离能如图所示,下列说法正确的是( )
A.X元素可能为+4价
B.X可能为非金属
C.X为第五周期元素
D.X与氯反应时最可能生成的阳离子为X3+
解析:由图像知,该元素的I4≫I3,故该元素最外层有3个电子,易形成+3价阳离子,A、B两项错误,D项正确;无法确定该元素是否位于第五周期,C项错误。
答案:D
9.具有下列电子排布式的原子中,半径最大的为( )
A.1s22s22p63s1
B.1s22s22p63s23p64s1
C.1s22s22p63s2
D.1s22s22p63s23p64s2
解析:根据电子排布式可知A为Na,B为K,C为Mg,D为Ca,K半径最大。
答案:B
10.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是( )
A.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
B.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7
C.根据溶液的pH与溶液酸碱性的关系,推出pH=6.8的溶液一定显酸性
D.根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO
解析:由于Mg的最外层电子排布为3s2,Al的最外层电子排布为3p1,当原子核外电子排布在能量相等的轨道上形成全空、半满和全满结构时,原子的能量较低,
该元素具有较大的第一电离能,A错;B中F元素不显正价,更没有+7价;C中溶液的pH与温度有关,若溶液温度为25 ℃时,pH=6.8的溶液显酸性,若温度为100 ℃时,则显碱性,故C不正确;H2CO3的酸性比HClO强,故D正确。
答案:D
11.下列对元素周期律和元素周期表的认识正确的是( )
A.元素周期律的本质是随着核电荷数的增加元素化合价呈周期性的变化
B.核外电子排布的周期性变化是元素性质周期性变化的本质
C.元素周期表中可以把元素分成s、p、d、ds四个区
D.元素周期表中最外层电子数<2的元素一定是金属元素
解析:元素周期律是原子核外电子排布的周期性变化所决定的,A项错误、B项正确;元素周期表可分为s、p、d、ds和f五个区,C项错误;氢元素原子核外只有一个电子,为非金属元素,D项错误。
答案:B
12.当镁原子由1s22s22p63s2→1s22s22p63p2时,以下认识正确的是( )
A.此过程中,镁原子由基态转化成激发态,这一过程中吸收能量
B.此过程中,镁原子由激发态转化成基态,这一过程中释放能量
C.转化后位于p能级上的两个电子处于同一轨道,且自旋状态相同
D.转化后镁原子与硅原子电子层结构相同,化学性质相似
解析:1s22s22p63s2为Mg的基态,1s22s22p63p2为Mg的激发态,A项正确,B项错误;转化后位于p能级上的两个电子处于两个轨道,C项错误;转化后的镁原子(核外有12个电子)与硅原子(核外有14个电子)电子层结构不同,D项错误。
答案:A
13.具有下列电子层结构的原子,其对应元素属于同一周期的是( )
A.两种原子的电子层上全部都是s电子
B.3p上只有一个空轨道的原子和3p能级上只有一个未成对电子的原子
C.最外层电子排布式为2s22p6的原子和最外层电子排布式为2s22p6的离子
D.原子核外的M层上的s能级和p能级都填满了电子,而d能级上尚未有电子的两种原子
解析:电子层上全部是s电子的原子有1s1、1s2、1s22s1、1s22s2,显然不一定属于同一周期;3p能级上只有一个空轨道的原子为1s22s22p63s23p2,是Si元素,3p能级上只有一个未成对电子的原子为1s22s22p63s23p1或1s22s22p63s23p5,分别是Al或Cl,在同一周期;最外层电子排布式为2s22p6的原子为Ne,最外层电子排布式为2s22p6的离子为F-、Na+、Mg2+等,不一定是同一周期;M层上的s能级和p能级都填满了电子,而d能级上尚未有电子的原子有1s22s22p63s23p6、1s22s22p63s23p64s1、1s22s22p63s23p64s2,显然不一定是同一周期。
答案:B
14.下列各组中的性质比较,正确的是( )
①酸性:HClO4>HBrO4>HIO4 ②碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2 ③稳定性:HCl>H2S>PH3 ④还原性:F->Cl->Br-
A.①②④ B.③④
C.①②③ D.①②③④
解析:①同主族自上而下,非金属性减弱,所以非金属性Cl>Br>I,非金属性越强,最高价氧化物对应水化物的酸性越强,故酸性HClO4>HBrO4>HIO4,正确;②同主族自上而下,金属性增强,所以金属性Ba>Ca>Mg,金属性越强,最高价氧化物对应水化物的碱性越强,所以碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2,正确;③同周期随原子序数增大,非金属性增强,所以非金属性:Cl>S>P,非金属性越强,氢化物的稳定性越强,所以稳定性:HCl>H2S>PH3,正确;④
同主族自上而下,非金属性减弱,所以非金属性:F>Cl>Br,非金属性越强,阴离子还原性越弱,所以离子还原性:F-”或“<”填空:
第一电离能
离子半径
酸性
Si S
O2- Na+
H2SO4 HClO4
(3)合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(Ⅰ)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3[Cu(NH3)3CO]Ac。
铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为 。其中氮元素原子最外层电子排布的轨道表示式是 。通过比较 可判断氮、磷两种元素的非金属性强弱。
解析:(1)Al的核外电子云有s电子云、p电子云两种,s电子云在空间只有1种伸展方向,p电子云在空间有3种不同的伸展方向。
(2)同一周期从左到右元素原子的第一电离能呈增大趋势(但第ⅡA族的大于第ⅢA族的,第ⅤA族的大于第ⅥA族的),所以SiH2SO4。
(3)铜液的组成元素中属于短周期元素的有C、H、O、N,根据原子半径变化规律可知,原子半径C>N>O>H;氮元素原子最外层有5个电子,根据核外电子排布的规律可知最外层排布的轨道式是;比较元素的非金属性强弱,我们可以通过比较元素气态氢化物低温稳定性或者元素最高价氧化物的水化物的酸性进行判断。
答案:(1)4 13
(2)< > <
(3)C>N>O>H NH3和PH3的稳定性
16.(10分)下表中的实线表示元素周期表的部分边界。①~⑤分别表示元素周期表中对应位置的元素。
(1)请在上表中用实线补全元素周期表边界。
(2)元素⑤的原子核外p电子比s电子多 个。元素③的氢化物的电子式为 。
(3)元素④一般在化合物中显 价,但与
(填图中标号)形成化合物时,所显示的价态则恰好相反。
(4)在元素①的单质A、元素②的单质B和元素①②形成的合金C中,熔点最低的是 (填名称)。
解析:由元素周期表可推出①~⑤分别为Na、K、N、O、F。(1)主要是将短周期的边界描出来。(2)元素⑤为F,电子排布式为1s22s22p5,p电子比s电子多1个。元素③的氢化物为NH3,电子式为H。(3)元素④为O,一般在化合物中显负价,但与F形成化合物时,可以显正价,如OF2。(4)钠、钾及钠钾合金中熔点最低的是钠钾合金。
答案:(1)
(2)1 H
(3)负 ⑤
(4)钠钾合金
17.(12分)现有A、B、C、D四种元素,A是第五周期第ⅣA族元素,B是第三周期元素,B、C、D的价电子数分别为2、2、7。四种元素原子序数从小到大的顺序是B、C、D、A。已知C和D的次外层电子数均为18个。
(1)写出A、B、C、D的元素符号:A 、B、C 、D 。
(2)C位于元素周期表的 区,C2+的电子排布式 。
(3)最高价氧化物对应水化物中碱性最强的化合物是 (写化学式,下同);最高价氧化物对应水化物中酸性最强的化合物是 。
(4)元素的第一电离能最小的是 ,元素的电负性最大的是 。
解析:(1)A是第五周期第ⅣA族元素,则A元素为Sn。由于B是第三周期元素,且其价电子数为2,所以B元素为Mg。由于C、D的原子序数均大于B,C、D的价电子为2、7,且C、D的次外层电子数均为18个,因此,C应该为第ⅡB族元素Zn,又因为原子序数ZnZn>Sn,故最高价氧化物对应水化物碱性最强的是Mg(OH)2。Br是非金属,其最高价氧化物对应水化物呈酸性,其化学式为HBrO4。
(4)元素的第一电离能越小,表示其失去一个电子的能力越强,其金属性越强,故镁元素的第一电离能最小。电负性越大,表示其吸引电子的能力越强,其非金属性越强,故电负性最大的为溴元素。
答案:(1)Sn Mg Zn Br
(2)ds 1s22s22p63s23p63d10
(3)Mg(OH)2 HBrO4
(4)Mg Br
18.(12分)有A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同族,它们原子的最外层电子排布式为ns1。B和D也属同族,它们原子最外层的p能级电子数是s能级电子数的两倍。C原子的最外层电子数等于D原子的最外层电子数的一半。请回答下列问题:
(1)A是 ,B是 ,E是 。
(2)写出C元素基态原子的电子排布式: 。
(3)用电子排布图表示D元素原子的价电子构型: 。
(4)元素B与D的电负性的大小关系是B D,C与E的第一电离能大小关系是C E。(填“>”“<”或“=”)
解析:A和E同族,最外层电子排布式为ns1,且C、E是金属,则A为H,E为Na或K;B、D同族,原子最外层的p能级电子数是s能级电子数的2倍,则B为O,D为S,进一步推出E为K。C的原子最外层上电子数是D的原子最外层电子数的一半,则C为Al。(1)A、B、E分别是H、O、K;(2)Al的基态原子电子排布式为1s22s22p63s23p1;(3)硫原子的价电子构型的电子排布图为;(4)O与S的电负性大小关系是O>S;Al与K的第一电离能的关系是Al>K。
答案:(1)H O K
(2)1s22s22p63s23p1
(3)
(4)> >