- 799.50 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
盖斯定律的应用
高考主要以生产生活、科学技术和能源问题为背景,将热化学方程式的书写和盖斯定律的计算融合考查。盖斯定律应用于反应热计算的流程如图所示:
【典例】(1) (2019·全国卷Ⅲ·T28·节选)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)CuCl(s)+Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+O2(g)CuO(s)+Cl2(g)
ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)CuCl2(s)+H2O(g)
ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)2Cl2(g)+2H2O(g)的ΔH=________ kJ·mol-1。
(2)(2018·北京高考·T27·节选)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
反应Ⅰ:2H2SO4(l)2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)SO2(g)
- 5 -
ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:_________________。
【思维建模】解答本类试题的流程如下:
【解析】(1)利用盖斯定律解答本题。
CuCl2(s)CuCl(s)+Cl2(g) ΔH1=83 kJ·mol-1①
CuCl(s)+O2(g)CuO(s)+Cl2(g)
ΔH2=-20 kJ·mol-1②
CuO(s)+2HCl(g)CuCl2(s)+H2O(g)
ΔH3=-121 kJ·mol-1③
则4HCl(g)+O2(g)2Cl2(g)+2H2O(g)可由①×2+②×2+③×2得到,所以其
ΔH=83×2+(-20)×2+(-121)×2=-116 (kJ·mol-1)。
(2)根据盖斯定律,反应Ⅰ和反应Ⅲ相加后的逆反应为反应Ⅱ的热化学方程式:3SO2(g)+2H2O(g)2H2SO4(l)+S(s) ΔH2=-254 kJ·mol-1。
答案:(1)-116
(2)3SO2(g)+2H2O(g)2H2SO4(l)+S(s) ΔH2=-254 kJ·mol-1
1.已知:H2O(g)H2O(l) ΔH1
C6H12O6 (g)C6H12O6(s) ΔH2
C6H12O6(s)+6O2 (g)6H2O(g)+6CO2 (g) ΔH3
C6H12O6(g)+6O2 (g)6H2O(l)+6CO2 (g) ΔH4
下列说法正确的是 ( )
A.ΔH1< 0,ΔH2< 0,ΔH3<ΔH4
B.6ΔH1+ΔH2+ΔH3-ΔH4=0
- 5 -
C.-6ΔH1+ ΔH2 +ΔH3-ΔH4=0
D.-6ΔH1+ΔH2-ΔH3 +ΔH4=0
【解析】选B。由题意得ΔH1<0,ΔH2<0。上述最后2个热化学方程式作差,可得C6H12O6 (s)+6H2O(l)6H2O(g)+C6H12O6 (g) ΔH3-ΔH4=-(6ΔH1+ΔH2)>0,得ΔH3>ΔH4 , A错误;根据盖斯定律,①×6+②+③=④,B正确,C、D错误。
2.已知:
①1 mol晶体硅中含有2 mol Si—Si键。
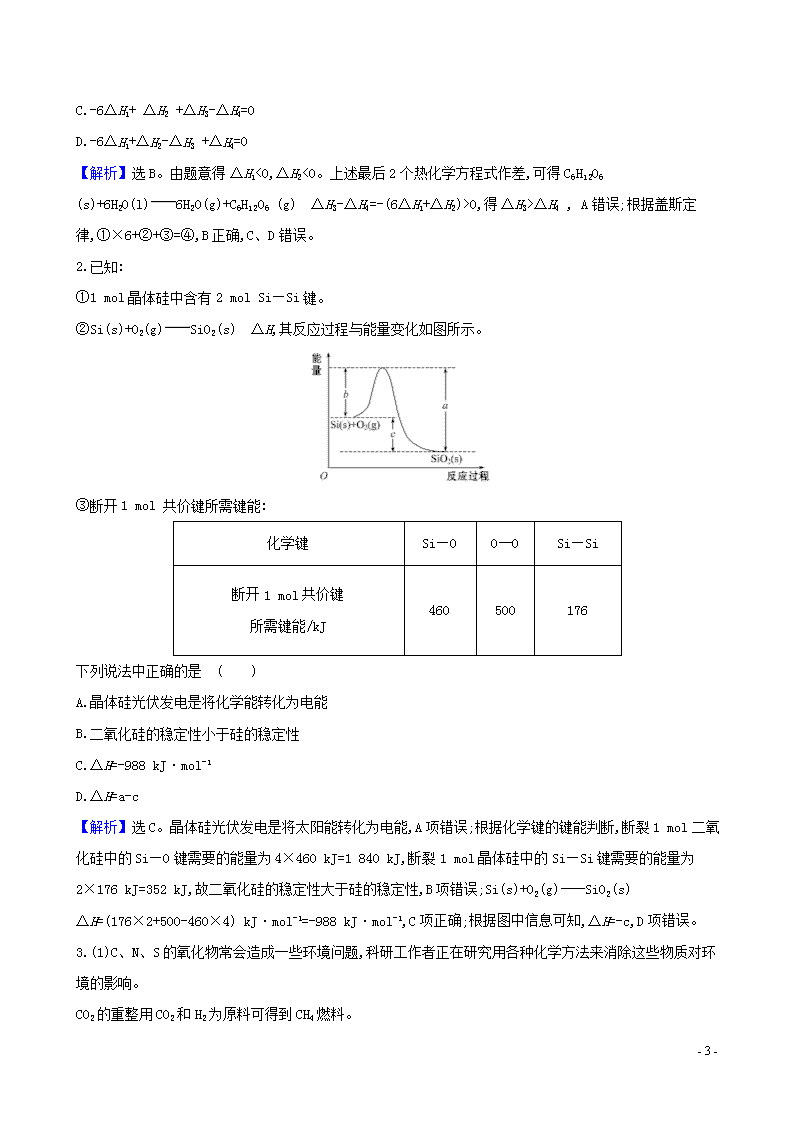
②Si(s)+O2(g)SiO2(s) ΔH,其反应过程与能量变化如图所示。
③断开1 mol 共价键所需键能:
化学键
Si—O
OO
Si—Si
断开1 mol共价键
所需键能/kJ
460
500
176
下列说法中正确的是 ( )
A.晶体硅光伏发电是将化学能转化为电能
B.二氧化硅的稳定性小于硅的稳定性
C.ΔH=-988 kJ·mol-1
D.ΔH=a-c
【解析】选C。晶体硅光伏发电是将太阳能转化为电能,A项错误;根据化学键的键能判断,断裂1 mol二氧化硅中的Si—O键需要的能量为4×460 kJ=1 840 kJ,断裂1 mol晶体硅中的Si—Si键需要的能量为2×176 kJ=352 kJ,故二氧化硅的稳定性大于硅的稳定性,B项错误;Si(s)+O2(g)SiO2(s) ΔH=(176×2+500-460×4) kJ·mol-1=-988 kJ·mol-1,C项正确;根据图中信息可知,ΔH=-c,D项错误。
3.(1)C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
CO2的重整用CO2和H2为原料可得到CH4燃料。
- 5 -
已知:①CH4 (g)+CO2(g)2CO(g)+2H2(g)
ΔH1=+247 kJ·mol-1
②CH4 (g)+H2O(g)CO(g)+3H2(g)
ΔH2=+205 kJ·mol-1
则CO2重整的热化学方程式为____________________。
(2)已知部分物质燃烧的热化学方程式如下:
2H2(g)+O2(g)2H2O(g) ΔH=-484 kJ·mol-1
2CO(g)+O2(g)2CO2(g) ΔH=-566 kJ·mol-1
CH4(g)+2O2(g)CO2(g)+2H2O(g)
ΔH=-802 kJ·mol-1
“二次转化”时CH4和O2反应生成CO和H2的热化学方程式为________________________。
(3)NH3是造成水体富营养化的重要因素之一,用次氯酸钠水解生成的次氯酸将水中的NH3转化为氮气除去,其相关反应的热化学方程式如下:
反应Ⅰ: NH3 (aq)+HClO(aq)NH2Cl(aq)+H2O(l)
ΔH1=a kJ·mol-1;
反应Ⅱ :NH2Cl(aq)+HClO(aq)NHCl2(aq) +H2O(l) ΔH2=b kJ·mol-1;
反应Ⅲ:2NHCl2(aq) +H2O(l)N2(g)+HClO( aq)+3HCl( aq) ΔH3=c kJ·mol-1。
则2NH3(aq)+3HClO(aq)N2 (g)+3HCl(aq)+3H2O(l) ΔH=____________kJ·mol-1
(4)已知:
①2CO(g)+SO2(g)S(l)+2CO2(g)
ΔH1=-37.0 kJ·mol-1
②2H2(g)+SO2(g)S(l)+2H2O(g)
ΔH2=+45.0 kJ·mol-1
③2CO(g)+O2(g)2CO2(g)
ΔH3=-566.0 kJ·mol-1
④2H2(g)+O2(g)2H2O(g)
ΔH4=-484.0kJ·mol-1
写出液态硫(S)燃烧的热化学方程式_____________________。
- 5 -
【解析】(1)由已知:①CH4 (g)+CO2(g)2CO(g)+2H2(g) ΔH1=+247 kJ·mol-1,②CH4(g)+H2O(g)CO(g)+3H2(g) ΔH2=+205 kJ·mol-1,根据盖斯定律,①-②×2得CO2重整的热化学方程式为CO2(g)+4H2(g)CH4(g)+2H2O(g) ΔH=ΔH1-2ΔH2=-163 kJ·mol-1。
(2)2H2(g)+O2(g)2H2O(g)
ΔH=-484 kJ·mol-1 ①
2CO(g)+O2(g)2CO2(g) ΔH=-566 kJ·mol-1 ②
CH4(g)+2O2(g)CO2(g)+2H2O(g)
ΔH=-802 kJ·mol-1 ③
将2×③-2×①-②得,2CH4 (g)+O2(g)2CO(g)+4H2(g) ΔH=-70 kJ·mol-1。
(3)反应Ⅰ×2+反应Ⅱ×2+反应Ⅲ,得出目标方程式的ΔH=(2a+2b+c)kJ·mol-1。
(4)②2H2(g)+SO2(g)S(1)+2H2O(g)
ΔH2=+45.0 kJ·mol-1
④2H2(g)+O2(g)2H2O(g)
ΔH4=-484.0 kJ·mol-1
根据盖斯定律,④-②得液态硫(S)燃烧的热化学方程式:S(l)+O2(g)SO2(g) ΔH=-529.0 kJ·mol-1。
答案:(1)CO2(g)+4H2(g)CH4(g)+2H2O(g)
ΔH=-163 kJ·mol-1
(2)2CH4 (g)+O2(g)2CO(g)+4H2(g)
ΔH=-70 kJ·mol-1
(3)2a+2b+c
(4)S(l)+O2(g)SO2(g) ΔH=-529.0 kJ·mol-1
- 5 -