- 1.17 MB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第1课时 认识同周期元素性质的递变规律
[学习目标] 1.知道同周期元素性质的递变规律,并能用实验等间接的方法验证规律的正确性。2.能用原子结构理论解释同周期元素性质的递变规律。
一、元素原子失电子能力强弱的判断
[自主学习]
1.元素周期表中第三周期包括的元素有
钠(Na)、镁(Mg)、铝(Al)、硅(Si)、磷(P)、硫(S)、氯(Cl)、氩(Ar)。
核外电子排布规律为:电子层数相同,最外层电子数逐渐增加。
2.元素原子失电子能力强弱的判断方法
(1)比较元素的单质与水(或酸)反应置换出氢的难易程度。置换反应越容易发生,元素原子的失电子能力越强。
(2)比较元素最高价氧化物对应的水化物的碱性强弱。一般说来,碱性越强,元素原子失电子的能力越强。
你能由钠、镁、铝三种元素原子的核外电子排布规律推测出三者失电子能力的强弱吗?
提示:从钠到铝,元素原子的半径逐渐减小,原子核对外层电子的吸引力逐渐增强,失电子能力逐渐减弱。
[点拨提升]
1.元素原子失电子能力强弱的实验探究
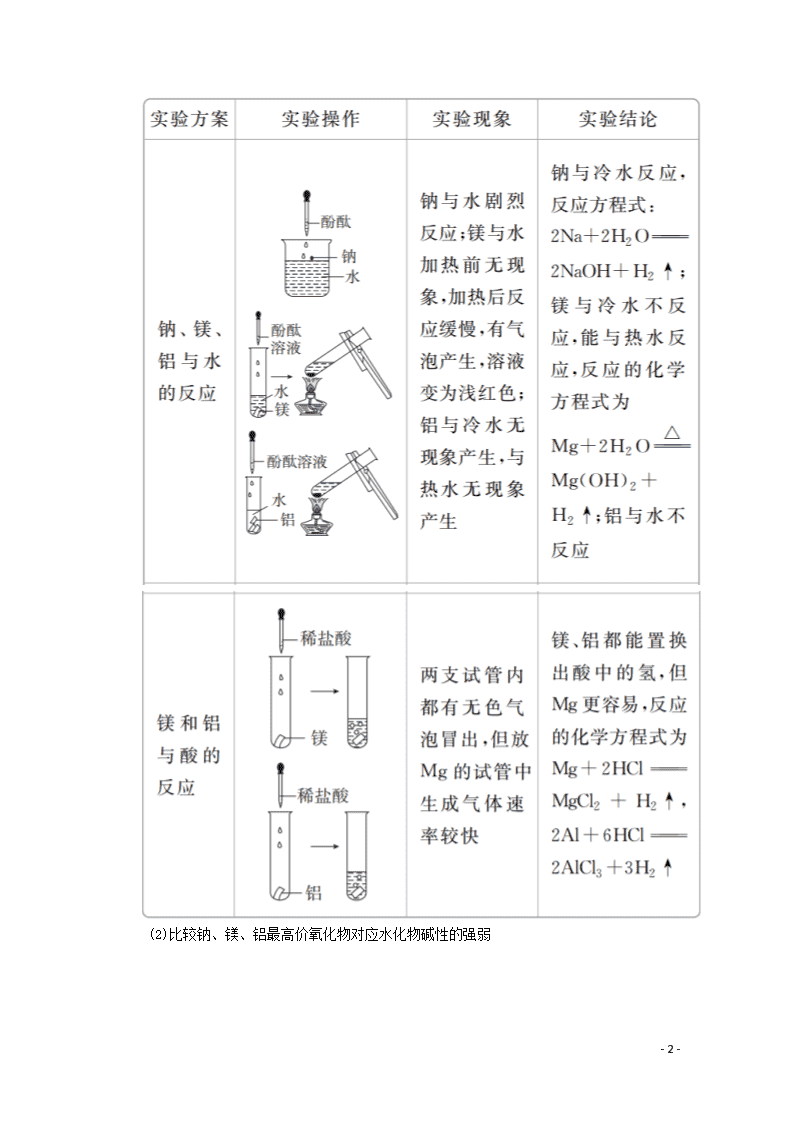
(1)钠、镁、铝与水(或酸)反应
- 9 -
(2)比较钠、镁、铝最高价氧化物对应水化物碱性的强弱
- 9 -
(3)由上述实验可知:
①钠、镁、铝置换出水(或酸)中的氢时,由易到难的顺序是Na>Mg>Al。
②钠、镁、铝的最高价氧化物对应的水化物的碱性由强到弱的顺序为NaOH>Mg(OH)2>Al(OH)3。
③钠、镁、铝原子失电子能力由强到弱的顺序为Na>Mg>Al。
2.同周期元素原子失电子能力的变化规律
在同一周期中,各元素原子的核外电子层数相同,但从左到右核电荷数依次增大,原子半径逐渐减小(稀有气体元素除外),原子核对外层电子的吸引力逐渐增强,原子失电子能力逐渐减弱,金属性逐渐减弱。
3.元素金属性强弱的比较方法
- 9 -
[练习与活动]
1.能说明钠比铝活泼的是( )
A.最外层电子数钠原子比铝原子少
B.相等物质的量的钠和铝分别和盐酸反应,钠产生的气体少
C.钠与铝的电子层数相等
D.常温下钠能与水剧烈反应,而铝不能
答案 D
解析 能说明失电子能力Na>Al,取决于其失电子难易程度,不决定于其失电子多少。
2.有三种金属元素A、B、C,在相同条件下,B的最高价氧化物的水化物碱性比A的最高价氧化物的水化物碱性强;A可以从C的盐溶液中置换出C。则这三种元素的金属性由强到弱的顺序正确的是( )
A.A>B>C B.B>A>C
C.B>C>A D.C>B>A
答案 B
解析 根据元素金属性强弱的比较方法及题意可知,由于B的最高价氧化物的水化物碱性比A的强,所以元素B的金属性比A的强;由于A可以从C的盐溶液中置换出C,所以A的金属性比C的强,故选B。
规律方法
决定元素金属性强弱的是元素原子失电子的难易程度,而不是失电子的多少。如镁原子比钠原子失电子数多,但钠原子比镁原子失电子容易,故钠的金属性比镁强。
- 9 -
二、元素原子得电子能力强弱的判断
[自主学习]
1.元素原子得电子能力强弱的判断方法
(1)比较元素的单质与氢气化合的难易程度以及气态氢化物的稳定性。一般说来,反应越容易进行,生成的气态氢化物越稳定,元素原子得电子的能力越强。
(2)比较元素最高价氧化物对应水化物的酸性。一般说来,酸性越强,元素原子得电子的能力越强。
2.硅、磷、硫、氯四种元素原子得电子能力的比较
- 9 -
1.非金属元素单质与H2反应的条件越难,生成相应的氢化物越稳定?
提示:不对。非金属元素单质与H2反应的条件越易,生成相应的氢化物才越稳定。
2.由H2SO4的酸性大于HClO的酸性,可推断S的非金属性大于Cl的非金属性?
提示:不对。因为HClO不是Cl元素最高价氧化物对应的水化物,无法判断两者的非金属性强弱。
[点拨提升]
1.同周期元素原子得电子能力的递变规律
在同一周期中,各元素原子的核外电子层数相同,但从左至右核电荷数依次增大,原子半径逐渐减小(稀有气体元素除外),原子核对外层电子的吸引力逐渐增大,原子得电子能力逐渐增强,非金属性逐渐增强。
2.元素非金属性强弱的比较方法
- 9 -
[练习与活动]
3.按C、N、O、F的顺序,下列递变规律正确的是( )
A.原子半径逐渐增大
B.元素原子得电子能力逐渐增强
C.最高正化合价逐渐增大
D.气态氢化物稳定性逐渐减弱
答案 B
- 9 -
解析 C、N、O、F元素处于第2周期,在同一周期中,随着元素原子序数递增,各元素原子的原子半径逐渐减小、最高正化合价逐渐增大(O、F除外)、气态氢化物稳定性逐渐增强、原子失电子能力逐渐减弱、得电子能力逐渐增强,故A、D不正确。但由于氧、氟无正价,故C不正确。
4.下列事实能说明X元素比Y元素的非金属性强的是( )
①与H2化合时X单质比Y单质容易;②X单质可以把Y从其氢化物中置换出来;③X的最高价氧化物对应水化物的酸性比Y的最高价氧化物对应水化物的酸性强;④与金属反应时,X原子得电子数目比Y的多;⑤X的单质熔、沸点比Y的低;⑥X原子的最外层电子数比Y原子的最外层电子数多
A.①②④ B.①②⑥
C.①②③ D.①②③④⑤⑥
答案 C
解析 ①②③是判断元素非金属性相对强弱常用的三种方法;④用得电子数目的多少不能判断非金属性强弱,应比较得电子的难易程度;⑤不能用单质的熔、沸点作依据判断非金属元素得电子的难易;⑥最外层电子数Cl>O,但非金属性O>Cl。
规律方法
(1)非最高价氧化物对应水化物的酸性强弱无法比较元素非金属性的强弱。如不能用酸性HClOCl。
(3)无氧酸的酸性强弱与元素非金属性强弱无必然联系。如不能用酸性HCl>H2S说明非金属性Cl>S。
本课归纳总结
同周期主族元素(稀有气体元素除外)原子结构与性质的递变规律
- 9 -
- 9 -
相关文档
- 2020高中化学第一章原子结构与元素2021-08-235页
- 2020版高中化学 第1章 原子结构与2021-08-236页
- 2020版高中化学 第1章 原子结构与2021-08-2319页
- 2020高中化学第一章原子结构与元素2021-08-066页
- 2020版高中化学 第1章 原子结构与2021-08-064页
- 2020高中化学第一章原子结构与元素2021-08-065页
- 2020高中化学第一章原子结构与元素2021-07-089页
- 2020高中化学第一章原子结构与元素2021-07-065页
- 原子结构与元素周期律第三节元素周2021-07-066页
- 2020版高中化学 第1章 原子结构与2021-07-056页