- 1.66 MB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题六
化学能与热能
第二单元
高频考点探究
命题考向追踪
教师备用习题
·
·
·
PART 1
考纲展示
1.
了解化学反应中能量转化的原因
,
能说出常见的能量转化形式。
2.
了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。
3.
了解热化学方程式的含义
,
能正确书写热化学方程式。
4.
了解焓变
(Δ
H
)
与反应热的含义。了解
Δ
H
=
H
(
生成物
)-
H
(
反应物
)
表达式的含义。
5.
理解盖斯定律
,
并能运用盖斯定律进行有关反应焓变的简单计算。
6.
了解能源是人类生存
和社会发展的重要基础
;
了解化学在解决能源
危机中的重要作用。
高频考点探究
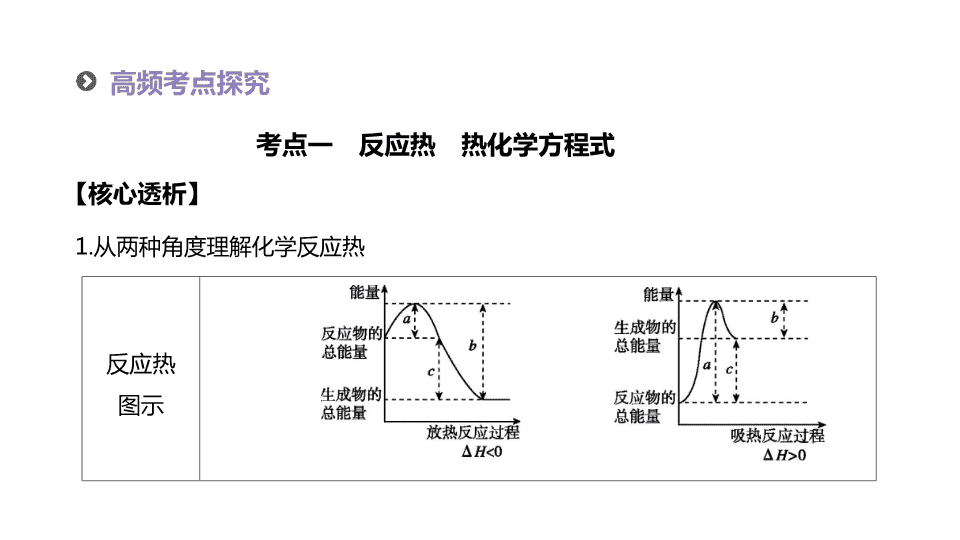
1.
从两种角度理解化学反应热
【
核心透析
】
考点一
反应热 热化学方程式
反应热
图示
图像
分析
微观
宏观
a
表示断裂旧化学键吸收的热量
;
b
表示生成新化学键放出的热量
;
c
表示反应热
a
表示反应物的活化能
;
b
表示活化分子形成生成物释放的能量
;
c
表示反应热
Δ
H
的
计算
Δ
H
=
H
(
生成物
)―
H
(
反应物
)
Δ
H
=∑
E
(
反应物键能
)―∑
E
(
生成物键能
)
2.“
五环节
”
法书写热化学方程式
[
提醒
]
对于具有同素异形体的物质
,
除了要注明聚集状态之外
,
还要注明物质的名称。
3.
燃烧热和中和热应用中的注意事项
(1)
均为放热反应
,Δ
H
<0,
单位为
kJ·mol
-1
。
(2)
燃烧热概念理解的三要点
:
①
外界条件是
25
℃
、
101 kPa;
②
反应的可燃物是
1 mol;
③
生成物是稳定的氧化物
(
包括状态
),
如碳元素生成的是
CO
2
,
而不是
CO,
氢元素生成的是液态水
,
而不是水蒸气。
(3)
中和热概念理解三要点
:
①
反应物的酸、碱是强酸、强碱
;
②
溶液是稀溶液
,
不存在稀释过程的热效应
;
③
生成产物水是
1 mol
。
例
1
(1)
[
2018·
北京卷
]
我国科研人员提出了由
CO
2
和
CH
4
转化为高附加值产品
CH
3
COOH
的催化反应历程
,
该历程示意图如图
6-1
所示。
【
典例探究
】
图
6-1
下列说法不正确的是
(
)
A.
生成
CH
3
COOH
总反应的原子利用率为
100%
B.CH
4
→CH
3
COOH
过程中
,
有
C—H
键发生断裂
C.
①
→
②
放出能量并形成了
C—C
键
D.
该催化剂可有效提高反应物的平衡转化率
(2)
[
2018·
海南卷
]
炭黑是雾霾中的重要颗粒物
,
研究发现它可以活化氧分子
,
生成活化氧
,
活化
过程的能量变化模拟计算结果如图
6-2
所示。
活化氧可以快速氧化二氧化硫。下列说法正确的是
(
)
图
6-2
A.
每活化一个氧分子吸收
0.29 eV
的能量
B.
水可使氧分子活化反应的活化能降低
0.42 eV
C.
氧分子的活化是
O—O
键的断裂与
C—O
键的生成过程
D.
炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
(3)
[
2016·
天津卷节选
]
硅和氯两元素的单质反应生成
1 mol Si
的最高价化合物
,
恢复至室温
,
放热
687 kJ,
已知该化合物的熔、沸点分别为
-69
℃
和
58
℃
,
写出该反应的热化学方程式
:
。
[
答案
]
(1)D
(2)CD
(3)Si(s)+2Cl
2
(g)=SiCl
4
(l)
Δ
H
=-687 kJ
·
mol
-1
[
解析
]
(1)
观察图像
,
发生的反应是二氧化碳和甲烷生成醋酸
,
反应的原子利用率为
100%,A
项正确
;
甲烷生成醋酸
,
观察分子结构可知有
C
—
H
键断裂
,B
项正确
;
观察图像
①
→
②,
物质的能量降低
,
故放出能量
,
且形成了
C
—
C
键
,C
项正确
;
催化剂只能改变反应速率
,
不影响平衡的转化率
,D
项错误。
(2)
根据图示
,
活化一个氧分子放出
0.29 eV
的热量
,A
错误
;
图中
0.73 eV
只是无水的过渡态
,0.75 eV
才是无水的中间态
,
因此水可使氧分子活化反应的活化能降低
0.18 eV,B
错误
;
氧气中存在
O
—
O
键
,
活化氧中存在
C
—
O
键
,C
正确
;
由题给信息“活化氧可以快速氧化二氧化硫”
,
结合氧化二氧化硫的总反应可知
,D
正确。
(3)
单质
Si
和
Cl
2
发生化合反应生成
Si
的最高价化合物即
SiCl
4
,
根据熔沸点可判断常温下
SiCl
4
为液体
,
根据题意可写出热化学方程式为
Si(s)+2Cl
2
(g)=SiCl
4
(l)
Δ
H
=-687 kJ
·
mol
-1
。
图
6-3
(2)
甲烷自热重整是先进的制氢方法
,
包含甲烷氧化和蒸汽重整两个过程。向反应系统同时通入甲烷、氧气和水蒸气
,
发生的主要化学反应如下表
,
则在初始阶段
,
蒸汽重整的反应速率
(
填
“
大于
”“
小于
”
或
“
等于
”)
甲烷氧化的反应速率。
化学键
C
=
O
H—H
C
=
C
C—H
H—O
键能
/(kJ·mol
-1
)
803
436
x
414
464
反应
过程
化学方程式
焓变
Δ
H
/
(kJ·mol
-1
)
活化能
E
a
/(kJ·mol
-1
)
甲烷
氧化
CH
4
(g)+2O
2
(g)=CO
2
(g)+2H
2
O(g)
-802.6
125.6
CH
4
(g)+O
2
(g)=CO
2
(g)+2H
2
(g)
-322.0
172.5
蒸汽
重整
CH
4
(g)+H
2
O(g)=CO(g)+3H
2
(g)
+206.2
240.1
CH
4
(g)+2H
2
O(g)=CO
2
(g)+4H
2
(g)
+158.6
243.9
(3)CO
2
在
Cu-ZnO
催化下
,
可同时发生如下的反应
Ⅰ
、
Ⅱ
,
其可作为解决温室效应及能源短缺问题的重要手段。
A
B
C
D
图
6-4
[
答案
]
(1)-(
b-a
)kJ
·
mol
-1
764 (2)
小于
(3)D
(2)
从表中活化能数据可以看出
,
在初始阶段
,
蒸汽重整反应活化能较大
,
而甲烷氧化的反应活化能均较小
,
所以甲烷氧化的反应速率快。
(3)
反应
Ⅰ
是放热反应
,
反应物的总能量大于生成物的总能量
,
反应
Ⅱ
是吸热反应
,
反应物的总能量小于生成物的总能量
,
因为反应
Ⅰ
的速率大于反应
Ⅱ,
因此反应
Ⅰ
的活化能低于反应
Ⅱ,D
正确。
特别提醒
【特别提醒】 催化剂能加快反应速率的原理是降低了反应的活化能
,
由此可推知反应的活化能越低
,
反应速率越快
,
相对来说反应就越易进行。
【
核心透析
】
考点二
盖斯定律的应用
【
典例探究
】
考查角度一
反应热的计算
[
答案
]
(1)53.1
(2)-136.2
变式
(1)
通过热循环进行能源综合利用的反应系统的原理如图
6-5
所示
:
图
6-5
系统
(
Ⅰ
)
制取氢气的热化学方程式为
,
两个系统制得等量的氢气所需能量较少的是
。
(2)
热化学碘硫循环脱硫涉及以下三个反应
:
bunsen
反应
:SO
2
(g)+I
2
(g)+2H
2
O(l) =2HI(g)+H
2
SO
4
(l)
Δ
H
硫酸分解反应
:2H
2
SO
4
(l) =2SO
2
(g)+O
2
(g)+2H
2
O(l)
Δ
H
=+462 kJ·mol
-1
碘化氢分解反应
:2HI(g) =H
2
(g)+I
2
(g)
Δ
H
=+10 kJ·mol
-1
已知氢气的燃烧热为
286 kJ·mol
-1
,
则
bunsen
反应的
Δ
H
=
kJ·mol
-1
。
解题策略
考查角度二
反应热大小的比较
则该反应的
Δ
H
=
。分别在
v
L
恒温密闭容器
A(
恒容
)
、
B(
恒压
,
容积可变
)
中
,
加入
CH
4
和
CO
2
各
1 mol
的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是
(
填
“A”
或
“B”)
。
(2)
室温下
,CuSO
4
(s)
和
CuSO
4
·5H
2
O(s)
溶于
水及
CuSO
4
·5H
2
O
受热分解的能量变化如
图
6-6
所示
,
下列说法不正确的是
(
)
A.
将
CuSO
4
·5H
2
O(s)
溶于水会使溶液温度降低
B.
将
CuSO
4
(s)
溶于水会使溶液温度升高
C.Δ
H
3
>Δ
H
2
D.Δ
H
1
=Δ
H
2
+Δ
H
3
图
6-6
[
答案
]
(1)+120 kJ
·
mol
-1
B
(2)D
[
解析
]
(1)
根据焓变
=
反应物的键能总和
-
生成物的键能总和
,
可得
Δ
H
=(4×413 kJ
·
mol
-1
+2×745 kJ
·
mol
-1
)-(2×1075 kJ
·
mol
-1
+2×436 kJ
·
mol
-1
)=+120 kJ
·
mol
-1
;
容器
A
恒容
,
随着反应进行
,
相对于容器
B
等于加压
,
平衡逆向移动
,
反应吸热较少。
变式
已知
:
C(s)+O
2
(g)=CO
2
(g)
Δ
H
1
CO
2
(g)+C(s)=2CO(g)
Δ
H
2
2CO(g)+O
2
(g)=2CO
2
(g)
Δ
H
3
4Fe(s)+3O
2
(g)=2Fe
2
O
3
(s)
Δ
H
4
3CO(g)+Fe
2
O
3
(s)=3CO
2
(g)+2Fe(s)
Δ
H
5
下列关于上述反应焓变的判断正确的是
(
)
A.Δ
H
1
>0,Δ
H
3
<0 B.Δ
H
2
>0,Δ
H
4
>0
C.Δ
H
1
=Δ
H
2
+Δ
H
3
D.Δ
H
3
=Δ
H
4
+Δ
H
5
归纳总结
比较反应热大小的方法
比较反应热的大小时要注意
:Δ
H
有正负之分
,
比较时要连同
“+”“-”
一起比较
,
类似数学中的正、负数大小的比较
;
若只比较放出或吸收热量的多少
,
则只比较数值的大小
,
不考虑正、负号。具体比较方法有如下几种
:
(1)
利用盖斯定律比较。
(2)
同一反应的生成物状态不同时
,
如
A(g)+B(g) =C(g)
Δ
H
1
,A(g)+B(g) C(l)
Δ
H
2
,
则
Δ
H
1
>Δ
H
2
。
命题考向追踪
【
历年动态
】
命题考向追踪
[
答案
]
C
2.
[
2016·
江苏卷
]
通过以下反应均可获取
H
2
。下列有关说法正确的是
(
)
①
太阳光催化分解水制氢
:2H
2
O(l)=2H
2
(g)+O
2
(g)
Δ
H
1
=+571.6 kJ·mol
-1
②
焦炭与水反应制氢
:C(s)+H
2
O(g)=CO(g)+H
2
(g)
Δ
H
2
=+131.3 kJ·mol
-1
③
甲烷与水反应制氢
:CH
4
(g)+H
2
O(g)=CO(g)+3H
2
(g)
Δ
H
3
=+206.1 kJ·mol
-1
A.
反应
①
中电能转化为化学能
B.
反应
②
为放热反应
C.
反应
③
使用催化剂
,Δ
H
3
减小
D.
反应
CH
4
(g)=C(s)+2H
2
(g)
的
Δ
H
=+74.8 kJ·mol
-1
[
答案
]
D
(2)
[
2018·
北京卷节选
]
近年来
,
研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下
:
图
6-7
[
答案
]
(1)247 (2)3SO
2
(g)+2H
2
O(g)=2H
2
SO
4
(l)+S(s)
Δ
H
2
=-254 kJ
·
mol
-1
(3)+135.6
c
(CO
2
)
·
c
(H
2
O) (4)2Δ
H
3
-2Δ
H
2
-Δ
H
1
(5)+124
[
解析
]
(1)
将题给三个已知热化学方程式依次编号为
①②③,
由
③×2
―
①
―
②
可得
CH
4
(g)+CO
2
(g) =2CO(g)+2H
2
(g);
根据盖斯定律
,
则该反应的
Δ
H
=(
―
111 kJ
·
mol
-1
)×2
―
(
―
75 kJ
·
mol
-1
)
―
(
―
394 kJ
·
mol
-1
)=+247 kJ
·
mol
-1
。
(2)
根据过程
,
反应
Ⅱ
为
SO
2
催化歧化生成
H
2
SO
4
和
S,
反应为
3SO
2
+2H
2
O =2H
2
SO
4
+S
↓。根据盖斯定律
,
由反应
Ⅰ+
反应
Ⅲ
得
2H
2
SO
4
(l)+S(s) 3SO
2
(g)+2H
2
O(g)
Δ
H
=Δ
H
1
+Δ
H
3
=(+551 kJ
·
mol
-1
)+(-297 kJ
·
mol
-1
)=+254 kJ
·
mol
-1
,
反应
Ⅱ
的热化学方程式为
3SO
2
(g)+2H
2
O(g) 2H
2
SO
4
(l)+S(s)
Δ
H
=-254 kJ
·
mol
-1
。
(3)
根据盖斯定律
,NaHCO
3
(s)
分解反应可由
①-②×2
得到
,
故
Δ
H
=Δ
H
1
-2Δ
H
2
=-127.4 kJ
·
mol
-1
-(-131.5 kJ
·
mol
-1
)×2=+135.6 kJ
·
mol
-1
。固体不能写入平衡常数表达式
,
该反应的平衡常数表达式
K
=
c
(CO
2
)
·
c
(H
2
O)
。
(4)
观察可知
,
四个热化学方程式关系式为
③×2-②×2-①=④,
由盖斯定律可知
2Δ
H
3
-2Δ
H
2
-Δ
H
1
=Δ
H
4
。
(5)
用反应物的总键能减去生成物的总键能等于反应的焓变
,
反应可看成是苯乙烷中乙基的两个碳氢键断裂
,
由碳碳单键变成碳碳双键
,
同时有
H
2
生成
,
故有
Δ
H
=412 kJ
·
mol
-1
×2+348 kJ
·
mol
-1
-612 kJ
·
mol
-1
-436 kJ
·
mol
-1
=+124 kJ
·
mol
-1
。
【2019
预测
】
图
6-8
[
答案
]
D
[
解析
]
根据反应过程示意图
,
过程
Ⅰ
为水分子中的化学键断裂的过程
,
为吸热过程
,A
错误
;
过程
Ⅲ
中
CO
、氢氧原子团和氢原子形成了二氧化碳、水和氢气
,H
2
中的化学键为非极性键
,B
错误
;
催化剂不能改变反应的
Δ
H
,C
错误
;
根据反应过程示意图
,
过程
Ⅰ
中水分子中的化学键断裂
,
过程
Ⅱ
也是水分子中的化学键断裂的过程
,
过程
Ⅲ
中形成了水分子
,
因此
H
2
O
均参与了反应过程
,D
正确。
5.(1)
已知
H
2
的燃烧热
Δ
H
=-285.8 kJ·moI
-1
,N
2
(g)+O
2
(g)=2NO(g)
Δ
H
=+180 kJ·moI
-1
。一定条件下
,H
2
还原
NO
生成液态水和一种无毒物质的热化学方程式为
。
(2)
在
100 kPa
和
298.15 K
下
,
由稳定单质生成
1 mol
化合物的焓变称为该物质在
298.15 K
时的标准摩尔生成焓。已知
NO
标准摩尔生成焓
Δ
H
=+91.5 kJ·moI
-1
,CO
的标准燃烧热
Δ
H
=-283 kJ·moI
-1
,
由此写出
NO
和
CO
反应的热化学方程式
:
。
(3)
已知拆开
1 mol H
2
、
1 mol O
2
和液态水中
1 mol O—H
键使之成为气态原子所需的能量分别为
436 kJ
、
496 kJ
和
462 kJ;CH
3
OH(g)
的燃烧热为
627 kJ·mol
-1
。则
CO
2
(g)+3H
2
(g)=CH
3
OH(g)+H
2
O(l)
Δ
H
=
kJ·mol
-1
。
[
答案
]
(1)2H
2
(g)+2NO(g)=N
2
(g)+2H
2
O(l)
Δ
H
=-751.6 kJ
·
mol
-1
(2)2CO(g)+2NO(g)=N
2
(g)+2CO
2
(g)
Δ
H
=-749 kJ
·
mol
-1
(3)-93
教师备用习题
教师备用习题
[
答案
]
A
[
答案
]
B
A.
反应的
Δ
H
=
逆反应活化能
-
正反应活化能
B.
把
1 mol CO(g)
和
2 mol H
2
(g)
充入密闭容器中
充分反应
,
达到平衡时放出的热量为
91 kJ
C.
从图中信息可知加入催化剂能改变反应历程和热效应
D.
相同条件下
,CO(g)
和
H
2
(g)
反应生成
1 mol
液态
CH
3
OH
放出的热量大于
91 kJ
(2)
某课题组实现了在常温常压下
,
以氮气和液态水为原料制备氨
,
同时有氧气生成。已知
,
在一定温度和压强下
,
由最稳定的单质生成
1 mol
纯物质的热效应
,
称为该物质的生成热
(Δ
H
)
。常温常压下
,
相关物质的生成热如下表所示
:
上述合成氨反应的热化学方程式为
。
(3)
氮的氧化物是大气污染物
,
可以通过催化还原法处理
,
在汽车排气管上安装一个催化转化器
,
发生反应
:
物质
NH
3
(g)
H
2
O(l)
Δ
H
/(kJ
·
mol
-1
)
-46
-242
[
解析
]
(1)
由图可知
,
反应为放热反应
,Δ
H
=
正反应活化能
-
逆反应活化能
,A
错误
;
反应为可逆反应
,
不可能完全转化
,
故把
1 mol CO(g)
和
2 mol H
2
(g)
充入密闭容器中充分反应
,
达到平衡时放出的热量小于
91 kJ,B
错误
;
从图中信息可知加入催化剂能改变反应历程但不能改变热效应
,C
错误
;
气态
CH
3
OH
转化为液态
CH
3
OH
时放热
,
故相同条件下
,CO(g)
和
H
2
(g)
反应生成
1 mol
液态
CH
3
OH
放出的热量大于
91 kJ,D
正确。