- 369.00 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
安徽省宣城市郎溪县郎溪中学2019-2020学年
高二第二学期第二次月考化学考卷
可能用到的相对原子质量:H-1 C-12 Ni-59
一、选择题(每题3分,共42分,每小题只有一个正确答案)
1.下列有关物质的性质或应用正确的是( )
A.单质硅用于制造芯片和光导纤维
B.浓硫酸能干燥SO2、NH3等气体,说明浓硫酸具有吸水性
C.SO2具有漂白性,通入紫色石蕊溶液中能使溶液会先变红后褪色
D.30%的H2O2溶液中加入FeCl3溶液可制得O2,说明FeCl3是催化剂
2.下列有关化学用语正确的是( )
A.二氧化碳的结构式:O—C—O B.原子核内有10个中子的氧原子:O
C.四氯化碳分子的电子式: D.聚丙烯的结构简式:
3.设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A.14 g乙烯和丙烯混合气体中的氢原子数为3NA B.1 molN2与3mol H2反应生成的NH3分子数为2NA
C.1molFe溶于过量稀硝酸,电子转移数为2NA D.标准状况下,2.24LCH3Cl含有的共价键数为0.4NA
4.下列各组中微粒能大量共存,且当加入试剂后反应的离子方程式书写正确的( )
选项
微粒组
加入试剂
发生反应的离子方程式
A
Na+、Fe3+、Cl-、I-
NaOH溶液
Fe3++3OH-=Fe(OH)3↓
B
K+、NH3·H2O、SO42-
通入少量CO2
2OH-+CO2=CO32-+H2O
C
Na+、Al3+、Cl-、NO3-
少量澄清石灰水
Al3++3OH-=Al(OH)3↓
D
H+、Fe2+、SO42-、Cl-
Ba(NO3)2溶液
SO42-+Ba2+=BaSO4↓
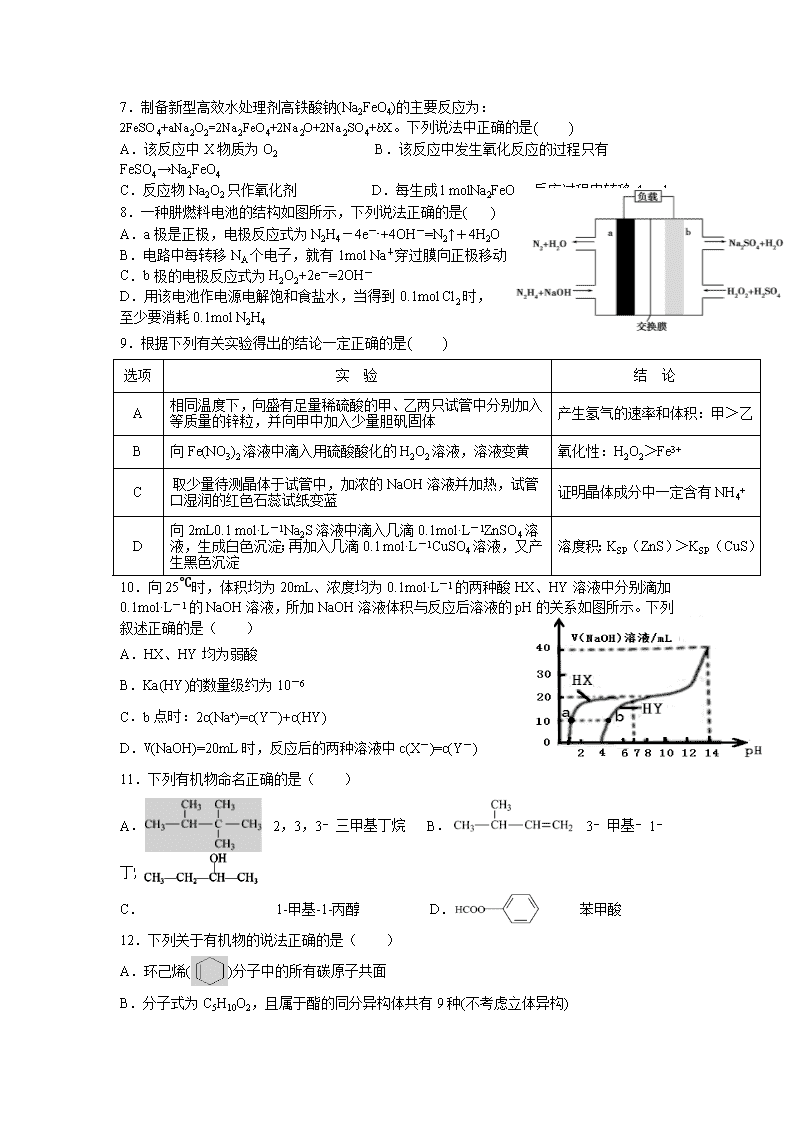
5. 用下列装置不能达到实验目的的是( )
A.用甲图装置可证明ρ(煤油)< ρ(钠) < ρ(水) B.用乙图装置制备Fe(OH)2
C.用丙图装置制取金属锰 D.用丁图装置制取氯气
6.已知短周期元素A、B、C、D原子序数依次增大,且最高价氧化物对应水化物
分别为X、Y、Z、W。常温下,X、Z、W均可与Y反应。0.1 mol·L-1的X、Z、
W三种溶液的pH如图所示。下列说法错误的是 ( )
A.B的离子半径小于A的离子半径 B.C氢化物稳定性小于D氢化物稳定性
C.B和D形成的化合物是离子化合物 D.B原子的电子层数与最外层电子数相等
7.制备新型高效水处理剂高铁酸钠(Na2FeO4)的主要反应为:2FeSO4+aNa2O2=2Na2FeO4+2Na2O+2Na2SO4+bX。下列说法中正确的是( )
A.该反应中X物质为O2 B.该反应中发生氧化反应的过程只有FeSO4→Na2FeO4
C.反应物Na2O2只作氧化剂 D.每生成l molNa2FeO4,反应过程中转移4 mol e-
8.一种肼燃料电池的结构如图所示,下列说法正确的是( )
A.a极是正极,电极反应式为N2H4-4e--+4OH-=N2↑+4H2O
B.电路中每转移NA个电子,就有1mol Na+穿过膜向正极移动
C.b极的电极反应式为H2O2+2e-=2OH-
D.用该电池作电源电解饱和食盐水,当得到0.1mol Cl2时,
至少要消耗0.1mol N2H4
9.根据下列有关实验得出的结论一定正确的是( )
选项
实 验
结 论
A
相同温度下,向盛有足量稀硫酸的甲、乙两只试管中分别加入等质量的锌粒,并向甲中加入少量胆矾固体
产生氢气的速率和体积:甲>乙
B
向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液,溶液变黄
氧化性:H2O2>Fe3+
C
取少量待测晶体于试管中,加浓的NaOH溶液并加热,试管口湿润的红色石蕊试纸变蓝
证明晶体成分中一定含有NH4+
D
向2mL0.1 mol·L-1Na2S溶液中滴入几滴0.1mol·L-1ZnSO4溶液,生成白色沉淀;再加入几滴0.1 mol·L-1CuSO4溶液,又产生黑色沉淀
溶度积:KSP(ZnS)>KSP(CuS)
10.向25℃时,体积均为20mL、浓度均为0.1mol·L-1的两种酸HX、HY溶液中分别滴加0.1mol·L-1的NaOH溶液,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是( )
A.HX、HY均为弱酸
B.Ka(HY)的数量级约为10-6
C.b点时:2c(Na+)=c(Y-)+c(HY)
D.V(NaOH)=20mL时,反应后的两种溶液中c(X-)=c(Y-)
11.下列有机物命名正确的是( )
A. 2,3,3﹣三甲基丁烷 B. 3﹣甲基﹣1﹣丁烯
C. 1-甲基-1-丙醇 D. 苯甲酸
12.下列关于有机物的说法正确的是( )
A.环己烯()分子中的所有碳原子共面
B.分子式为C5H10O2,且属于酯的同分异构体共有9种(不考虑立体异构)
C.丙烯和C4H8互为同系物
D.二环己烷( )的一氯代物有3种结构(不考虑立体异构)
13.某品牌的家用消毒剂其有效成分为对氯间二甲苯酚(结构简式如下图所示),可以杀灭新型冠状病毒。下面有关该物质的说法正确的是( )
A.该物质的分子式是C8H10ClO
B.0.1mol该物质最多可以与0.2mol NaOH反应
C.0.1mol该物质可以与含0.2molBr2的浓溴水发生取代反应
D.该物质可以发生加成、取代、消去、氧化等反应
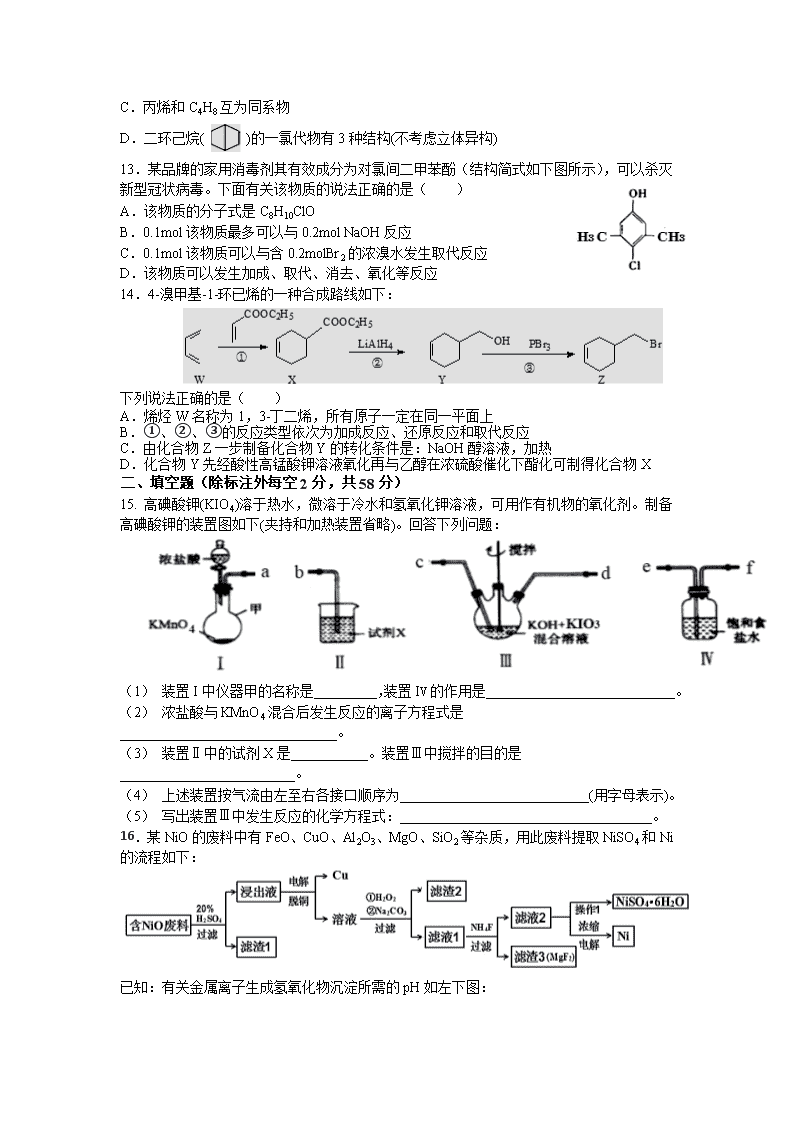
14.4-溴甲基-1-环已烯的一种合成路线如下:
下列说法正确的是( )
A.烯烃W名称为1,3-丁二烯,所有原子一定在同一平面上
B.①、②、③的反应类型依次为加成反应、还原反应和取代反应
C.由化合物Z一步制备化合物Y的转化条件是:NaOH醇溶液,加热
D.化合物Y先经酸性高锰酸钾溶液氧化再与乙醇在浓硫酸催化下酯化可制得化合物X
二、填空题(除标注外每空2分,共58分)
15. 高碘酸钾(KIO4)溶于热水,微溶于冷水和氢氧化钾溶液,可用作有机物的氧化剂。制备高碘酸钾的装置图如下(夹持和加热装置省略)。回答下列问题:
(1) 装置I中仪器甲的名称是_________,装置IV的作用是___________________________。
(2) 浓盐酸与KMnO4混合后发生反应的离子方程式是_______________________________。
(3) 装置Ⅱ中的试剂X是___________。装置Ⅲ中搅拌的目的是_________________________。
(4) 上述装置按气流由左至右各接口顺序为___________________________(用字母表示)。
(5) 写出装置Ⅲ中发生反应的化学方程式:____________________________________。
16.某NiO的废料中有FeO、CuO、Al2O3、MgO、SiO2等杂质,用此废料提取NiSO4和Ni的流程如下:
已知:有关金属离子生成氢氧化物沉淀所需的pH如左下图:
(1)滤渣1的主要成分为________________。
(2)①用离子方程式解释加入H2O2的作用_____________________________________。
②加Na2CO3调节溶液的pH至5,则滤渣2的主要成分为____________________。
(3)从滤液2中获得NiSO4·6H2O的实验操作是____________、____________、过滤、洗涤、干燥。
(4)电解浓缩后的滤液2可获得金属镍,其基本反应原理示意图见右上图:
① B极附近pH会_______(填“升高”、“降低”或“不变”);用平衡移动原理解释B极附近pH变化的原
因:__________________________________________________________。
②一段时间后,在A、B两极均收集到11.2L气体(标准状况下),理论上能得到Ni________g。
17.能源问题是现代社会发展的三大基本问题之一。
(1)焦炭可用于制取水煤气。实验测得1.2 g 碳与水蒸气完全反应生成水煤气时,吸收了13.16 kJ热量。该反应的热化学方程式为__________________________;该反应在________条件下能自发进行(选“高温”、“低温”或“任意温度”)。
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
①T1和T2温度下的平衡常数大小关系是K1_______K2。
(填“>”、“<”或“=”)
②若容器容积不变,下列措施不能增加CO转化率的是_______。
(填字母)
a.降低温度 b.将CH3OH(g)从体系中分离 c.使用合适的催化剂
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。
则图中t2时采取的措施可能是___________________ ;
④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得
容器内总压强1MPa,40min达平衡时测得容器内总压强为
0.6MPa,计算生成甲醇的压强平衡常数KP=________(MPa)-2
(小数点后保留2位小数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流,请写出负极的电极反应为________________________。
18. 丙烯是石油化工的重要原料,一定条件下可发生下列转化:已知:
(1)A的结构简式为:______________________;反应④的类型为:_____________反应;
(2) D与足量乙醇反应生成E的化学方程式为:____________________________________________。
(3)与足量NaOH溶液反应的化学方程式为__________________________________。
(4)B的同分异构体有多种,其中既能发生银镜反应,又能发生酯化反应的同分异构体有 种,写出
其中核磁共振氢谱峰值为6:1:1的同分异构体的结构简式___________________________。
(5) 根据所学知识,写出以丙烯为原料制备2-羟基丙酸()的合成路线,无机试剂任选。
催化剂
(合成路线书写示例: , 注意反应条件 )
。
化学答案
一、选择题
1-5 DBDCD 6-10 CABCC 11-14 BBCB
二、填空题(除标注外每空2分)
15. (1)圆底烧瓶 除去氯气中的HCl气体
(2) 16H++10Cl-+2MnO4-=2Mn2++8H2O+5Cl2↑
(3) NaOH溶液 使反应混合物混合均匀,反应更充
(4) a e f c d b
(5) 2KOH+Cl2+KIO3 == KIO4+2KCl+H2O
16 . (1)SiO2 2H++Fe2++H2O2=2Fe3++2H2O
(2)Fe(OH)3 (1分) Al(OH)3 (1分)
(3)蒸发浓缩 (1分) 冷却结晶(1分)
(4)降低 H2OH++OH-,OH-在B极放电使c(OH-)降低,平衡向右移动,c(H+)增大,导致pH降低
(5) 29.5 (3分)
17. (1)C(s)+H2O(g)=CO(g)+H2(g) ∆H=+131.6 kJ/mol 高温
(2) > c 加压 66.67
(3)CH3OH-6e-+8OH- = CO32-+6H2O
18.
(4)5种(2分) (2分)
(5)
(4分)