- 544.50 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
普高联谊校高三第五次月考
理科综合能力测试化学试卷
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.作答时,务必将答案写在答题卡上。写在本试卷及草稿纸上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H1 C12 O16 Na23 Ca40 Cl35.5 Fe56
7.废电池投入的垃圾桶上应贴有的垃圾分类标志是
8.用NA代表阿伏加德罗常数的数值。下列说法正确的是
A.3.6 g CaO2晶体中阴离子的数目为0.1NA
B.将7.1 g Cl2通入水中,转移电子数为0.1NA
C.标准状况下,11.2 L O2和CO2混合气体含有的氧原子数为NA
D.室温下,1 L pH=13的NaOH溶液中,由水电离出的OH-的数目为0.1NA
9.下列反应的离子方程式正确的是
A.碳酸钠的水溶液呈碱性:CO32-+2H2OH2CO3+2OH-
B.用CH2COOH溶解CaCO3:CO32-+CH3COOH=CH3COO-+H2O+CO2↑
C.向Fe(OH)3胶体中加入氢碘酸溶液:Fe(OH)3+3H+=Fe3++3H2O
D.氧化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl-
10.某铁的氧化物(FexO)1.52 g溶于足量盐酸中,向所得溶液中通入标准状况下112 mLCl2,恰好将Fe2+完全氧化成Fe3+,则x值为
A.0.80 B.0.85 C.0.90 D.0.93
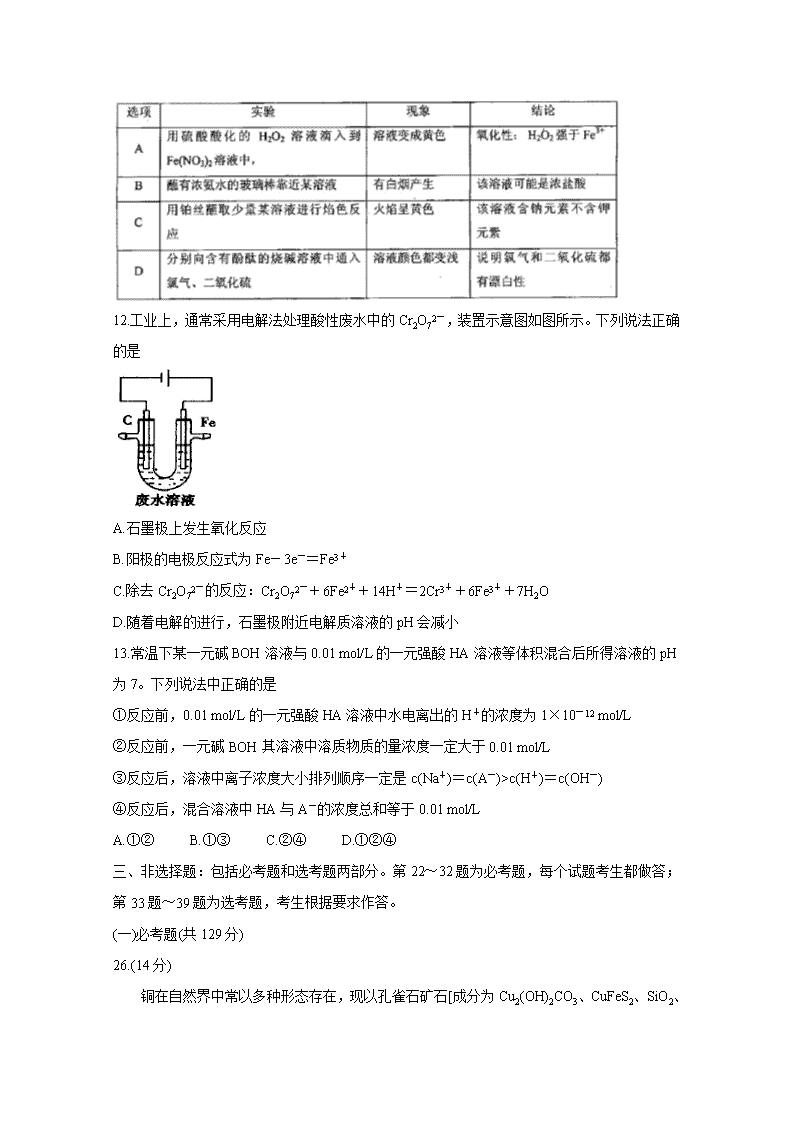
11.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是
12.工业上,通常采用电解法处理酸性废水中的Cr2O72-,装置示意图如图所示。下列说法正确的是
A.石墨极上发生氧化反应
B.阳极的电极反应式为Fe-3e-=Fe3+
C.除去Cr2O72-的反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
D.随着电解的进行,石墨极附近电解质溶液的pH会减小
13.常温下某一元碱BOH溶液与0.01 mol/L的一元强酸HA溶液等体积混合后所得溶液的pH为7。下列说法中正确的是
①反应前,0.01 mol/L的一元强酸HA溶液中水电离出的H+的浓度为1×10-12 mol/L
②反应前,一元碱BOH其溶液中溶质物质的量浓度一定大于0.01 mol/L
③反应后,溶液中离子浓度大小排列顺序一定是c(Na+)=c(A-)>c(H+)=c(OH-)
④反应后,混合溶液中HA与A-的浓度总和等于0.01 mol/L
A.①② B.①③ C.②④ D.①②④
三、非选择题:包括必考题和选考题两部分。第22~32题为必考题,每个试题考生都做答;第33题~39题为选考题,考生根据要求作答。
(一)必考题(共129分)
26.(14分)
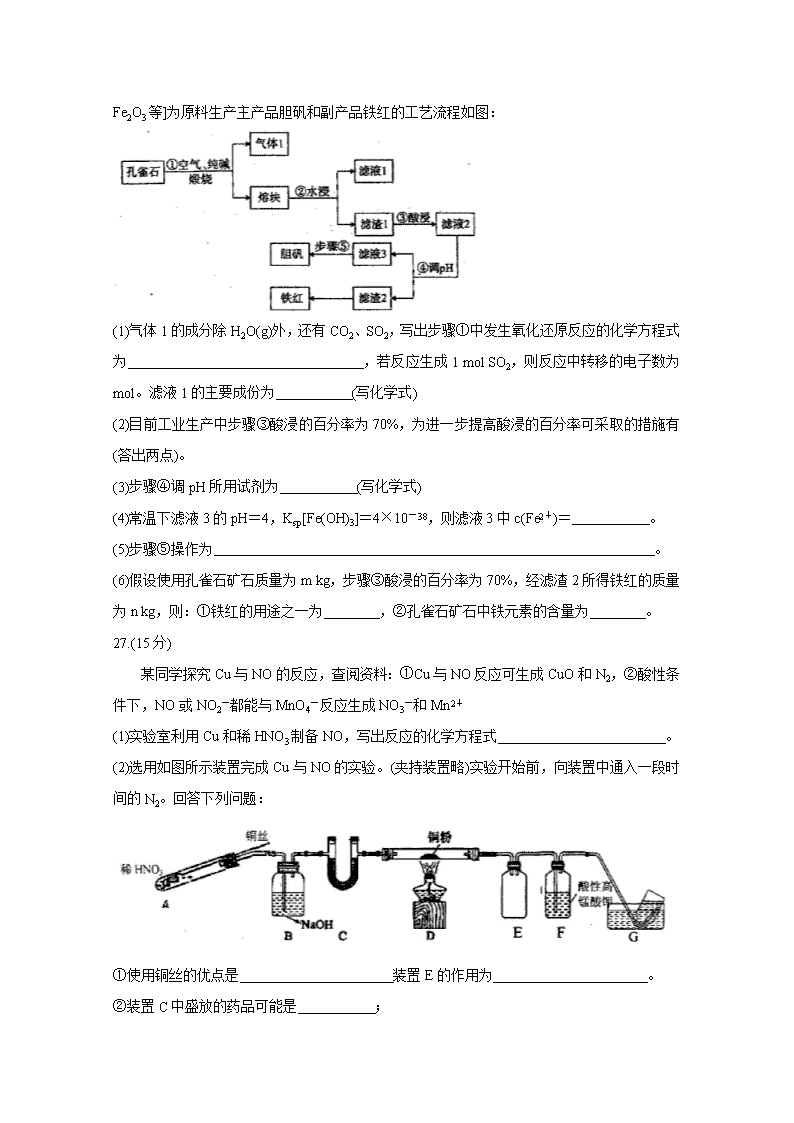
铜在自然界中常以多种形态存在,现以孔雀石矿石[成分为Cu2(OH)2CO3、CuFeS2、SiO2
、Fe2O3等]为原料生产主产品胆矾和副产品铁红的工艺流程如图:
(1)气体1的成分除H2O(g)外,还有CO2、SO2,写出步骤①中发生氧化还原反应的化学方程式为 ,若反应生成1 mol SO2,则反应中转移的电子数为 mol。滤液1的主要成份为 (写化学式)
(2)目前工业生产中步骤③酸浸的百分率为70%,为进一步提高酸浸的百分率可采取的措施有 (答出两点)。
(3)步骤④调pH所用试剂为 (写化学式)
(4)常温下滤液3的pH=4,Ksp[Fe(OH)3]=4×10-38,则滤液3中c(Fe2+)= 。
(5)步骤⑤操作为 。
(6)假设使用孔雀石矿石质量为m kg,步骤③酸浸的百分率为70%,经滤渣2所得铁红的质量为n kg,则:①铁红的用途之一为 ,②孔雀石矿石中铁元素的含量为 。
27.(15分)
某同学探究Cu与NO的反应,查阅资料:①Cu与NO反应可生成CuO和N2,②酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+
(1)实验室利用Cu和稀HNO3制备NO,写出反应的化学方程式 。
(2)选用如图所示装置完成Cu与NO的实验。(夹持装置略)实验开始前,向装置中通入一段时间的N2。回答下列问题:
①使用铜丝的优点是 装置E的作用为 。
②装置C中盛放的药品可能是 ;
③装置D中的现象是 ;装置F中反应的离子方程式是 。
(3)测定NaNO2和NaNO3混合溶液中NaNO2的浓度。取25.00 mL混合溶液于锥形瓶中,用0.1000 mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
①第一次实验数据出现异常,造成这种异常的原因可能是 (填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
d.酸性KMnO4溶液中含有其他氧化性试剂
e.锥形瓶洗净后用待测液润洗
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为 。
③NaNO2的物质的量浓度为
28.(14分)
CO2和CH4是常见的化合物,同时也是常用的化工原料。
I.以CO2与NH3为原料可以合成尿素[CO(NH2)2]。合成尿素的反应为2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(g)。
(1)在不同温度及不同y值下合成尿素,达到平衡时,氨气转化率变化情况如图所示。①该反应的△H 0(填“>”或、“<”),该反应自发进行的条件是 (填“低温”“高温”或“任意温度”)若y表示反应开始时的氨碳比[n(NH3)/n(CO2)],则y1 y2。(填“>”、“<”或“=”);
(2)t℃时,若向容积固定的密闭容器中加入一定量的NH3和CO2合成尿素,下列叙述能说明此反应达到平衡状态的是 (填字母)。
a.混合气体的平均相对分子质量保持不变
b.CO2和NH3的体积分数保持不变
c.CO2和NH3的转化率相等
d.混合气体的密度保持不变
e.1 mol CO2生成的同时有2 mol N-H键断裂
II.工业上用CH4与水蒸气在一定条件下制取H2:CH4(g)+H2O(g)CO(g)+3H2(g) △H=+203 kJ·mol-1
①该反应逆反应速率表达式为:v逆=k·c(CO)·c3(H2),k为速率常数,在某温度下测得实验数据如表:
由上述数据可得该温度下,该反应的逆反应速率常数k为 L3·mol-3·min-1。
②某温度下,在体积为3L的密闭容器中通入物质的量均为3 mol的CH4和水蒸气,发生上述反应,5分钟时达到平衡,此时H2的体积分数为60%,则在5分钟内用CH4浓度变化表示的平均反应速率v(CH4)= ;该温度下该反应的平衡常数K= 。平衡后再向容器中加入1 mol CH4和1 mol CO,平衡 移动(填“正反应方向”或“逆反应方向”或“不”)。
III.在常温下,将0.02 mol CO2通入200 mL 0.15 mol/L的NaOH溶液中,充分反应后下列关系式中正确的是
A.c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
B.3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
C.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
D.c(HCO3-)+3c(H2CO3)+2c(H+)=c(CO32-)+2c(OH-)
(二)选考题:共45分。请考生从2道物理题、2道化学题、2道生物题中每科任选一题作答。如果多做,则每科按所做的第一题计分。
35.[化学——选修3:物质结构与性质](15分)
氢、氮、氧、硫,镁,铁、铜,锌等元素及其化合物在人们的日常生活中有着广泛的用途。回答下列问题:
(1)某同学根据已学知识,推断Mg基态原子的核外电子排布为,
该同学所画的电子排布图违背了 。
(2)Fe位于 族 区,Fe2+价电子排布式为 。
(3)MgCO3的分解温度 BaCO3(填“>”或、“<”)
(4)C、N、O元素的第一电离能由大到小的顺序为
(5)1mol [Cu(NH3)2]+中含有σ键的数目为
(6)下列有关说法不正确的是
A.热稳定性:NH3>PH3,原因是NH3分子间存在氢键,而PH3分子间存在范德华力
B.SO2与CO2的化学性质有些类似,但空间结构与杂化方式不同
C.熔、沸点:SiF4KCl>KBr,原因是晶格能逐渐减小
(7)晶体Cu的堆积方式如图所示,其中Cu原子在二维平面里放置时的配位数为 ,设Cu原子半径为a,晶体的空间利用率为 。(用含π,a、的式子表示,不必化简)
36.[化学——选修5:有机化学基础](15分)
卡托普利(E)是一种血管紧张素转化酶抑制剂,被应用于治疗高血压和某些类型的充血性心力衰竭。合成路线如下:
(1)A中官能团的名称是 ,A→B反应方程式为 。C→D的反应类型是 。
(2)1 mol D与NaOH溶液反应,最多消耗 NaOH
(3)卡托普利E的分子中有 个手性碳原子,下列关于E说法不正确的是 。
a.卡托普利的水溶液呈酸性 b.在氧气中充分燃烧的产物中含有SO2
c.E的分子式为C9H16NO3S d.E存在属于芳香族化合物的同分异构体
(4)A与浓硫酸、甲醇反应生成M,M的同分异构体在核磁共振氢谱图中出现两种信号峰、且只有一种官能团,该同分异构体可能结构为 、 。M加聚反应生成高分子化合物N的方程式为 。
答案