- 335.00 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学试题
本试题卷共8页,满分100分。考试时间90分钟。
【注意事项】
1、答卷前,考生务必将自己的姓名、班级、准考证号填写在答题卷上。考试结束后,只将答题卷交回。
2、试卷中的选择题部分,请在选出答案后,用铅笔把答题卷上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。不能答在试题卷上。
3、 试卷中的非选择题部分,请用0.5mm黑色签字笔在答题卷上各题目的答题区域内作答,超出黑色矩形边框限定区域的答案无效。不能答在试题卷上。
可能用到的相对原子质量:H—1 Li—7 C—12 N—14 O—16 F—19 Na—23 Mg—24 Al—27 Si—28 P—31 S—32 Cl—35.5 K—39 Ca—40 Cr—52 Mn—55 Fe—56 Cu—64 Zn—65 Ag—108 I—127 Ba—137
第Ⅰ卷(选择题 共45分)
一、选择题(本题共20小题,1~15每题2分,16~20每题3分,且每题只有一个正确答案)
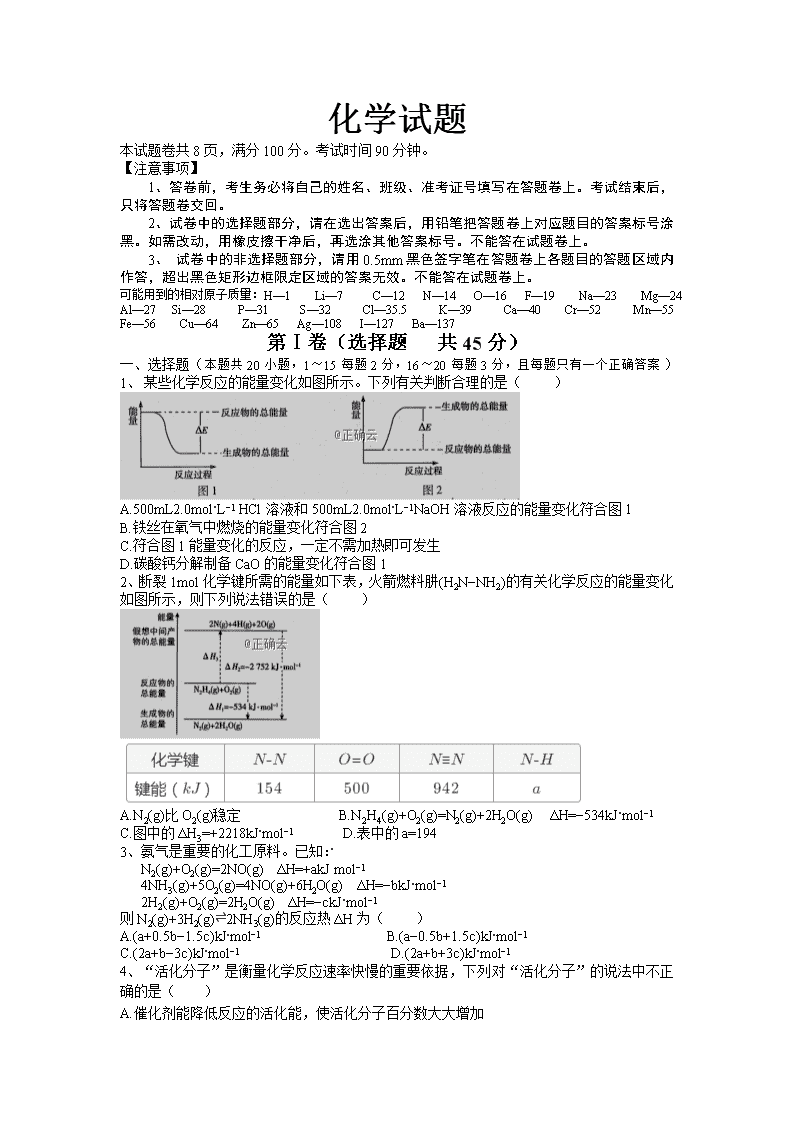
1、 某些化学反应的能量变化如图所示。下列有关判断合理的是( )
A.500mL2.0mol⋅L−1 HCl溶液和500mL2.0mol⋅L−1NaOH溶液反应的能量变化符合图1
B.铁丝在氧气中燃烧的能量变化符合图2
C.符合图1能量变化的反应,一定不需加热即可发生
D.碳酸钙分解制备CaO的能量变化符合图1
2、断裂1mol化学键所需的能量如下表,火箭燃料肼(H2N−NH2)的有关化学反应的能量变化如图所示,则下列说法错误的是( )
A.N2(g)比O2(g)稳定 B.N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=−534kJ⋅mol−1
C.图中的ΔH3=+2218kJ⋅mol−1 D.表中的a=194
3、氨气是重要的化工原料。已知:
N2(g)+O2(g)=2NO(g) ΔH=+akJ⋅mol−1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=−bkJ⋅mol−1
2H2(g)+O2(g)=2H2O(g) ΔH=−ckJ⋅mol−1
则N2(g)+3H2(g)⇌2NH3(g)的反应热ΔH为( )
A.(a+0.5b−1.5c)kJ⋅mol−1 B.(a−0.5b+1.5c)kJ⋅mol−1
C.(2a+b−3c)kJ⋅mol−1 D.(2a+b+3c)kJ⋅mol−1
4、“活化分子”是衡量化学反应速率快慢的重要依据,下列对“活化分子”的说法中不正确的是( )
A.催化剂能降低反应的活化能,使活化分子百分数大大增加
B.增大反应物的浓度,可使单位体积内活化分子的数目增多,反应速率加快
C.对于有气体参加的反应,通过压缩容器增大压强,可使单位体积内活化分子的数目增多,反应速率加快
D. 对于是吸热反应和放热反应,升高温度只能增大吸热反应的活化分子百分数
5、在恒容密闭容器中进行如下反应X(g)+Y(g)⇌2Z(g)+W(?),已知“?”代表W状态未确定。下列情况能表明该可逆反应一定达到平衡状态的是 ( )
A.混合气体平均相对分子质量不变 B.混合气体密度不变
C.混合气体压强不变 D.Z的消耗速率等于X的生成速率的2倍
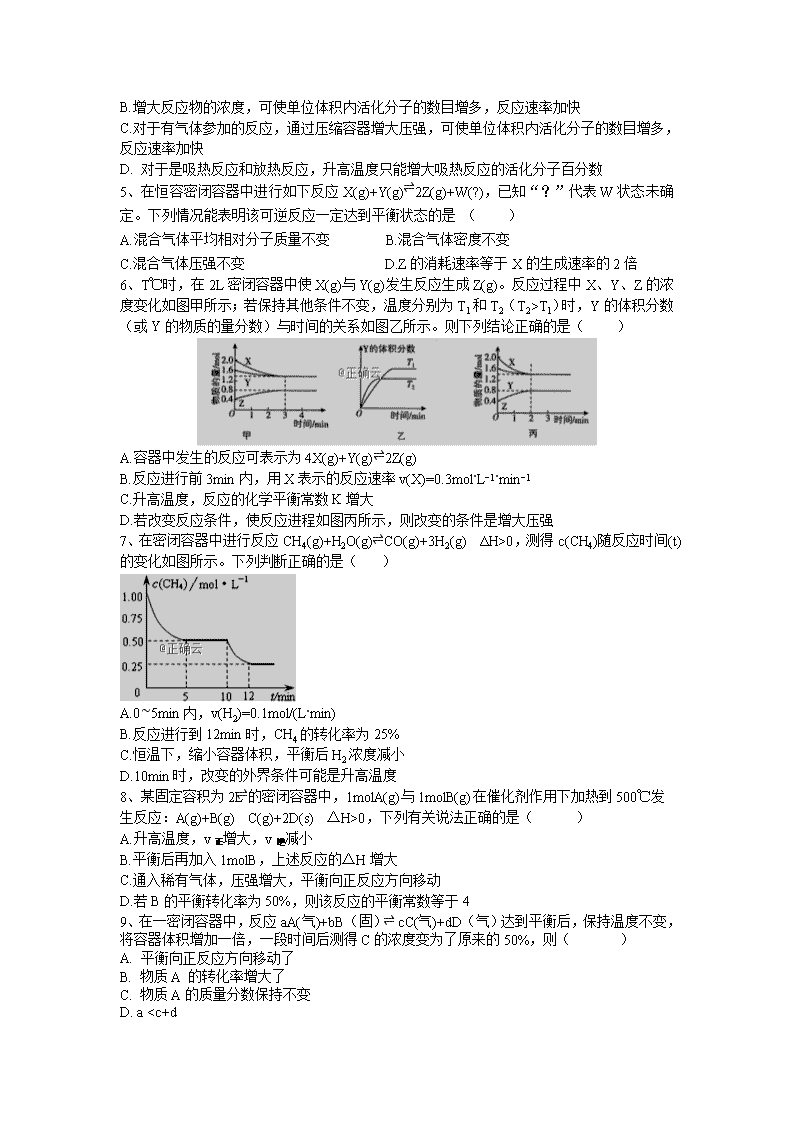
6、T℃时,在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图甲所示;若保持其他条件不变,温度分别为T1和T2(T2>T1)时,Y的体积分数(或Y的物质的量分数)与时间的关系如图乙所示。则下列结论正确的是( )
A.容器中发生的反应可表示为4X(g)+Y(g)⇌2Z(g)
B.反应进行前3min内,用X表示的反应速率v(X)=0.3mol⋅L−1⋅min−1
C.升高温度,反应的化学平衡常数K增大
D.若改变反应条件,使反应进程如图丙所示,则改变的条件是增大压强
7、在密闭容器中进行反应CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断正确的是( )
A.0∼5min内,v(H2)=0.1mol/(L⋅min)
B.反应进行到12min时,CH4的转化率为25%
C.恒温下,缩小容器体积,平衡后H2浓度减小
D.10min时,改变的外界条件可能是升高温度
8、某固定容积为2L的密闭容器中,1molA(g)与1molB(g)在催化剂作用下加热到500℃发
生反应:A(g)+B(g)⇌C(g)+2D(s) △H>0,下列有关说法正确的是( )
A.升高温度,v正增大,v逆减小
B.平衡后再加入1molB,上述反应的△H增大
C.通入稀有气体,压强增大,平衡向正反应方向移动
D.若B的平衡转化率为50%,则该反应的平衡常数等于4
9、在一密闭容器中,反应aA(气)+bB(固)⇌ cC(气)+dD(气)达到平衡后,保持温度不变,将容器体积增加一倍,一段时间后测得C的浓度变为了原来的50%,则( )
A. 平衡向正反应方向移动了
B. 物质A 的转化率增大了
C. 物质A的质量分数保持不变
D. a p2,则a+b>c+d且ΔH<0
B.图乙中,若T2>T1,则ΔH<0且a+b=c+d
C.图丙中,t1时刻改变的条件一定是使用了催化剂
D.图丁中,若ΔH<0,则纵坐标不可能表示的是反应物的转化率
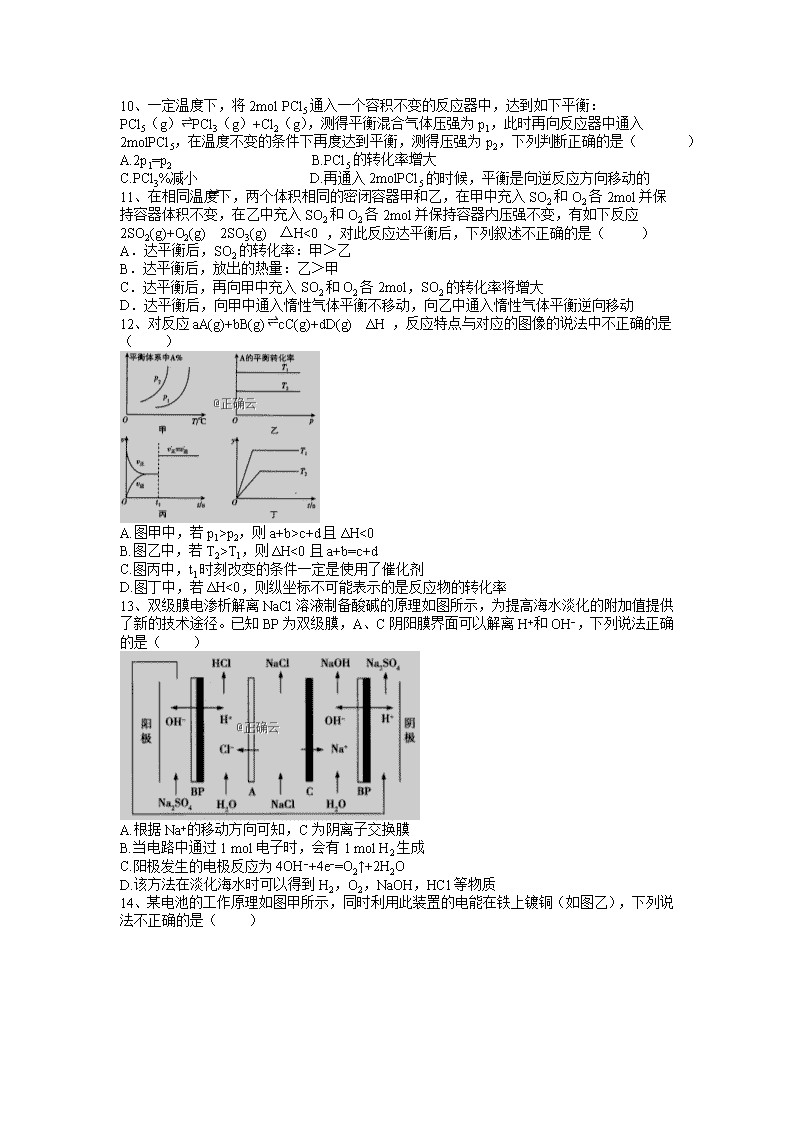
13、双级膜电渗析解离NaCl溶液制备酸碱的原理如图所示,为提高海水淡化的附加值提供了新的技术途径。已知BP为双级膜,A、C阴阳膜界面可以解离H+和OH−,下列说法正确的是( )
A.根据Na+的移动方向可知,C为阴离子交换膜
B.当电路中通过1 mol电子时,会有1 mol H2生成
C.阳极发生的电极反应为4OH−+4e−=O2↑+2H2O
D.该方法在淡化海水时可以得到H2,O2,NaOH,HCl等物质
14、某电池的工作原理如图甲所示,同时利用此装置的电能在铁上镀铜(如图乙),下列说法不正确的是( )
A.电池工作时,a是正极,外电路中流过0.02mol电子,负极材料减重0.65g
B.电子从Zn极流出,流入Fe极,经盐桥回到Zn极
C.当电池电极提供1mol电子时,则理论上图乙铁电极增重32g
D.烧杯a中发生反应O2+2H2O+4e−=4OH−,溶液pH升高
15、 一种双室微生物燃料电池污水净化系统原理如图所示,图中酸性污水中含有的有机物用C6H12O6表示。下列有关该电池的说法不正确的是( )
A.正极的电极反应为Fe(CN) 63−+e−=Fe(CN) 64−
B.电池的总反应为C6H12O6+24Fe(CN) 63−+6H2O=6CO2↑+24Fe(CN) 64−+24H+
C.该“交换膜”可选用“质子交换膜”
D.若将“K3Fe(CN)6溶液”改为“O2”,当有22.4LO2参与反应时,理论上转移4mol电子
16、已知可逆反应3X(g)+2Y(s)⇌nC(g) ΔH。若p10
B.在T2时,若反应体系处于状态D,则此时v正>v逆
C.若状态B、C、D的压强分别为PB、PC、PD,则PC=PD>PB
D.若该反应在T1、T2时的平衡常数分别为K1、K2,则K1”、“<”或“=”),用平衡移动原理解释理由是 ;
②由图可知,P2 0.1MPa(填“>”、“<”或“=”) ,用平衡移动原理解释理由是 。
③如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是________(选填编号)。
A.v正(H2)=v逆(H2O)
B.再加入MOS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
④由图可知M点时氢气的平衡转化率为 。
⑤平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数Kp=________(MPa)2
参考答案
一、选择题(1~15每题2分,16~20每题3分,共45分)
1
2
3
4
5
6
7
8
9
10
A
D
A
D
A
C
D
D
C
C
11
12
13
14
15
16
17
18
19
20
A
C
D
B
D
C
D
C
D
B
二、非选择题(本题包括四个题,共55分)
21、除标注外,其余每空1分,共13分
(1) I、阳 4OH--4e-===O2↑+2H2O或2H2O-4e-=4H++O2↑(2分)
2CuSO4+2H2O2Cu+O2↑+2H2SO4(2分)
Ⅱ、①铜 不变 ② 0.25
Ⅲ、c
(2)① Fe2+ ②产生蓝色沉淀 溶液变红色 ③牺牲阳极的阴极保护法
22、除标注外,其余每空1分,共7分
(1)①H2(g)+1/2O2(g)=H2O(l) △H=-286.0kJ/mol(2分)
(2)①C ②0.12mol/(L·min) ③a、c(2分)
(3)增大压强,化学反应速率加快,化学平衡正向移动,有利于氨的合成
23、除标注外,其余每空1分,共17分
(1)Ⅰ、Cr2+H2O2Cr+2H+或2Cr+2H+Cr2+H2O(2分) 橙
Ⅱ、①5H2C2O4+2Mn+6H+=2Mn2++10CO2↑+8H2O(2分)
②2 确保每次实验c(H2C2O4) 、 c(H2SO4)不变(2分)
③1.5 mol··
(2)①c (CO)·c (H2O)/c (CO2) ·c (H2)
②吸热 不变 减小 ③2/3或66.7%或66.67%或0.67(2分) ④小于(2分)
24、每空2分,共18分
(1)△H1+2△H2 2.8
(2)①> 由图可知,在其他条件不变时,随温度升高,H2的体积分数逐渐减小 ,说明温度升高时,化学平衡向正反应方向移动,所以正反应为吸热反应,△H>0
②> 由图可知,在相同的温度下,P2条件下的H2体积分数比P1条件下的H2体积分数大,根据反应的化学方程式可知,压强增大时,化学平衡向逆反应方向移动,H2体积分数将增大,所以P2>P1 =0.1MPa
③B ④2/3或66.7%或66.67%或0.67 ⑤0.01