- 451.50 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学试卷
评卷人
得分
一、选择题
1.下列说法正确的是( )
A.氯水应保存在棕色广口瓶中并置于阴凉处
B.用玻璃棒蘸醋酸溶液点在用水润湿的pH 试纸上,测定该溶液pH
C.焰色反应时,先用稀盐酸洗涤铂丝并在酒精灯火焰上灼烧至无色,然后再进行实验
D.用容量瓶配制溶液时,先用蒸馏水洗涤,再用待装溶液润洗
2.下列实验中,预期的现象不合理的是( )
选项
滴管
试管
预测的现象
A
浓硫酸
铝片
持续产生使品红溶液褪色的气体
B
氨水
CaO固体
产生使湿润的红色石蕊试纸变蓝的气体
C
氯水
溶液
溶液变成黄色
D
KI溶液
AgCl悬浊液
白色沉淀变黄
A.A B.B C.C D.D
3.下列离子方程式书写不正确的是( )
A.向溶液中通入少量气体:
B.大理石与醋酸反应:
C.制备胶体:
D.少量碳酸氢钠溶液与足量石灰水反应:
4.室温下,0.1mol/L某一元酸(HA)溶液中,下列叙述正确的是( )
A.溶液中水电离出的
B.溶液中
C.与0.05 NaOH溶液等体积混合,所得混合溶液中水的电离程度减小
D.上述溶液中加入一定量NaA晶体或加水稀释,溶液的均增大
5.NO和CO都是汽车尾气里的有害物质,有人提出通过以下反应来处理尾气:。 对上述反应,下列看法正确的是( )
A.使用催化剂能加快反应速率
B.改变压强对反应速率没有影响
C.冬天气温低,反应速率降低,对人体危害较小
D.无论外界条件怎样改变,均对此化学反应的速率无影响
6.如下图所示,三个烧瓶中分别充满气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(1)中加入CaO,在(2)中不加其他任何物质,在(3)中加入晶体,发现(1)中红棕色变深,(3)中红棕色变浅,下列叙述正确的是( )
A.是放热反应
B.溶于水时放出热量
C.烧瓶(1)中平衡混合气的相对分子质量增大
D.烧瓶(3)中气体的压强增大
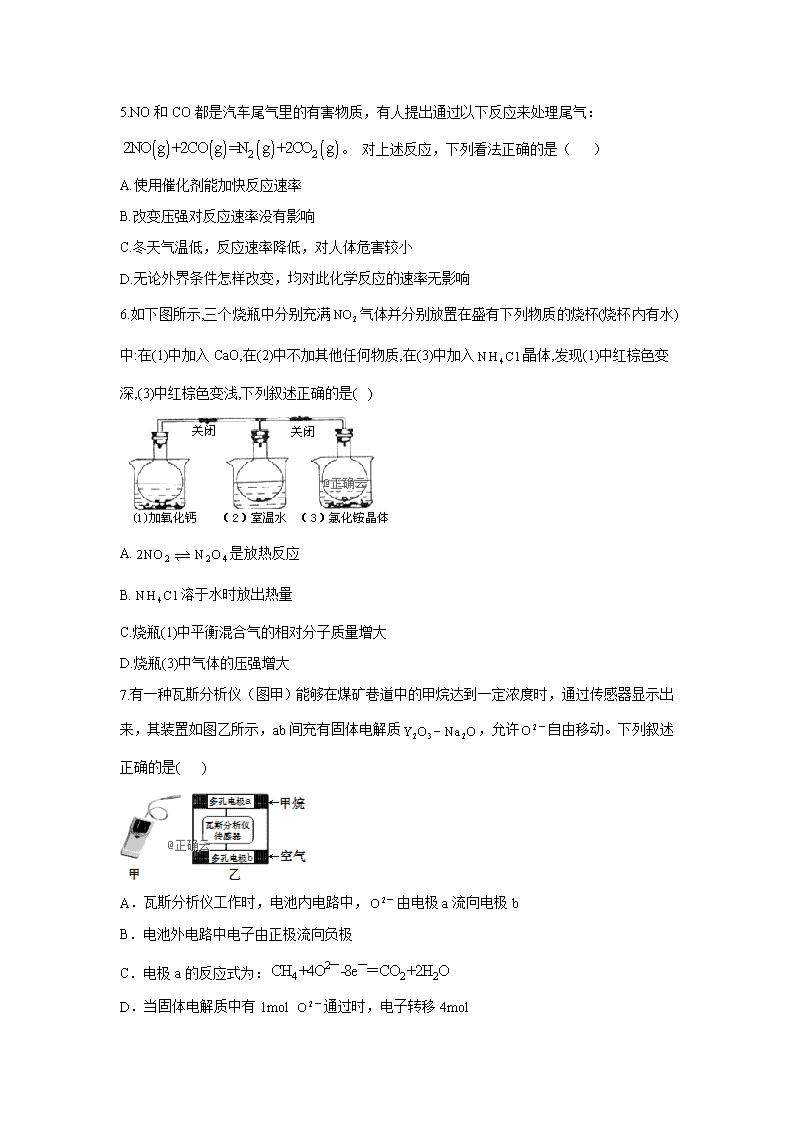
7.有一种瓦斯分析仪(图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来,其装置如图乙所示,ab间充有固体电解质,允许自由移动。下列叙述正确的是( )
A.瓦斯分析仪工作时,电池内电路中,由电极a流向电极b
B.电池外电路中电子由正极流向负极
C.电极a的反应式为:
D.当固体电解质中有1mol 通过时,电子转移4mol
评卷人
得分
二、填空题
8.铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。放电时,该电池总反应式为:Pb+PbO2+2H2SO42PbSO4+2H2O。请根据上述情况判断:
(1)该蓄电池的负极材料是__________,放电时发生__________(填“氧化”或“还原”)反应。
(2)该蓄电池放电时,电解质溶液的酸性______(填“增大”、“减小”或“不变”),电解质溶液中阴离子移向_____(填“正”或“负”)极。
(3)已知硫酸铅为不溶于水的白色固体,生成时附着在电极上。试写出该电池放电时,正极的电极反应__________(用离子方程式表示)。
(4)氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为KOH溶液,则氢氧燃料电池的负极反应式为__________。该电池工作时,外电路每流过1×103mole-,消耗标况下氧气_______m3。
9.汽车尾气中含有CO、NO、、碳氢化合物等多种污染物。回答下列问题:
(1)汽车燃料中不含氮元素,尾气中所含NO产生的原因是_________________________(用化学方程式表示)。
(2)已知:
① 若;,则表示正丁烷燃烧热的热化学方程式为__________________。
② 部分化学键键能数据为:氧分子中氧氧键的键能为;C=O的键能为;CO分子中碳氧键的键能为1076;请计算出反应的=______________,由此可以计算=__________。
(3)1573K时,平衡常数为2.0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0.2mol、0.001mol,则生成NO的物质的量为_____________mol,的转化率为____________。
(4)T<500K时,反应分两步进行:
第一步:(慢反应)
第二步:(快反应)
下列表述正确的是__________(填标号)
A.反应速率与浓度有关 B.反应速率与NO浓度有关
C.反应的中间产物只有 D.第一步反应活化能较低
评卷人
得分
三、实验题
10.工业废弃物的资源化回收再利用,可以更大限度地发挥原材料的价值。某教师在指导学生做研究性学习时,拟利用废铁屑在实验室制备溶液,再与等物质的量的反应,制备补血剂硫酸亚铁铵晶体[,相对分子质量为392]。硫酸亚铁铵晶体比一般亚铁盐稳定,在空气中不易被氧化,易溶于水,不溶于乙醇。
废铁屑的净化:将废铁屑投入10%的碳酸钠溶液中并加热5~10min,通过倾析法弃去纯碱溶液,并用蒸馏水洗净废铁屑,待用。
酸浸净化后的废铁屑:将2g Fe粉、10mL 3的溶液加入烧瓶中反应,用如图所示装置制备溶液。保持温度70~80℃,适当添加水以补充被蒸发掉的水分,并控制溶液的pH,至反应无明显气泡产生,停止加热,过滤,称量残留固体质量。
(1)① 反应过程中会产生少量等气体,需使用封闭装置。写出用溶液吸收气体的化学反应方程式:____________________________。
② 反应过程中使用过量铁粉的目的是____________________________。
(2)制备:向溶液中加入一定质量的固体,70~80℃条件下溶解后,趁热倒入50mL乙醇中,析出晶体。
实验中,需对过滤出产品的母液(pH<1)进行处理。室温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是_____ (填序号)。
A.通入过量:
B.加入过量KSCN溶液:
C.加入过量NaOH溶液:
D.加入过量NaClO和NaOH的混合溶液:
(3)产品纯度测定:称取ag产品溶于水,配制成500mL溶液,取25.00mL待测液,用浓度为c 的酸性溶液滴定。重复上述操作2次实验结果如下:
实验次数
第一次
第二次
第三次
消耗高锰酸钾溶液的体积/mL
25.52
25.02
24.98
该产品的纯度为____________________________(用含a、c的代数式表示)。
有同学提出,测定产品中的含量也可测定产品的纯度,请补充完整实验方案:称取约0.4g样品,溶于70mL水,__________________________________________________,将沉淀移入坩埚,灼烧至恒重,记录数据(实验中必须使用的试剂有:2的HCl溶液、溶液、溶液)。
评卷人
得分
四、问答题
11.钼酸钠晶体()是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的)制备钼酸钠的两种途径如图所示:
(1)中钼元素的化合价为____,NaCIO的电子式为 ___。
(2)途径I为了提高钼精矿焙烧速率,可采取的措施是____(答出两条即可)。
(3)途径I焙烧过程中化学方程式为____,碱浸时气体A的化学式为____。
(4)已知途径I的钼酸钠溶液中,。由钼酸钠溶液制备钼酸钠晶体时,需加入固体以除去。当开始沉淀时,的去除率是____(已知、,忽略溶液的体积变化)。
(5)途径II氧化时溶液中还有生成,则还原剂与氧化剂物质的量之比为_____。
(6)途径I或途径II所得的溶液经结晶可得固体A后再重结晶可得固体B,其重结晶操作的目的为____。
参考答案
1.答案:C
解析:A. 氯水中HClO光照易分解,则氯水应保存在棕色细口瓶中并置于阴凉处,故A错误;
B. pH试纸不能润湿,应选干燥的pH试纸测定,故B错误;
C. 盐酸清洗,灼烧时不会造成干扰,则先用稀盐酸洗涤铂丝并在酒精灯火焰上灼烧至无色,然后再进行实验,故C正确;
D. 容量瓶不能用待装溶液润洗,用蒸馏水洗涤后可使用,故D错误;
2.答案:A
解析:A. 常温下,浓硫酸与铝发生钝化反应,不能持续生成气体,故A错误;
B.CaO吸水,且放出热量,可生成氨气,能使湿润的红色石蕊试纸变蓝,故B正确;
C. 氯气可氧化硫酸亚铁,可观察到溶液变黄色,故C正确;
D.AgI溶度积较小,可生成AgI沉淀,故D正确。
3.答案:A
解析:A、刚好沉淀完全,与物质的量之比为1:1,离子方程式为:,正确;B、醋酸为弱酸,应用表示,错误;C、过量,应生成,错误;D、过量小苏打使中完全反应:,错误。
4.答案:D
解析:根据以上分析可知HA为弱酸,则
A、溶液中=0.01mol/L,则,该溶液中由水电离出的,A错误;
B、0.1mol/L某一元酸(HA)溶液中A元素的总物质的量为0.1mol/L,则,B错误;
C、0.1mol/L某一元酸(HA)与0.05mol/L NaOH溶液等体积混合HA管理,溶液是由等浓度的HA和NaA构成,HA浓度减小,对水的电离的抑制作用减弱,所得混合溶液中水的电离程度增大,C错误;
D、HA溶液中加入一定量NaA晶体,A-
离子浓度增大,抑制HA电离,氢离子浓度减小,则氢氧根离子浓度增大,pH增大。加水稀释会促进酸的电离,但是溶液体积增大的程度大于氢离子物质的量增大的程度,所以氢离子浓度减小,则氢氧根离子浓度增大,pH增大,D正确;答案选D。
5.答案:A
解析:
6.答案:A
解析:A、氧化钙溶于水放热,(1)中红棕色变深,说明反应向左移动,该反应放热,故A正确;
B、由于(3)中红棕色变浅,说明反应向右移动,温度降低,所以溶于水时吸收热量,故B错误;
C、由于(1)中红棕色变深,平衡向着逆向移动,气体物质的量变大,混合气的相对分子质量减小,故C错误;
D、(3)中红棕色变浅,平衡右移,气体的总物质的量减少,压强减小,故D错误;
7.答案:C
解析:A、依据原电池的构成条件,通甲烷的电极作负极,即电极a作负极,则电极b作正极,根据原电池的工作原理,阴离子由正极流向负极,即电极b流向电极a,故说法正确;B、燃料电池相当甲烷燃烧,其电极a的反应式:,故说法正确;C、内电路中没有电子通过,只有阴阳离子的移动,故说法错误;D、依据B选项的电极反应式,通过1mol ,电子转移2mol,故说法正确。
8.答案:(1)Pb;氧化;(2)减小;负;(3)PbO2+2e-++4H+=PbSO4+2H2O;(4)H2-2e-+2OH-=2H2O,(5)6
解析:(1)铅蓄电池中,根据原电池反应式中元素化合价变化知,Pb中Pb元素化合价由0价变为+2价,被氧化发生氧化反应,所以Pb作负极。
(2)铅蓄电池工作时,硫酸参加反应生成硫酸铅同时生成水,导致硫酸浓度降低、酸性减小,原电池放电时阴离子向负极移动。
(3)工作时,该铅蓄电池正极上PbO2得电子发生还原反应,电极反应为PbO2+2e-++4H+=PbSO4+2H2O。
(4)燃料与氧气燃烧的总化学方程式为2H2+O2=2H2O,电解质溶液呈碱性,负极上氢气失电子生成水,则负极的电极反应式为2H2+4OH--4e-=4H2O;该电池中正极上是氧气发生得电子的还原反应,其电极反应为O2+2H2O+4e-=4OH-,则外电路每流过1×103mol e-,消耗的氧气为1×103mol÷4=250mol,所以氧气的体积为250mol×22.4L/mol=5.6×103L=5.6m3。
9.答案:(1)
(2);-550;+196
(3);0.005%
(4)AC
解析:
10.答案:(1);避免被氧化为
(2)D
(3);加入2mol/LHCl溶液酸化,滴加溶液至沉淀完全,过滤,洗涤沉淀,直至滤液滴加溶液不出现浑浊
解析:
11.答案:(1)+6;
(2)充分粉碎钼精矿,加压增大氧气浓度,升高温度等
(3);
(4)95%
(5)1:9
(6)除去其它可溶性杂质,便于得到更纯净的钼酸钠晶体
解析: