- 2.29 MB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
试卷类型:A
高三第四轮复习质量检测
化 学 试 题
2020.6
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。保持卡面清洁,不折叠、不破损。
可能用到的相对原子质量:H 1 Li 7 C 12 O 16 Na 23 Al 27 C1 35.5 Ca 40 Ti 48
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.宋代张杲《医说》记载:每每外出,用雄黄桐子大,在火中烧烟薰脚绷、草履、领袖间,以消毒灭菌,防止疫菌通过衣物的接触而传染。下列说法错误的是
A.雄黄中硫的价态为-2价
B.古代烟熏的消毒原理与H2O2、酒精相同
C.人们佩戴的药剂香囊具有驱虫抑疫、防病保健等功效
D.生活中也可使用火、盐水消毒器具
2.化学材料不断改变着人类的生活、生产方式。下列说法错误的是
A.天宫二号空间站使用的碳纤维是一种新型有机高分子材料
B.“司烜氏,掌以夫遂(青铜凹镜),取明火于日”的“夫遂”是一种合金
C.我国自主研发的“东方超环”(人造太阳)应用的氕、氘、氚互为同位素
D.制作N95型口罩使用的熔喷布主要原料是聚丙烯,聚丙烯属于混合物
3.下列说法或表达方式中不正确的是
A.电子从激发态到基态产生的光谱是发射光谱
B.HC1O的电子式:
C.NH3、H2O、CO2分子中孤电子对数最多的是H2O
D.基态氯原子的价电子轨道表示式为
4.下列说法正确的是
A.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
B.做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸。如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加
C.在未知液中滴加BaCl2溶液产生白色沉淀,滴加稀硝酸,沉淀不溶解,说明该未知液中存在或
D.提纯混有少量硝酸钾的氯化钠,可采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法
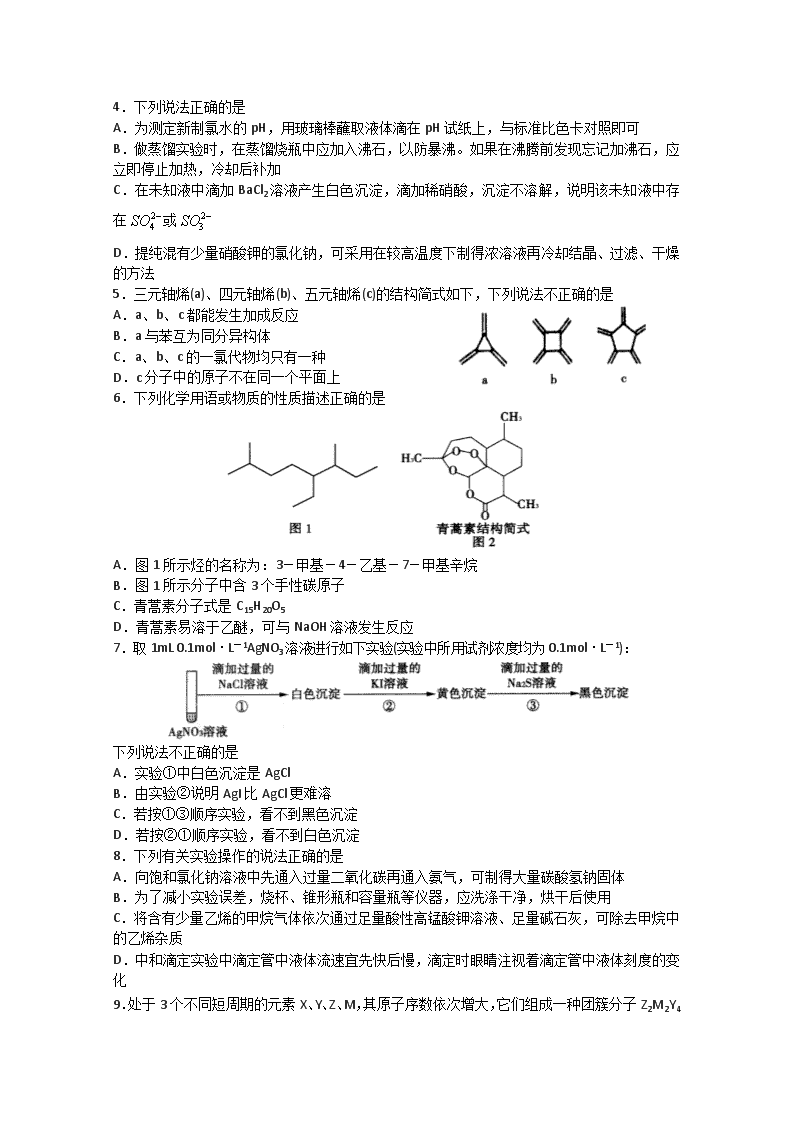
5.三元轴烯(a)、四元轴烯(b)、五元轴烯(c)的结构简式如下,下列说法不正确的是
A.a、b、c都能发生加成反应
B.a与苯互为同分异构体
C.a、b、c的一氯代物均只有一种
D.c分子中的原子不在同一个平面上
6.下列化学用语或物质的性质描述正确的是
A.图1所示烃的名称为:3-甲基-4-乙基-7-甲基辛烷
B.图1所示分子中含3个手性碳原子
C.青蒿素分子式是C15H20O5
D.青蒿素易溶于乙醚,可与NaOH溶液发生反应
7.取1mL 0.1mol·L-1AgNO3溶液进行如下实验(实验中所用试剂浓度均为0.1mol·L-1):
下列说法不正确的是
A.实验①中白色沉淀是AgCl
B.由实验②说明AgI比AgCl更难溶
C.若按①③顺序实验,看不到黑色沉淀
D.若按②①顺序实验,看不到白色沉淀
8.下列有关实验操作的说法正确的是
A.向饱和氯化钠溶液中先通入过量二氧化碳再通入氨气,可制得大量碳酸氢钠固体
B.为了减小实验误差,烧杯、锥形瓶和容量瓶等仪器,应洗涤干净,烘干后使用
C.将含有少量乙烯的甲烷气体依次通过足量酸性高锰酸钾溶液、足量碱石灰,可除去甲烷中的乙烯杂质
D.中和滴定实验中滴定管中液体流速宜先快后慢,滴定时眼睛注视着滴定管中液体刻度的变化
9.处于3个不同短周期的元素X、Y、Z、M,其原子序数依次增大,它们组成一种团簇分子Z2M2Y4
(YX)2。X、M的族序数均等于周期序数,Y原子核外最外层电子数是其电子总数的3/4,下列说法正确的是
A.元素形成的简单离子半径:Z>M>Y
B.常温下Z和M的单质均能溶于浓硝酸
C.X与Y结合形成的化合物是离子化合物
D.工业上常用电解熔融的Z的氯化物来制取Z单质
10.科研人员通过实验和计算机模拟HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成
CO2、H2O的反应历程示意图如下(图中只画出了HAP的部分结构)。下列说法不正确的是
A.HAP能提高HCHO与O2的反应速率
B.HCHO在反应过程中,有C—H键发生断裂
C.根据图示信息,CO2分子中的氧原子全部来自O2
D.该反应可表示为:
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
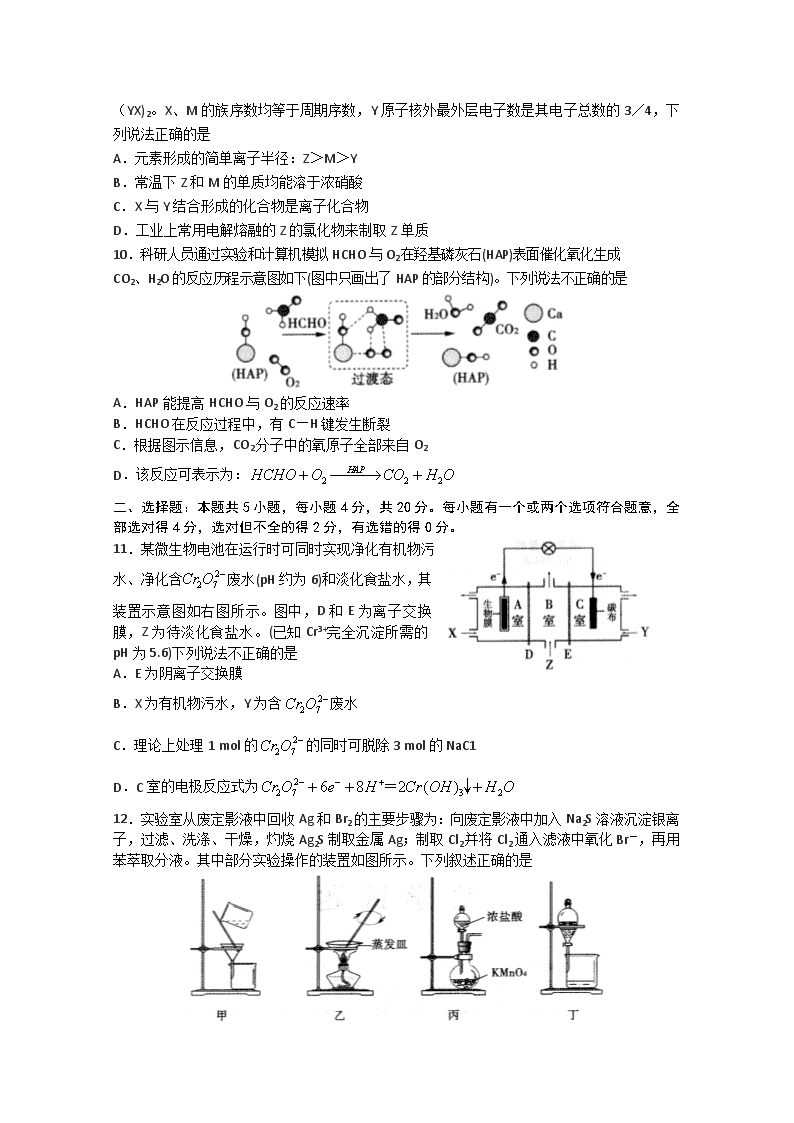
11.某微生物电池在运行时可同时实现净化有机物污水、净化含废水(pH约为6)和淡化食盐水,其装置示意图如右图所示。图中,D和E为离子交换膜,Z为待淡化食盐水。(已知Cr3+完全沉淀所需的pH为5.6)下列说法不正确的是
A.E为阴离子交换膜
B.X为有机物污水,Y为含废水
C.理论上处理1 mol的的同时可脱除3 mol的NaC1
D.C室的电极反应式为
12.实验室从废定影液中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉淀银离子,过滤、洗涤、干燥,灼烧Ag2S制取金属Ag;制取Cl2并将Cl2通入滤液中氧化Br-,再用苯萃取分液。其中部分实验操作的装置如图所示。下列叙述正确的是
A.用装置甲分离Ag2S时,用玻璃棒不断搅拌
B.用装置乙在通风橱中高温灼烧Ag2S制取Ag
C.用装置丙制备Cl2,其中KMnO4也可用MnO2代替
D.用装置丁分液时,打开分液漏斗活塞,再打开旋塞,使下层液体从分液漏斗下端放出,待两液界面与旋塞上口相切即可关闭旋塞
13.利用废铁屑(含有C、S、P等杂质)制取高效净水剂K2FeO4的流程如图所示。下列说法不正确的是
A.废铁屑在酸溶前可用热的纯碱溶液去油污
B.步骤②是将Fe2+转化为Fe(OH)3
C.步骤③中发生反应的离子方程式为:2Fe(OH)3+3ClO-=+3Cl-+H2O+4H+
D.步骤④说明在相同条件下,K2FeO4的溶解度小于Na2FeO4
14.T℃时,三种盐的沉淀溶解平衡曲线如图所示,已知pM为阳离子浓度的负对数,pR为阴离子浓度的负对数,下列说法正确的是
A.Y点:c(Ca2+)<c(),Z点:c()<c(Mn2+)
B.溶度积:Ksp(MnCO3)>Ksp(CaCO3)>Ksp(CaSO4)
C.X点对应的CaCO3溶液为不饱和溶液,可以继续溶解CaCO3
D.T℃时,
的平衡常数K的数量级为103
15.25℃时,向10 mL 0.01mol·L-1NaCN溶液中逐滴加入0.01mol mol·L-1的盐酸,溶液中CN-、HCN物质的量分数(δ)随pH变化的关系如图甲所示,其中a点的坐标为(9.5,0.5)。溶液的pH变化曲线如图乙所示。下列溶液中的关系中正确的是
A.图甲中pH=7的溶液:c(Cl-)<c(HCN)
B.常温下,NaCN的水解平衡常数:Kh(NaCN)=10-4.5mol·L-1
C.图乙中b点的溶液:c(HCN)>c(Cl-)>c(CN-)>c(OH-)>c(H+)
D.图乙中c点的溶液:c(Na+)+c(H+)=c(HCN)+c(OH-)+c(CN-)
三、非选择题:本题共5小题,共60分。
16.(12分)(1)以甲醇为原料制取高纯H2具有重要的应用价值。甲醇水蒸气重整制氢主要发生以下两个反应:
主反应:
副反应:
①甲醇蒸气在催化剂作用下裂解可得到H2和CO,则该反应的热化学方程式为__________
_______,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是______________。
②分析适当增大水醇比n(H2O)/n(CH3OH)对甲醇水蒸气重整制氢的好处是__________。
③某温度下,将n(H2O):n(CH3OH)=1:1的原料气充入恒容密闭容器中,初始压强为P1,反应达平衡时总压强为P2,则平衡时甲醇的转化率为________________(忽略副反应,用含P1、P2的式子表示)。
(2)工业上用CH4与水蒸气在一定条件下制取H2,原理为:
①该反应逆反应速率表达式为:v逆=k·c(CO)·c3(H2),k为速率常数,在某温度下测得实验数据如下表:
c(CO)/mol·L-1
c(H2)/mol·L-1
v逆/mol·L-1·min-1
0.05
c1
4.8
c2
c1
19.2
c2
0.15
8.1
由上述数据可得该温度下,该反应的逆反应速率常数k为_________L3·mol-3·min-1。
②在体积为3L的密闭容器中通入物质的量均为3mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度关系如图所示:N点v正____________M点v逆(填“大于”或“小于”);Q点对应温度下该反应的平衡常数K=_______________mol2·L-2。平衡后再向容器中加入1molCH4和1molCO,平衡向_____________方向移动(填“正反应”或“逆反应”)。
17.(13分)探究NaHSO3溶液分别与CuCl2、CuSO4溶液的反应。
已知:①(深蓝色溶液)
②
回答下列问题:
(1)实验Ⅰ产生的无色气体为SO2。用蘸有碘水的淀粉试纸接近试管口,观察到__________
_______________,反应的离子方程式为______________________。
(2)对实验Ⅰ产生SO2的原因进行分析,提出两种假设:
①Cu2+水解使溶液中c(H+)增大;
②Cl-存在时,Cu2+与反应生成CuCl白色沉淀,溶液中c(H+)增大。
实验证明,①不合理,实验证据是____________________;②合理,实验Ⅰ反应的离子方程式有_________________________、H++=SO2↑+H2O。
(3)通过分析实验Ⅰ、Ⅱ,可知:Cl-增强了Cu2+的氧化性。
下述实验证实了此结论。实验方案:闭合K,电压表的指针偏转至“x”处;向U形管_____
_________________(补全实验操作及现象)。装置中,盐桥的作用是____________________
__________________________________________(答出两条即可)。
(4)将实验Ⅱ的溶液静置24小时或加热后,得到红色沉淀。经检验,红色沉淀中含有Cu+、Cu2+和。设计实验,证明红色沉淀中含有Cu+________________________________。
18.(12分)磷能形成多种单质或化合物。回答下列问题:
(1)白磷(P4)在氯气中燃烧产生大量白色烟雾,生成PCl3和PCl5。
①P4化学性质比N2活泼的主要原因是___________________________。
②形成PCl5时,P原子的一个3s电子激发到3d轨道后参与成键。写出该激发态原子的外围电子轨道表示式___________________________________。
③PCl5是一种白色固体,加压下于148℃液化,形成离子导体,其中阳离子为正四面体结构,阴离子为正八面体结构,该离子导体能导电的原因是____________________________
_______________________________________(用电离方程式解释)。
(2)新型半导体材料 黑磷,是一种二维材料(结构如下图甲所示),其单层的结构如下图乙所示。
①黑磷中P原子的杂化方式为_____________________________。
②用4-甲氧基重氮苯四氟硼酸盐(如上图丙所示)处理黑磷纳米材料,可以保护和控制其性质。该盐的构成元素中N、O、F的电负性由大到小顺序为__________________,1mol该盐的阳离子含有的σ键的数目为____________(阿伏加德罗常数的值用NA表示,下同)。
(3)中国科学院深圳先进技术研究院在钙钛矿/黑磷纳米复合材料的研究领域取得新进展,该材料表现出优异的光电应用潜力。如图所示为高温超导领域里的一种化合物 钙钛
矿晶胞结构。若图中正方体边长为a nm,则该晶体的密度
为____________g·cm-3。
19.(11分)SAH(NaAlH4)还原性非常强。纯的四氢铝钠是白色晶状固体,在干燥空气中相对稳定,遇水发生剧烈反应。以铝合金废边脚料为原料(含有少量Al2O3、Fe2O3、MgO、PbO和SiO2等杂质)制备四氢铝钠:
请回答下列问题:
(1)滤渣1的主要成分为__________________(填化学式)。试剂A中溶质的阴、阳离子所含电子数相等,其电子式为_________________________。
(2)已知废料接触面积、接触时间均相同,“酸浸”中铝元素浸出率与硫酸浓度的关系如图甲所示。当硫酸浓度大于C0 mol·L-1时,浸出率降低的原因可能是__________________。
(3)滤液3可以循环利用,写出滤液2与滤液3反应的离子方程式____________________________________。
(4)NaAlH4与水反应的化学方程式为____________________。
(5)测定NaAlH4粗产品的纯度。
称取m g NaAlH4粗产品按如图乙所示装置进行实验,测定产品的纯度。
①“安全漏斗”中“安全”的含义是____________________。
②已知实验前C管读数为V1mL,向A中加入适量蒸馏水使NaAlH4完全反应,当A中反应完全后,冷却至室温后C管读数为V2mL(均折合成标准状况)。则该产品的纯度为____________________(用含m、V1和V2的代数式表示,忽略加入蒸馏水的体积)。
③若实验前读数时B中液面和C管液面相平,实验后读数时B中液面低于C管,则测得的结果_____________(填“偏高”“偏低”或“无影响”)。
20.(12分)一种防止血栓形成与发展的药物J的合成路线如图所示(部分反应条件略去):
回答下列问题:
(1)A中官能团的名称是________________,反应⑤的反应类型是_________________。
(2)J的分子式是_______________。F的结构简式是________________________。
(3)反应③的化学方程式为_______________________________________________。
(4)已知C有多种同分异构体。写出同时满足下列条件的C的同分异构体的结构简式________________________(只需写出两个):
①苯环上有两个处于对位上的取代基;②1mol该有机物与足量金属钠反应生成1g氢气。
(5)请参照J的合成方法,写出以为原料制备的合成路线:
高三第四轮复习质量检测
化学试题(A)参考答案及评分标准 2020.6
说明:1.每小题若有其它正确答案,可参照评分标准给分。
2.化学专用名词中出现错别字、元素符号有错误,都要参照评分标准扣分。
3.化学方程式、离子方程式未配平的,都不给分。
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.B 2.A 3.B 4.B 5.D 6.D 7.C 8.C 9.D 10.C
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.AC 12.D l3.C 14.AD 15.BC
三、非选择题:本题共5小题,共60分。
16.(12分)
(1)① =+90 kJ·mol-1(2分) 升温(1分)
②提高甲醇的利用率,有利于抑制CO的生成或抑制副反应发生(2分)
③(2分)
(2)①1.2×104(2分)
②小于(1分) 48(1分) 正反应(1分)
17.(13分)
(1)蓝色褪去(1分) SO2+I2+2H2O=+2I-+4H+(2分)
(2)实验Ⅰ、Ⅱ中c(Cu2+)相同,但实验Ⅱ中未见气泡(2分)
2Cu2++2Cl-++H2O=2CUCl++3H+(2分)
(3)右侧加入一定量NaCl固体,溶解后,观察到电压表指针偏转变大(2分)
隔离两极区电解质溶液;使离子定向移动,构成闭合回路;平衡两极区电荷(答出2条,2分)
(4)取洗净的红色固体于试管中,滴加足量浓氨水,沉淀溶解,得到浅蓝色溶液,露置在空气中一段时间后溶液变为深蓝色(2分)
l8.(12分)
(1)①P4分子中存在P—P单键,而N2分子中存在N≡N键,键能较大,化学性质比较稳定(1分)
②(2分)
③2PCl5= (2分)
(2)①sp3(1分) ②F>O>N(2分) 17NA(2分)
(3) (2分)
19.(11分)
(1)SiO2、PbSO4(1分) (1分)
(2)硫酸浓度增大,铝片与硫酸发生钝化(1分)
(3) (或)
(2分)
(4)NaAlH4+4H2O=Na[Al(OH)4]+4H2↑(或NaAIH4+2H2O=4H2↑+NaAlO2)(2分)
(5)①加入液体能起液封作用,避免气体从漏斗中逸出(1分)
② (2分) ③偏低(1分)
20.(12分)
(1)羟基(酚羟基)(1分) 消去反应(1分)
(2)C19H16O4(1分) (1分)
(3)2分)
(4)(2分)
(5)(4分)