- 281.00 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
题型一 化学反应原理综合题
1.(2019·泰州四校高三联考)燃煤的过程中排放大量CO2、SO2、NOx以及固体颗粒物,对环境污染严重。请回答下列问题:
(1)将煤作为燃料常通过下列两种途径:
途径Ⅰ:C(s)+O2(g)===CO2(g) ΔH1<0 ①
途径Ⅱ:先制水煤气,后燃烧水煤气
C(s)+H2O(g)CO(g)+H2(g) ΔH2>0 ②
2CO(g)+O2(g)===2CO2(g) ΔH3<0 ③
2H2(g)+O2(g)===2H2O(g) ΔH4<0 ④
ΔH1、ΔH2、ΔH3、ΔH4的关系式是___________________________________________。
(2)已知碳的气化反应在不同温度下平衡常数的对数值(lg K)如表:
气化反应
lg K
700 K
900 K
1 200 K
C(s)+H2O(g)CO(g)+H2(g) i
-2.64
-0.39
1.58
C(s)+2H2O(g)CO2(g)+2H2(g) ii
-1.67
-0.03
1.44
升高温度时,反应i中H2的产率________(填“增大”“减小”或“不变”)。在900 K时,反应CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数的对数值(lg K)为__________。
(3)为了减少燃煤污染,可将煤燃烧产生的SO2制成自发电池,其电池总反应为2SO2+O2+2H2O===2H2SO4,该电池的负极反应式为____________________________________。
用这种方法处理含SO2废气的优点是________________________________________。
(4)新型氨法烟气脱硫技术采用氨吸收烟气中的SO2生成亚硫酸铵和亚硫酸氢铵。亚硫酸铵又可用于燃煤烟道气脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式:_____________________________________。
(5)用K2CO3溶液可吸收燃煤反应中生成的CO2,常温下pH=10的K2CO3溶液中由水电离的OH-的物质的量浓度为______________。常温下,0.1 mol·L-1KHCO3溶液的pH>8,则溶液中c(H2CO3)________(填“>”“=”或“<”)c(CO)。
解析:(1)根据盖斯定律,由(②×2+③+④)/2可得①,则2ΔH1=2ΔH2+ΔH3+ΔH4。(2)依题表中数据可知,温度升高时,反应i的lg K增大,平衡正向移动,反应i中H2
- 8 -
的产率增大。根据盖斯定律,由反应ii-反应i得CO(g)+H2O(g)CO2(g)+H2(g),900 K时,此反应的平衡常数K==100.36,则lg K=0.36。(3)2SO2+O2+2H2O===2H2SO4,在此反应中,SO2被氧化生成H2SO4,通入SO2的一极是负极,负极的电极反应式为SO2+2H2O-2e-===SO+4H+。(4)NO2与(NH4)2SO3反应时,NO2是氧化剂,还原产物是N2;(NH4)2SO3是还原剂,氧化产物是(NH4)2SO4。(5)常温下pH=10的K2CO3溶液中,c(H+)=1×10-10mol·L-1,c(OH-)=1×10-4mol·L-1,K2CO3溶液中的OH-就是由水电离产生的。KHCO3溶液显碱性,说明HCO的水解能力大于其电离能力,故c(H2CO3)>c(CO)。
答案:(1)2ΔH1=2ΔH2+ΔH3+ΔH4
(2)增大 0.36
(3)SO2+2H2O-2e-===SO+4H+ 减少环境污染,获得副产品H2SO4,获得电能
(4)4(NH4)2SO3+2NO2===4(NH4)2SO4+N2
(5)1×10-4mol·L-1 >
2.(2019·连云港高三质检)“绿水青山就是金山银山”。近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:
(1)已知:N2(g)+O2(g)===2NO(g) ΔH1=+180.5 kJ·mol-1
C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH3=-221 kJ·mol-1
若某反应的平衡常数表达式为K=,则此反应的热化学方程式为________________________________________________________________________。
(2)N2O5在一定条件下可发生分解反应:2N2O5(g)4NO2(g)+O2(g),某温度下向恒容密闭容器中加入一定量N2O5,测得N2O5浓度随时间的变化如下表:
t/min
0
1
2
3
4
5
c(N2O5)/(mol·L-1)
1.00
0.71
0.50
0.35
0.25
0.17
①反应开始时体系压强为p0,第2 min时体系压强为p1,则p1∶p0=________。2~5 min内用NO2表示的该反应的平均反应速率为________________。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是________________(填字母)。
a.NO2和O2的浓度比保持不变
- 8 -
b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5)
d.气体的密度保持不变
(3)Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为________________(用k正、k逆表示)。
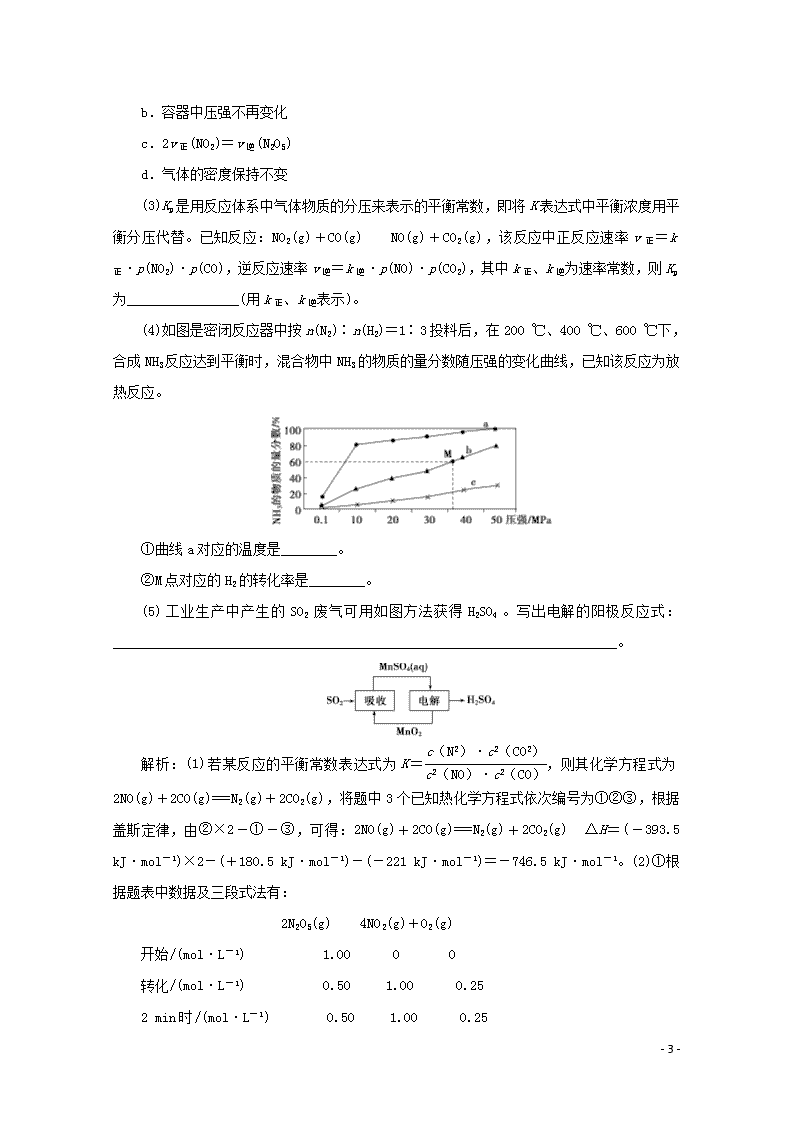
(4)如图是密闭反应器中按n(N2)∶n(H2)=1∶3投料后,在200 ℃、400 ℃、600 ℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。
①曲线a对应的温度是________。
②M点对应的H2的转化率是________。
(5)工业生产中产生的SO2废气可用如图方法获得H2SO4。写出电解的阳极反应式:________________________________________________________________________。
解析:(1)若某反应的平衡常数表达式为K=,则其化学方程式为2NO(g)+2CO(g)===N2(g)+2CO2(g),将题中3个已知热化学方程式依次编号为①②③,根据盖斯定律,由②×2-①-③,可得:2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=(-393.5 kJ·mol-1)×2-(+180.5 kJ·mol-1)-(-221 kJ·mol-1)=-746.5 kJ·mol-1。(2)①根据题表中数据及三段式法有:
2N2O5(g)4NO2(g)+O2(g)
开始/(mol·L-1) 1.00 0 0
转化/(mol·L-1) 0.50 1.00 0.25
2 min时/(mol·L-1) 0.50 1.00 0.25
- 8 -
该反应在恒温恒容条件下发生,反应前后气体的压强之比等于物质的量之比,也等于物质的量浓度之比,所以p1∶p0=(0.50+1.00+0.25)∶1.00=7∶4。2~5 min内,v(N2O5)==0.11 mol·L-1·min-1,v(NO2)=2v(N2O5)=0.22 mol·L-1·min-1。②反应过程中NO2和O2的浓度比始终保持不变,a项不能说明反应已经达到化学平衡状态;该反应在反应前后气体分子数不相等,反应过程中容器内压强为变量,容器内压强不再变化可以说明反应已经达到化学平衡状态,b项符合题意;v正(NO2)=2v逆(N2O5)时,正、逆反应速率相等,而2v正(NO2)=v逆(N2O5)时,正、逆反应速率不相等,c项不能说明反应已经达到化学平衡状态;反应物和生成物全为气体,气体总质量不变,而容器恒容,故反应过程中气体密度始终不变,d项不能说明反应已经达到化学平衡状态。(3)Kp=,v正=k正·p(NO2)·p(CO),v逆=k逆·p(NO)·p(CO2),平衡时正、逆反应速率相等,即k正·p(NO2)·p(CO)=k逆·p(NO)·p(CO2),则=,故Kp=。(4)①合成氨反应为放热反应,升高温度,平衡向逆反应方向移动,NH3的产率降低,NH3的物质的量分数减小,曲线a、b、c中,在相同条件下曲线a对应NH3的物质的量分数最高,其反应温度最低,所以曲线a对应的温度为200 ℃。②M点NH3的物质的量分数为60%,设NH3为0.6a mol,则N2、H2共为0.4a mol,因为反应器中按n(N2)∶n(H2)=1∶3投料,故M点时H2为0.3a mol,结合N2(g)+3H2(g)2NH3(g)可知,转化的H2的物质的量为0.9a mol,所以M点对应H2的转化率为×100%=75%。(5)由题图可知,在电解池的阳极发生Mn2+转化为MnO2的反应,电极反应式为Mn2++2H2O-2e-===MnO2↓+4H+。
答案:(1)2NO(g)+2CO(g)===N2(g)+2CO2(g) ΔH=-746.5 kJ·mol-1
(2)①7∶4 0.22 mol·L-1·min-1 ②b
(3)
(4)①200 ℃ ②75%
(5)Mn2++2H2O-2e-===MnO2↓+4H+
3.对温室气体二氧化碳的研究一直是科技界关注的重点。
Ⅰ.在催化剂存在下用H2还原CO2是解决温室效应的重要手段之一,相关反应如下:
主反应:CO2(g)+4H2(g)===CH4(g)+2H2O(g) ΔH1
副反应:CO2(g)+H2(g)===CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
已知H2和CH4的燃烧热分别为-285.5 kJ·mol-1和-890.0 kJ·mol-1
- 8 -
H2O(l)===H2O(g) ΔH=+44 kJ·mol-1
(1)ΔH1=________kJ·mol-1。
(2)有利于提高CH4平衡产率的反应条件是___________________________________
_____________________________________________________________(至少写两条)。
工业上提高甲烷反应选择性的关键因素是__________。
(3)T ℃时,若在体积恒为2 L的密闭容器中同时发生上述反应,将物质的量之和为5 mol的H2和CO2以不同的投料比进行反应,结果如图1所示。若a、b表示反应物的转化率,则表示H2转化率的是________,c、d分别表示CH4(g)和CO(g)的体积分数,由图可知=________时,甲烷产率最高。若该条件CO的产率趋于0,则T ℃时①的平衡常数K=________。
Ⅱ.溶于海水的CO2 95%以HCO形式存在。在海洋中,通过如图2钙化作用实现碳自净。
(4)写出钙化作用的离子方程式:_______________________________________________。
(5)如图3,电解完成后,a室的pH________(填“变大”“变小”或“几乎不变”);其间b室发生反应的离子方程式为__________________________________________________。
解析:Ⅰ.(1)根据已知有②CO2(g)+H2(g)===CO(g)+H2O(g) ΔH2=+41.2 kJ·mol-1
③2H2(g)+O2(g)===2H2O(l) ΔH3=-571.0 kJ·mol-1
④CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH4=-890.0 kJ·mol-1
⑤H2O(l)===H2O(g) ΔH5=+44 kJ·mol-1
根据盖斯定律,由③×2-④+⑤×2可得CO2(g)+4H2(g)===CH4(g)+2H2O(g) ΔH1=2ΔH3-ΔH4+2ΔH5=-164.0 kJ·mol-1。
(2)反应CO2(g)+4H2(g)===CH4(g)+2H2O(g)是正方向为气体体积减小的放热反应,
- 8 -
降低温度和增大压强都有利于反应正向移动,提高CH4平衡产率;工业上提高甲烷反应选择性的关键因素是催化剂。
(3)随着比值的增大,氢气的转化率降低,则表示H2转化率的是b。随着比值的增大,氢气的量增多,一氧化碳的量减少,甲烷的量增加,故c为CH4(g)的体积分数,由图可知=4时,甲烷的产量最高。若该条件下CO的产率趋于0,=4,由于H2、CO2的物质的量之和为5 mol,则H2和CO2分别为4 mol和1 mol,平衡转化率为0.80,则利用三段式法:
CO2(g)+4H2(g)===CH4(g)+2H2O(g)
开始时浓度
/(mol·L-1) 0.5 2 0 0
改变的浓度
/(mol·L-1) 0.4 1.6 0.4 0.8
平衡时浓度
/(mol·L-1) 0.1 0.4 0.4 0.8
K==100。
Ⅱ.(4)根据图中信息可知,钙化作用是碳酸氢钙转化为碳酸钙、二氧化碳和水,其反应的离子方程式为2HCO+Ca2+===CaCO3↓+CO2↑+H2O。
(5)电解完成后,a室中水放电产生氧气,而氢离子进入b室,pH几乎不变;其间b室发生反应的离子方程式为H++HCO===CO2↑+H2O。
答案:Ⅰ.(1)-164.0 (2)降低温度,增大压强 催化剂
(3)b 4 100 Ⅱ.(4)2HCO+Ca2+===CaCO3↓+CO2↑+H2O (5)几乎不变 H++HCO===CO2↑+H2O
4.甲醇既是重要的化工原料,又是一种可再生能源,具有广泛地开发和应用前景。
(1)已知反应CO(g)+2H2(g)CH3OH(g) ΔH=-99 kJ·mol-1 中的相关化学键键能如下:
化学键
H—H
C—O
C≡O
H—O
C—H
E/(kJ·mol-1)
436
343
x
465
413
则x=________。
- 8 -
(2)在一容积可变的密闭容器中,1 mol CO与2 mol H2发生反应:CO(g)+2H2(g)CH3OH(g) ΔH<0,CO在不同温度下的平衡转化率(α)与压强的关系如图所示。
①a、b两点的反应速率:v(a)________(填“>”“<”或“=”)v(b)。
②T1________(填“>”“<”或“=”)T2,原因是_____________________________________
________________________________________________________________________。
③在c点条件下,下列叙述能说明上述反应达到化学平衡状态的是________(填字母)。
A.H2的消耗速率是CH3OH生成速率的2倍
B.CH3OH的体积分数不再改变
C.混合气体的密度不再改变
D.CO和CH3OH的物质的量之和保持不变
④计算图中a点的平衡常数Kp=__________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
Ⅰ:CO(g)+2H2(g)CH3OH(g) ΔH1
Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g) ΔH2
Ⅲ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图所示。
则ΔH1________(填“>”“<”或“=”)ΔH3,理由是______________________________
________________________________________________________________________。
解析:(1)根据反应CO(g)+2H2(g)CH3OH(g) ΔH=-99 kJ·mol-1及表中数据可知,
- 8 -
反应断键吸收的能量为(x+2×436) kJ,成键放出的能量为(3×413+465+343) kJ=2 047 kJ,反应放出99 kJ的热量,则2 047-(x+2×436)=99,x=1 076。(2)①a、b两点处在同一条等温线上,a点的压强小于b点的压强,由于增大压强,化学反应速率增大,则反应速率v(a)0,根据盖斯定律可得ΔH3=ΔH1+ΔH2,所以ΔH1<ΔH3
- 8 -
相关文档
- 2020届二轮复习第28题 化学反应原2021-08-2311页
- 高中化学《化学反应原理》4_1原电2021-08-235页
- 2020届高考化学二轮复习化学反应原2021-08-23112页
- 高中化学《化学反应原理》3_1弱电2021-08-235页
- 高中化学《化学反应原理》2_3化学2021-08-2311页
- 江苏省2020高考化学二轮复习专题题2021-08-238页
- 2020届高考化学二轮复习专题二十二2021-08-2314页
- 高中化学《化学反应原理》2_4化学2021-08-232页
- 2020高考化学考前微专题突破练十化2021-08-0616页
- 江苏省2020高考化学二轮复习题型一2021-08-0691页