- 481.50 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学实验仪器和基本操作
一、选择题(本题包括4小题,每题8分,共32分)
1.(双选)下列有关实验原理或操作正确的是 ( )
A.用20 mL量筒量取15 mL酒精,加水5 mL,配制质量分数为75%的酒精溶液
B.用向下排空气法收集氨气
C.从海带中提取碘应在坩埚中灼烧海带并用玻璃棒搅拌
D.实验室配制500 mL 0.2 mol·L-1的硫酸亚铁溶液,其操作是用天平称15.2 g绿矾(FeSO4·7H2O),放入小烧杯中加水溶解,转移到500 mL容量瓶中,洗涤、稀释、定容、摇匀
【解析】选B、C。量筒不能用来配制溶液,A错误;氨气密度小于空气,可以用向下排空气法收集氨气,B正确;灼烧海带应使用坩埚,C正确;溶解需要冷却到室温再转移到容量瓶中,D错误。
2.(2020年山东等级考模拟)下列操作能达到相应实验目的的是 ( )
实验目的
操作
A
检验绿茶中是否含有酚类物质
向茶水中滴加FeCl3溶液
B
测定“84”消毒液的pH
用洁净的玻璃棒蘸取少许“84”消毒液滴在pH试纸上
C
除去苯中混有的少量苯酚
向苯和苯酚的混合物中滴加溴水,过滤后分液
D
实验室制备乙酸乙酯
向试管中依次加入浓硫酸、乙醇、乙酸和碎瓷片,加热
【解析】选A。A选项,酚羟基遇Fe3+发生显色反应。B选项,“84”消毒液的主要成分是次氯酸钠,是一种强碱弱酸盐,水解显碱性,但水解产物具有漂白性,对pH 试纸有漂白作用,可以使用数字pH计测量。C选项,溴水与苯酚生成的三溴苯酚也可溶于苯中,一般加入氢氧化钠溶液再进行分液。D选项,正确顺序为依次加入碎瓷片、乙醇、浓硫酸、乙酸,再加热。
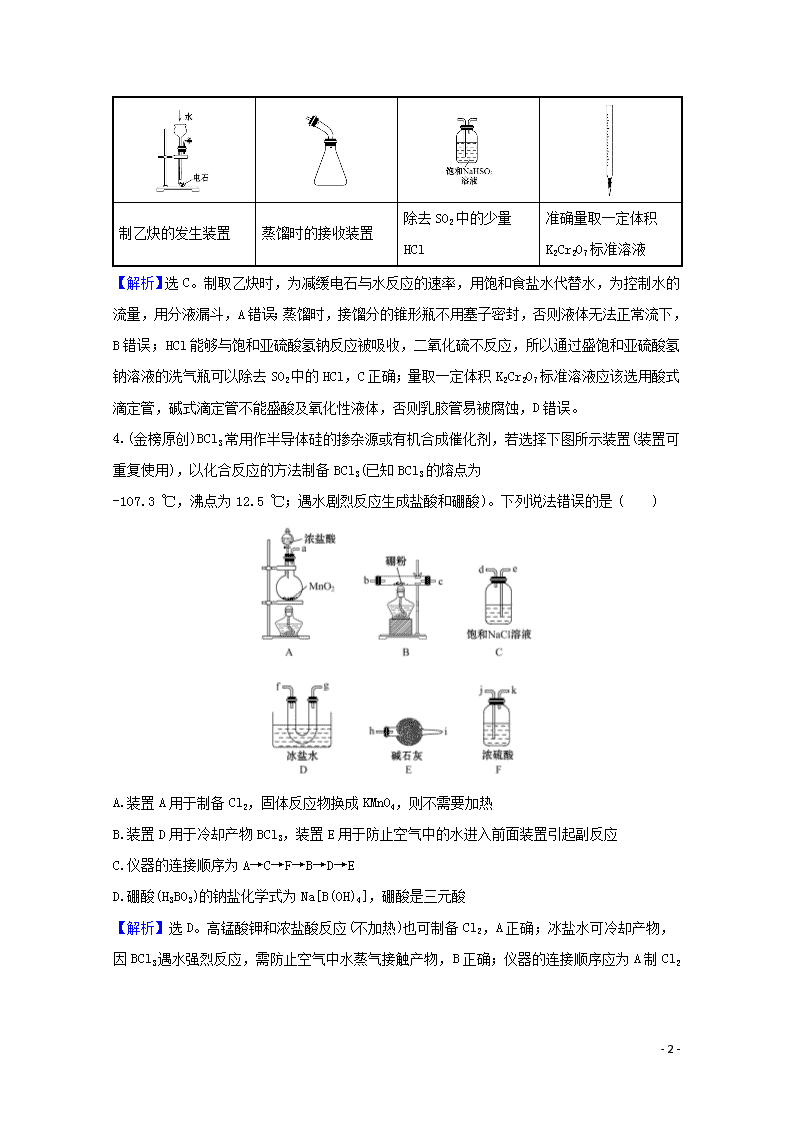
3.(2020·漳州模拟)下列选用的仪器和药品能达到实验目的的是 ( )
A
B
C
D
- 9 -
制乙炔的发生装置
蒸馏时的接收装置
除去SO2中的少量HCl
准确量取一定体积K2Cr2O7标准溶液
【解析】选C。制取乙炔时,为减缓电石与水反应的速率,用饱和食盐水代替水,为控制水的流量,用分液漏斗,A错误;蒸馏时,接馏分的锥形瓶不用塞子密封,否则液体无法正常流下,B错误;HCl能够与饱和亚硫酸氢钠反应被吸收,二氧化硫不反应,所以通过盛饱和亚硫酸氢钠溶液的洗气瓶可以除去SO2中的HCl,C正确;量取一定体积K2Cr2O7标准溶液应该选用酸式滴定管,碱式滴定管不能盛酸及氧化性液体,否则乳胶管易被腐蚀,D错误。
4.(金榜原创)BCl3常用作半导体硅的掺杂源或有机合成催化剂,若选择下图所示装置(装置可重复使用),以化合反应的方法制备BCl3(已知BCl3的熔点为
-107.3 ℃,沸点为12.5 ℃;遇水剧烈反应生成盐酸和硼酸)。下列说法错误的是 ( )
A.装置A用于制备Cl2,固体反应物换成KMnO4,则不需要加热
B.装置D用于冷却产物BCl3,装置E用于防止空气中的水进入前面装置引起副反应
C.仪器的连接顺序为A→C→F→B→D→E
D.硼酸(H3BO3)的钠盐化学式为Na[B(OH)4],硼酸是三元酸
【解析】选D。高锰酸钾和浓盐酸反应(不加热)也可制备Cl2,A正确;冰盐水可冷却产物,因BCl3遇水强烈反应,需防止空气中水蒸气接触产物,B正确;仪器的连接顺序应为A制Cl2
- 9 -
→C除HCl→F干燥→B反应→D冷却并收集产物→E防止空气中成分干扰,C正确;硼酸的电离方程式为H3BO3+H2O [B(OH)4]- +H+,硼酸是一元酸,D错误。
二、非选择题(本题包括1小题,共18分)
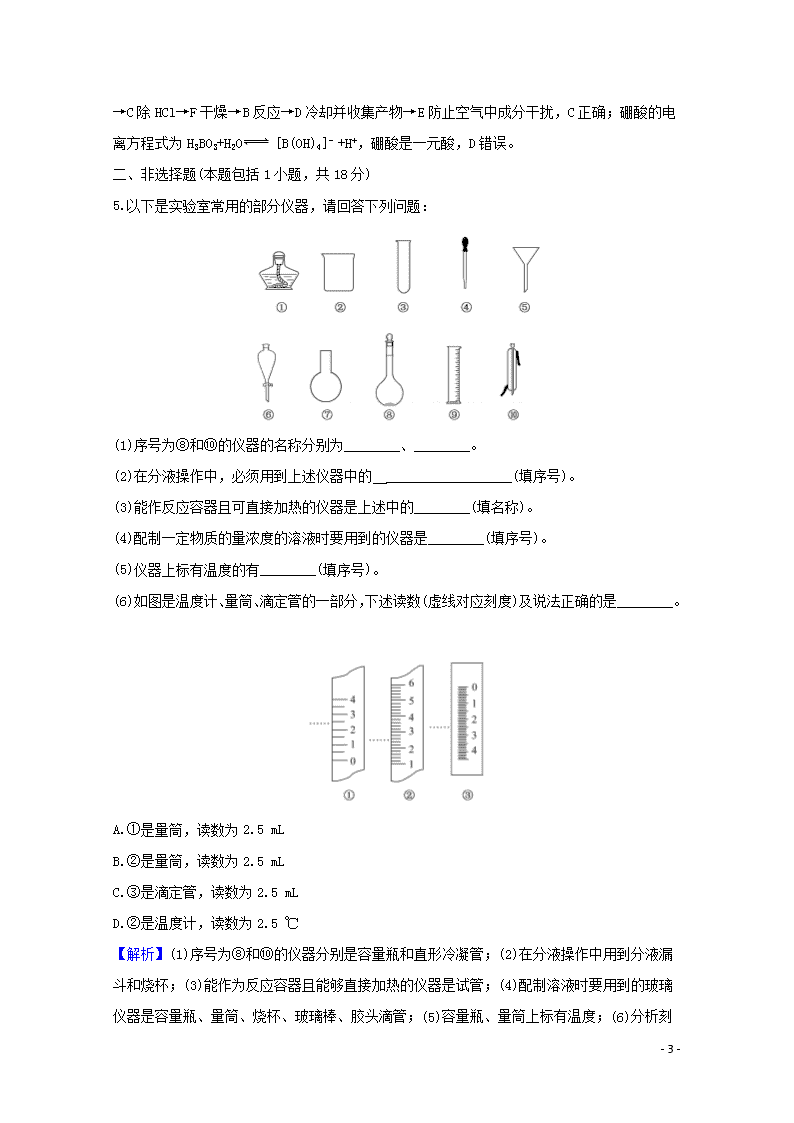
5.以下是实验室常用的部分仪器,请回答下列问题:
(1)序号为⑧和⑩的仪器的名称分别为________、________。
(2)在分液操作中,必须用到上述仪器中的 __________________(填序号)。
(3)能作反应容器且可直接加热的仪器是上述中的________(填名称)。
(4)配制一定物质的量浓度的溶液时要用到的仪器是________(填序号)。
(5)仪器上标有温度的有________(填序号)。
(6)如图是温度计、量筒、滴定管的一部分,下述读数(虚线对应刻度)及说法正确的是________。
A.①是量筒,读数为2.5 mL
B.②是量筒,读数为2.5 mL
C.③是滴定管,读数为2.5 mL
D.②是温度计,读数为2.5 ℃
【解析】(1)序号为⑧和⑩的仪器分别是容量瓶和直形冷凝管;(2)在分液操作中用到分液漏斗和烧杯;(3)能作为反应容器且能够直接加热的仪器是试管;(4)配制溶液时要用到的玻璃仪器是容量瓶、量筒、烧杯、玻璃棒、胶头滴管;(5)容量瓶、量筒上标有温度;(6)
- 9 -
分析刻度可知①是温度计,②是量筒,读数精确到小数点后一位,③是滴定管,读数精确到小数点后两位,只有B合理。
答案:(1)容量瓶 直形冷凝管 (2)②⑥
(3)试管 (4)②④⑧⑨ (5)⑧⑨ (6)B
一、选择题(本题包括3小题,每题6分,共18分)
1.(原创)实验室有下列试剂:①浓硝酸②铁粉③稀盐酸④硅酸钠溶液,应保存在相应的试剂瓶(甲、乙、丙、丁)中,下列试剂瓶选择正确的是 ( )
A.②③④① B.②④③①
C.②①③④ D.①②④③
【解析】选B。①浓硝酸见光易分解,应保存在棕色试剂瓶中;②铁粉是固体,应保存在广口瓶中;稀盐酸是液体,应保存在玻璃塞细口瓶中;④硅酸钠溶液呈碱性,应保存在橡胶塞细口瓶中。
2.(双选)实验室从废定影液[含Ag(S2O3和Br-等]中回收Ag和Br2的主要步骤为向废定影液中加入Na2S溶液沉淀银离子,过滤、洗涤、干燥,灼烧Ag2S制取金属Ag;制取Cl2并将Cl2通入滤液中氧化Br-,再用苯萃取分液。其中部分实验操作的装置如图所示:
下列叙述正确的是 ( )
A.用装置甲可分离出Ag2S
B.用装置乙在通风橱中高温灼烧Ag2S制取Ag
C.用装置丙制备用于氧化过滤液中Br-的Cl2
D.用装置丁分液时,先放出水层再换个烧杯继续放出有机层
- 9 -
【解析】选A、C。A.用装置甲(过滤)可分离Ag2S不溶物,故A项正确;B.蒸发皿可用于水溶液的蒸发结晶,而高温灼烧Ag2S固体时需用坩埚进行实验,故B项错误;C.高锰酸钾具有强氧化性,在常温下可与浓盐酸反应制备氯气,其实验装置与操作均科学规范,故C项正确;D.苯为有机萃取剂,其密度比水小,则在分液时,先从分液漏斗的下口放出水层,不能从下口继续放出有机层,而应该从上口倒出有机层,故D项错误。
3.(2020·南通模拟)仅用表中提供的玻璃仪器(非玻璃仪器任选)或实验装置就能达到相应实验目的的是 ( )
选项
A
B
C
D
实验
目的
除去KCl中少量MnO2
用10 mol·L-1盐酸配制100 mL 0.1 mol·L-1盐酸
用NaCl溶液制备NaCl晶体
除去乙烯中少量SO2
实验仪器或装置
烧杯、玻璃棒、分液漏斗
100 mL容量瓶、玻璃棒、烧杯
【解析】选C。MnO2难溶于水,KCl易溶于水,采用过滤法,应用普通漏斗,A错误;缺少量取盐酸的仪器,如移液管等,B错误;可以用蒸发的方法用NaCl溶液制备NaCl晶体,C正确;SO2和乙烯均能与酸性KMnO4溶液反应,不能达到除杂的目的,D错误。
二、非选择题(本题包括2小题,共32分)
4.(15分)下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体)。请回答下列问题:
(1)能用作干燥氨气的装置有________(填字母);
(2)既能用于收集氯气又能用于收集一氧化氮气体的装置有________(填字母);
(3)在氯气和铁反应的实验中,能添加在制氯气和反应装置之间以除去氯气中氯化氢等杂质气体的装置有________(填字母);
(4)能用于乙烯与溴水反应制二溴乙烷的实验装置有________(填字母);
- 9 -
(5)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体。可供选择的液体试剂有浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液。请回答下列问题:
①通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满。若制取某气体的过程中,丙中的紫色石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为__________________,制取该气体利用了B的性质有____________、____________。若紫色石蕊溶液变蓝,则烧瓶中应加入的固体试剂A为________。
②若在乙中收集氨气,气体流经装置的顺序是a→______→______→d(填接口字母)。
【解析】(1)干燥氨气需要用固体干燥剂碱石灰,故只能用球形干燥管D或U形管E。
(2)收集氯气可用向上排空气法或排饱和食盐水法,而收集NO只能用排水法,不能用排空气法,因其易与空气中O2反应。既能用于收集氯气又能用于收集一氧化氮气体的装置有A和B,A中装满水,短管进气可以收集NO。
(3)根据题意,需要添加一个洗气瓶。
(4)A装置具有双孔橡皮塞,可用作乙烯与溴水反应制二溴乙烷的实验装置,乙烯从长导管进,瓶内装溴水,故选用装置A。
(5)①根据丙中紫色石蕊溶液变红可知制备的气体为氯化氢。因浓硫酸稀释时放出大量的热,故A为浓盐酸。若紫色石蕊溶液变蓝可知制备的气体为氨气,故固体A为NaOH或CaO或碱石灰,B为浓氨水。②氨气极易溶于水,且密度比空气小,故连接顺序为acbd。
答案:(1)DE (2)AB (3)A (4)A (5)①浓盐酸 吸水性 溶于水放出大量热 NaOH(或CaO或碱石灰)
②c b
5.(17分)无水氯化铝为白色粉末,极易吸水,常压下182.7 ℃升华。学生甲拟选用如图所示仪器、装置(部分仪器连接的橡胶管或橡胶塞省略)和试剂制备无水氯化铝。
- 9 -
回答下列问题:
(1)实验前,如何检查装置A的气密性?
____________________。
(2)装置A中反应的化学方程式为 ______________。
(3)从上列仪器中选取制备无水氯化铝的装置,各装置的连接顺序为A→____→____→____→____→G。
(4)装置G的作用是____________________。
(5)学生乙提出另一种制备无水氯化铝的方案:将金属铝与足量盐酸反应后,将溶液加热蒸干、灼烧得到无水氯化铝,请你评价该方案是否可行,并说明理由
__________________。
【解析】(1)关闭A装置的止水夹和分液漏斗的旋塞,向分液漏斗中加水,然后打开分液漏斗的旋塞,当少许水进入烧瓶后滴水停止,说明装置A不漏气;
(2)HCl(浓)与MnO2反应可用来制取氯气;
(3)根据题意知,先制取氯气,制取氯气所用的药品的状态是固体和液体,条件是加热,所以选A;制取氯气所用的浓盐酸具有挥发性,浓盐酸中的水在加热条件下生成水蒸气,所以制取的氯气中含有氯化氢和水蒸气,要想制取纯净、干燥的氯气,必须除去氯化氢和水蒸气,所以要进行净化和干燥氯气,所以选C、B;制取的纯净、干燥的氯气和铝反应,条件是加热,且必须有进气口和出气口,所以选D;因为AlCl3易升华,所以选取一个缓冲装置使其变成固态易保存,故选F;氯气有毒,污染空气,所以不能直接排空,又因为空气中有水蒸气,无水AlCl3极易与水作用而变质,所以选取盛放碱石灰的干燥管G;
(4)因为空气中有水蒸气,无水AlCl3极易与水作用而变质,且氯气有毒,所以用碱石灰吸收Cl2和防止空气中水蒸气进入装置;
- 9 -
(5)AlCl3在水中存在如下平衡:AlCl3+3H2OAl(OH)3+3HCl,蒸干和灼烧过程中,HCl挥发,Al(OH)3分解:2Al(OH)3Al2O3+3H2O↑,因此固体产物主要为Al2O3。
答案:(1)关闭A装置的止水夹和分液漏斗的旋塞,向分液漏斗中加水,然后打开分液漏斗的旋塞,当少许水进入烧瓶后滴水停止,说明装置A不漏气
(2)4HCl(浓)+MnO2MnCl2+Cl2↑+2H2O
(3)C B D F
(4)吸收多余的氯气,同时防止空气中水蒸气进入装置中使氯化铝水解
(5)不可行,AlCl3在水中存在如下平衡:AlCl3+3H2OAl(OH)3+3HCl,蒸干和灼烧过程中,HCl挥发,Al(OH)3分解:2Al(OH)3Al2O3+3H2O↑,因此固体产物主要为Al2O3
【加固训练】
玻璃棒是中学化学实验中常用的仪器,下列实验过程中,一般不需要用玻璃棒的是________(填写编号)
①用湿润的红色石蕊试纸检验氨气;
②将蒸发结晶所得NaCl固体从蒸发皿中转移至称量纸上进行称量;
③探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化;
④用蒸馏法分离两种沸点差距较大的液体;
⑤过滤分离互不相溶的固体和液体;
⑥用已知浓度的盐酸滴待测浓度的NaOH溶液的酸碱中和滴定过程;
⑦稀释浓硫酸的过程。
【解析】将湿润的红色石蕊试纸沾在玻璃棒一端,靠近待测气体,即可检验氨气,故①需要;蒸发皿中的NaCl用玻璃棒刮下,转移到称量纸上进行称量,故②需要;探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化,用玻璃棒搅拌两固体的混合物,需要使用玻璃棒,故③需要;蒸馏需要使用温度计测量温度,蒸馏操作中不需要使用玻璃棒,故④不需要;过滤操作中需要使用玻璃棒引流,避免液体流到漏斗以外,故⑤需要;酸碱中和滴定中不需要使用玻璃棒,故⑥不需要;稀释浓硫酸的过程中,需要使用玻璃棒搅拌,加速稀释过程,故⑦需要。
答案:④⑥
- 9 -
- 9 -