- 525.50 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第3课时 化学能与电能(1)——原电池、化学电源(过基础)
知识点一 原电池工作原理及应用
1.概念
原电池是把化学能转化为能的装置。
2.构成条件
反应
能自发进行的氧化还原反应(一般是活泼性强的金属与电解质溶液反应)
电极
一般是活泼性不同的两电极(金属或石墨)
闭合
回路
①电解质溶液
②两电极直接或间接接触
③两电极插入电解质溶液中
3.工作原理(如锌铜原电池可用简图表示)
总反应离子方程式为Zn+2H+===Zn2++H2↑
(1)电极
①负极:失去电子,发生氧化反应;
②正极:得到电子,发生还原反应。
(2)电子定向移动方向和电流方向
①电子从负极流出经外电路流入正极;
②电流从正极流出经外电路流入负极;
故电子定向移动方向与电流方向正好相反。
(3)离子移动方向
阴离子向负极移动(如SO),阳离子向正极移动(如Zn2+和H+,溶液中H+在正极上得电子形成氢气在铜片上冒出)。
[提醒] ①电解质溶液中阴、阳离子的定向移动,与导线中电子的定向移动共同组成了一个完整的闭合回路。
②无论在原电池中还是在电解池中,电子均不能通过电解质溶液。
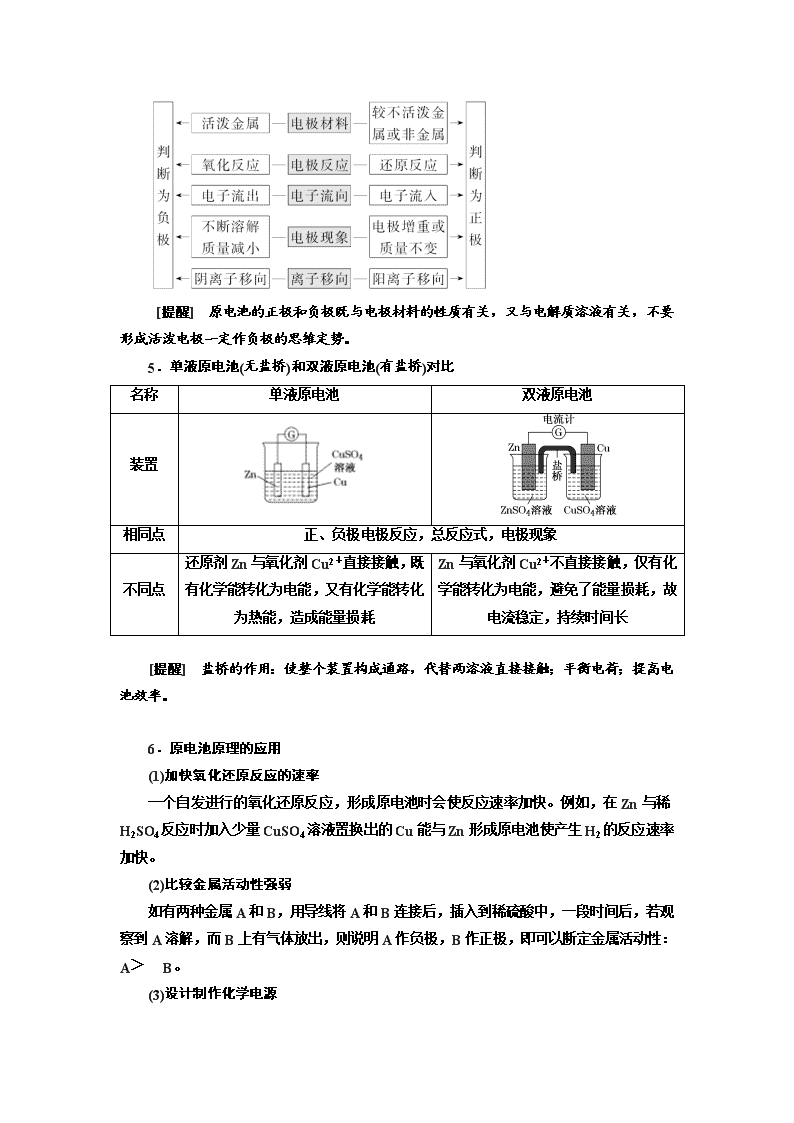
4.原电池正、负极的判断
[提醒] 原电池的正极和负极既与电极材料的性质有关,又与电解质溶液有关,不要形成活泼电极一定作负极的思维定势。
5.单液原电池(无盐桥)和双液原电池(有盐桥)对比
名称
单液原电池
双液原电池
装置
相同点
正、负极电极反应,总反应式,电极现象
不同点
还原剂Zn与氧化剂Cu2+直接接触,既有化学能转化为电能,又有化学能转化为热能,造成能量损耗
Zn与氧化剂Cu2+不直接接触,仅有化学能转化为电能,避免了能量损耗,故电流稳定,持续时间长
[提醒] 盐桥的作用:使整个装置构成通路,代替两溶液直接接触;平衡电荷;提高电池效率。
6.原电池原理的应用
(1)加快氧化还原反应的速率
一个自发进行的氧化还原反应,形成原电池时会使反应速率加快。例如,在Zn与稀H2SO4反应时加入少量CuSO4溶液置换出的Cu能与Zn形成原电池使产生H2的反应速率加快。
(2)比较金属活动性强弱
如有两种金属A和B,用导线将A和B连接后,插入到稀硫酸中,一段时间后,若观察到A溶解,而B上有气体放出,则说明A作负极,B作正极,即可以断定金属活动性:AB。
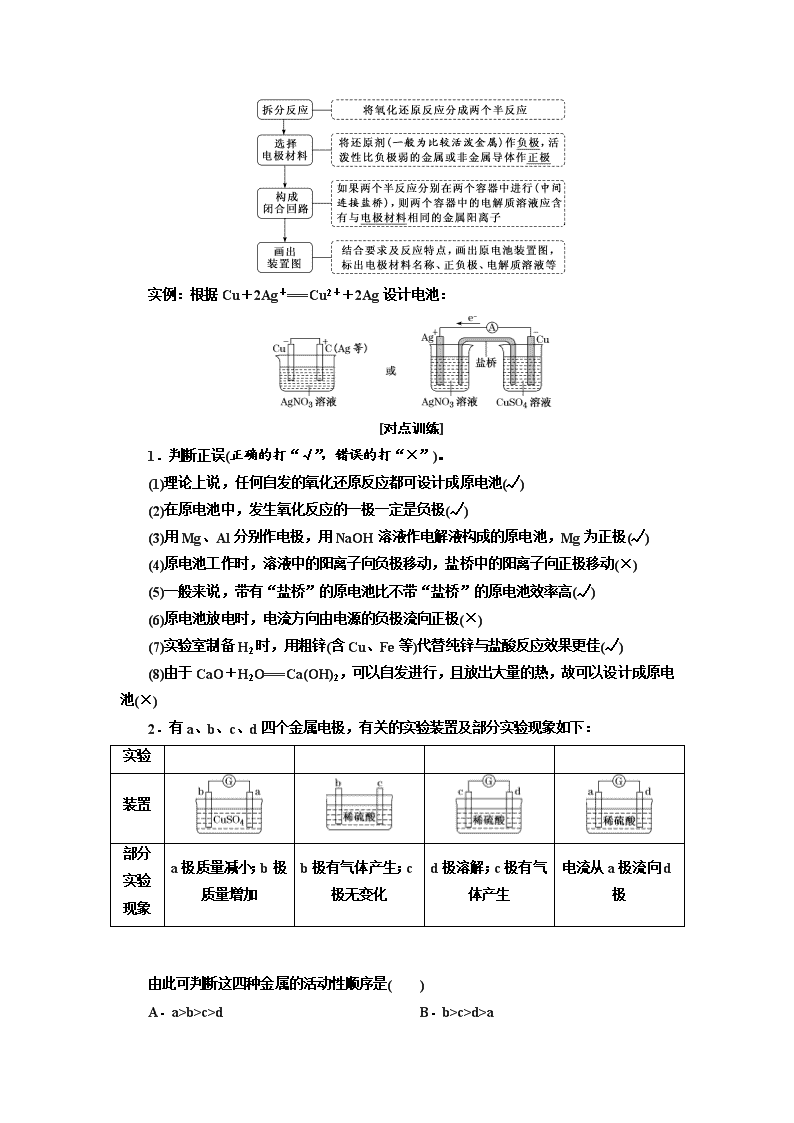
(3)设计制作化学电源
实例:根据Cu+2Ag+===Cu2++2Ag设计电池:
[对点训练]
1.判断正误(正确的打“√”,错误的打“×”)。
(1)理论上说,任何自发的氧化还原反应都可设计成原电池(√)
(2)在原电池中,发生氧化反应的一极一定是负极(√)
(3)用Mg、Al分别作电极,用NaOH溶液作电解液构成的原电池,Mg为正极(√)
(4)原电池工作时,溶液中的阳离子向负极移动,盐桥中的阳离子向正极移动(×)
(5)一般来说,带有“盐桥”的原电池比不带“盐桥”的原电池效率高(√)
(6)原电池放电时,电流方向由电源的负极流向正极(×)
(7)实验室制备H2时,用粗锌(含Cu、Fe等)代替纯锌与盐酸反应效果更佳(√)
(8)由于CaO+H2O===Ca(OH)2,可以自发进行,且放出大量的热,故可以设计成原电池(×)
2.有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验
装置
部分实验现象
a极质量减小;b极质量增加
b极有气体产生;c极无变化
d极溶解;c极有气体产生
电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>d B.b>c>d>a
C.d>a>b>c D.a>b>d>c
解析:选C 把四个实验从左到右分别编号为①、②、③、④,则由实验①可知,a作原电池负极,b作原电池正极,金属活动性:a>b;由实验②可知,b极有气体产生,c极无变化,则活动性:b>c;由实验③可知,d极溶解,则d作原电池负极,c作正极,活动性:d>c;由实验④可知,电流从a极流向d极,则d极为原电池负极,a极为原电池正极,活动性:d>a。综合所述可知活动性:d>a>b>c。
3.利用反应Cu+2Fe3+===2Fe2++Cu2+设计了如图所示的原电池。回答下列问题:
(1)该原电池的负极材料是________,发生________(填“氧化”或“还原”)反应。
(2)X是____________,图中“→”表示________的方向。
(3)盐桥中的SO移向________溶液。
答案:(1)Cu 氧化
(2)Fe2(SO4)3(或FeCl3)溶液 电子移动
(3)CuSO4
知识点二 化学电源
1.一次电池
(1)碱性锌锰干电池
正极反应:2MnO2+2H2O+2e-===2MnOOH+2OH-;
负极反应:Zn+2OH--2e-===Zn(OH)2;
总反应:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2。
(2)锌银电池
负极反应:Zn+2OH--2e-===Zn(OH)2;
正极反应:Ag2O+H2O+2e-===2Ag+2OH-;
总反应:Zn+Ag2O+H2O===Zn(OH)2+2Ag。
2.二次电池(可充电电池)
铅蓄电池是最常见的二次电池,负极材料是,正极材料是PbO2。
(1)放电时的反应
①负极:Pb(s)+SO(aq)-2e-===PbSO4(s)(氧化反应)。
②正极:PbO2(s)+4H+(aq)+SO(aq)+2e-===PbSO4(s)+2H2O(l)(还原反应)。
③总反应:Pb(s)+PbO2(s)+2H2SO4(aq)===2PbSO4(s)+2H2O(l)。
(2)充电时的反应
①阴极:PbSO4(s)+2e-===Pb(s)+SO(aq)(还原反应)。
②阳极:PbSO4(s)+2H2O(l)-2e-===PbO2(s)+4H+(aq)+SO(aq)(氧化反应)。
③总反应:2PbSO4(s)+2H2O(l)===Pb(s)+PbO2(s)+2H2SO4(aq)。
3.燃料电池
氢氧燃料电池是目前最成熟的燃料电池,可分成酸性和碱性两种。
酸性
碱性
负极反应式
2H2-4e-===4H+
2H2+4OH--4e-
===4H2O
正极反应式
O2+4H++4e-
===2H2O
O2+2H2O+4e-
===4OH-
电池总反应式
2H2+O2===2H2O
[提醒] ①燃料电池中通入O2的一极为正极,通入可燃物的一极为负极。
②书写燃料电池的电极反应时,要注意溶液的酸碱性,介质的酸碱性对电极反应和总反应都会产生影响。
[对点训练]
1.镉镍可充电电池的充、放电反应按下式进行:Cd+2NiO(OH)+2H2OCd(OH)2+2Ni(OH)2,由此判断错误的是( )
A.放电时,Cd作负极
B.放电时,NiO(OH)作负极
C.电解质溶液为碱性溶液
D.放电时,负极反应为Cd+2OH--2e-===Cd(OH)2
解析:选B 镉镍电池放电时,Cd作负极,电板反应式为Cd+2OH--2e-===Cd(OH)2;NiO(OH)作正极,电解质溶液为KOH等碱性溶液,B项错误。
2
.由我国科学家研发成功的铝锰电池是一种比能量很高的新型干电池,以氯化钠和稀氨水混合溶液为电解质,铝和二氧化锰石墨为两极,其电池反应为Al+3MnO2+3H2O===3MnO(OH)+Al(OH)3。下列有关该电池放电时的说法不正确的是( )
A.二氧化锰石墨为电池正极
B.负极反应式为Al-3e-+3NH3·H2O===Al(OH)3+3NH
C.OH-不断由负极向正极移动
D.每生成1 mol MnO(OH)转移1 mol电子
解析:选C 由电池反应方程式知,铝为电池负极,铝失去电子转化为Al(OH)3,A、B正确;阴离子移向负极,OH-应不断由正极向负极移动,C错误;由反应中锰元素价态变化知D正确。
3.银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O===Zn(OH)2+2Ag。其工作示意图如图所示。下列说法不正确的是( )
A.Zn电极是负极
B.Ag2O电极发生还原反应
C.Zn电极的电极反应式:Zn-2e-+2OH-===Zn(OH)2
D.放电前后电解质溶液的pH保持不变
解析:选D 由电池的总反应Zn+Ag2O+H2O===Zn(OH)2+2Ag知,Zn从0价变为+2价,化合价升高,失去电子,故Zn电极为负极,A正确;Ag2O中Ag从+1价变为0价,化合价降低,得到电子,发生还原反应,B正确;在碱性条件下,Zn2+与OH-结合生成Zn(OH)2,故Zn电极的电极反应式为Zn-2e-+2OH-===Zn(OH)2,C正确;根据总反应可知,反应中H2O被不断地消耗,电解质溶液中OH-浓度增大,所以放电后电解质溶液的pH增大,D错误。