- 262.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学反应速率与化学平衡图像解题方法
专题训练
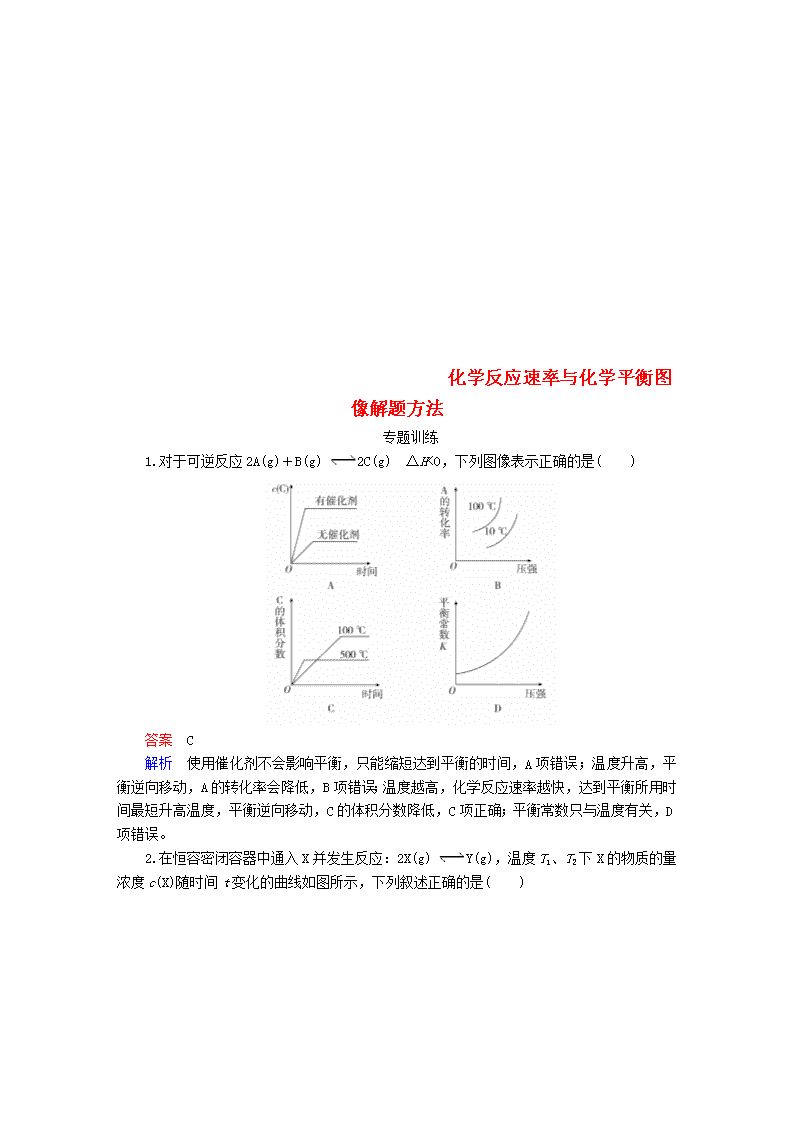
1.对于可逆反应2A(g)+B(g) 2C(g) ΔH<0,下列图像表示正确的是( )
答案 C
解析 使用催化剂不会影响平衡,只能缩短达到平衡的时间,A项错误;温度升高,平衡逆向移动,A的转化率会降低,B项错误;温度越高,化学反应速率越快,达到平衡所用时间最短升高温度,平衡逆向移动,C的体积分数降低,C项正确;平衡常数只与温度有关,D项错误。
2.在恒容密闭容器中通入X并发生反应:2X(g) Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是( )
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)= mol·L-1·min-1
C.M点的正反应速率v正大于N点的逆反应速率v逆
D.M点时再加入一定量X,平衡后X的转化率减小
答案 C
解析 依据题中图示,可看出T1>T2,由于T1时X的平衡浓度大,可推出该反应为放热反应。A项,M点与W点比较,X的转化量前者小于后者,故进行到M点放出的热量应小于进行到W点放出的热量,A项错误;B项,2v(Y)=v(X)= mol·L-1·min-1,B项错误;C项,T1>T2且M点的Y的浓度大于N点的,故M点v逆大于N点v逆,而M点v正=v逆,所以M点v正大于N点v逆,C项正确;D项,恒容时充入X,压强增大,平衡正向移动,X的转化率增大,D项错误。
3.在密闭容器中进行反应:X(g)+2Y(g) 2Z(g) ΔH>0。下图能正确表示该反应有关物理量变化规律的是( )
答案 C
解析
正反应吸热,升高温度平衡向正反应方向移动,正反应速率大于逆反应速率,A错误;正反应吸热,升高温度平衡向正反应方向移动,Z的含量升高,B错误;升高温度或增大压强,平衡均向正反应方向进行,X的转化率升高,C正确;平衡常数只与温度有关,温度不变,平衡常数为定值,D错误。
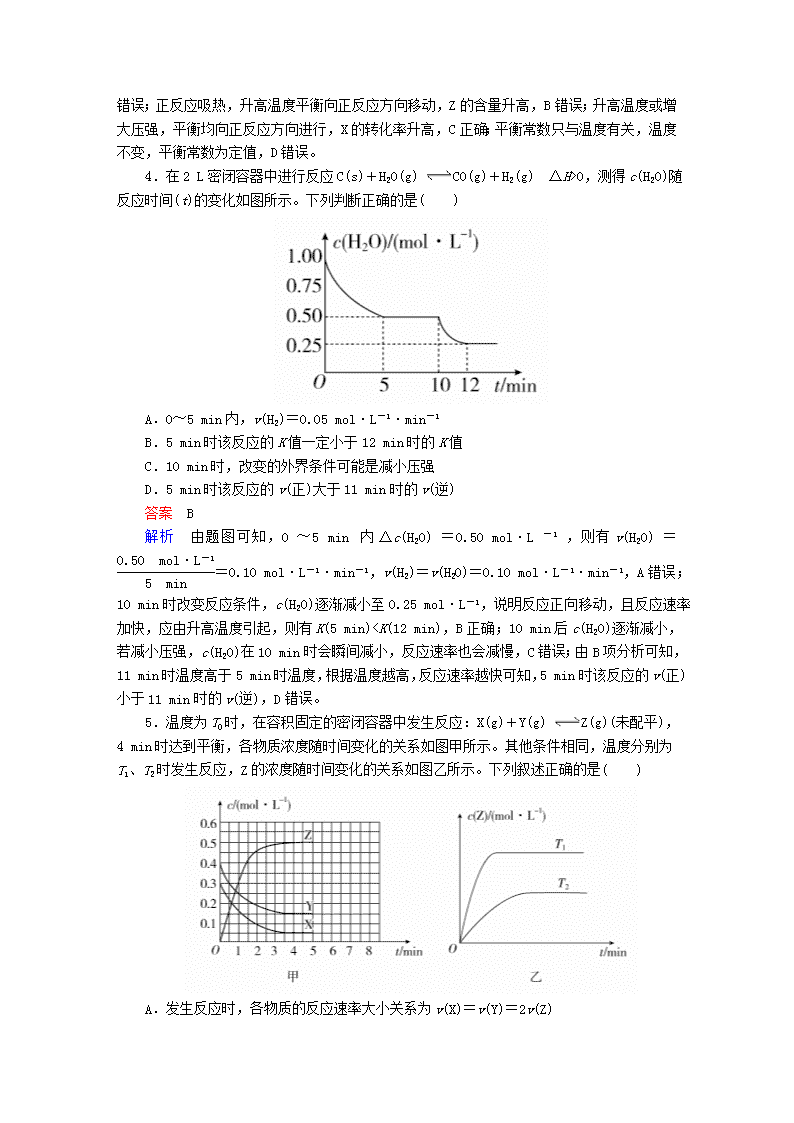
4.在2 L密闭容器中进行反应C(s)+H2O(g) CO(g)+H2(g) ΔH>0,测得c(H2O)随反应时间(t)的变化如图所示。下列判断正确的是( )
A.0~5 min内,v(H2)=0.05 mol·L-1·min-1
B.5 min时该反应的K值一定小于12 min时的K值
C.10 min时,改变的外界条件可能是减小压强
D.5 min时该反应的v(正)大于11 min时的v(逆)
答案 B
解析 由题图可知,0~5 min内Δc(H2O)=0.50 mol·L-1,则有v(H2O)==0.10 mol·L-1·min-1,v(H2)=v(H2O)=0.10 mol·L-1·min-1,A错误;10 min时改变反应条件,c(H2O)逐渐减小至0.25 mol·L-1,说明反应正向移动,且反应速率加快,应由升高温度引起,则有K(5 min)T2,温度越高,平衡时Z的物质的量浓度越大,说明升高温度平衡向正反应方向移动,升高温度平衡向吸热方向移动,故正反应为吸热反应。A项,由上述分析可知,反应为X(g)+Y(g)2Z(g),速率之比等于各物质的化学计量数之比,所以反应时各物质的反应速率大小关系为2v(X)=2v(Y)=v(Z),错误;B项,由图甲可知,Y的起始浓度为0.4 mol/L,平衡时Y的物质的量浓度为0.15 mol/L,Y的浓度变化了0.25 mol/L,故平衡时Y的转化率为×100%=62.5%,错误;C项,由图甲可知,平衡时,X、Y、Z的物质的量浓度分别为0.05 mol/L、0.15 mol/L、0.5 mol/L,K===33.3,正确;D项,由上述分析可知,该反应正反应为吸热反应,故ΔH>0,错误。
6.I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I(aq),某I2、KI混合溶液中,c(I)与温度T的关系如图所示(曲线上任何一点都表示平衡状态),下列说法不正确的是( )
A.温度为T1时,向该平衡体系中加入KI固体,平衡正向移动
B.反应I2(aq)+I-(aq) I(aq)的ΔH<0
C.若T1时,反应进行到状态d时,一定有v正>v逆
D.状态a与状态b相比,状态b时I2的转化率更高
答案 D
解析 温度为T1时,加入KI固体,碘离子浓度增大,平衡向正反应方向移动,故A正确;由图像中曲线的变化趋势可知,当温度升高时,I的物质的量浓度减小,说明升温平衡向逆反应方向移动,该反应的正反应为放热反应,反应I2(aq)+I-(aq) I(aq)的ΔH<0,故B正确;反应进行到状态d时,反应未达到平衡状态,反应趋向于平衡,则反应向生成I的方向移动,则v正>v逆,故C正确;状态b相当于在状态a的基础上升高温度,该反应的正反应为放热反应,升高温度,平衡向逆反应方向移动,状态b时I2
的转化率更低,故D错误。
7.工业上用下列反应合成甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。在固定容积为2 L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示(注:T1、T2均大于300 ℃)。下列说法正确的是( )
A.温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH)= mol·L-1·min-1
B.该反应在温度为T1时的平衡常数比温度为T2时的小
C.该反应的正反应为放热反应
D.处于A点的反应体系从T1变到T2,达到平衡时减小
答案 C
解析 由图像可知在温度为T2时反应先达到平衡,因此温度T2>T1,温度高反应达平衡时甲醇的物质的量反而低,说明正反应是放热反应,升高温度平衡常数减小,故B项错误,C项正确;温度为T1时,从反应开始到达到平衡,生成甲醇的物质的量为n1 mol,此时甲醇的浓度为 mol·L-1,所以生成甲醇的平均速率为v(CH3OH)= mol·L-1·min-1,A项错误;因为温度T2>T1,所以A点的反应体系从T1变到T2时,平衡会向逆反应方向移动,即生成物浓度减小而反应物浓度增大,增大,所以D项错误。
8.对于密闭容器中的可逆反应A2(g)+3B2(g) 2AB3(g),探究单一条件改变情况下,可能引起平衡状态的改变,得到如图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是( )
A.加入催化剂可以使状态d变为状态b
B.若T1>T2,则逆反应一定是放热反应
C.达到平衡时,A2的转化率大小为b>a>c
D.在T2和n(A2)不变时达到平衡,AB3的物质的量的大小为c>b>a
答案 D
解析 加入催化剂只改变反应速率,不能使平衡发生移动,故加入催化剂不能使状态d变为状态b,A错误。若T1>T2,由题图可知,温度升高,n(B2)不变时,平衡时AB3的体积分数减小,说明升高温度,平衡逆向移动,则逆反应是吸热反应,B错误。图中横坐标为n起始(B2),增大一种反应物的量会提高另一种反应物的转化率,则n起始(B2)越大,平衡时A2的转化率越大,即达到平衡时A2的转化率大小为c>b>a,C错误。其他条件相同时,n起始(B2)越大,平衡时A2的转化率越大,则平衡时AB3的物质的量越大,故平衡时AB3的物质的量的大小为c>b>a,D正确。
9.(1)CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
①曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ________KⅡ(填“>”“=”或“<”)。
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
若甲平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为________。
(2)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如下图。在0~15小时内,CH4的平均生成速率Ⅰ、Ⅱ和Ⅲ从大到小的顺序为________(填序号)。
答案 (1)①> ②0.4Ⅲ>Ⅰ
解析 (1)①分析图像知KⅠ>KⅡ。
② CO2(g)+3H2(g) CH3OH(g)+H2O(g)
初始量/mol 1 3 0 0
转化量/mol x 3x x x
平衡量/mol 1-x 3-3x x x
4-2x=4×0.8,得x=0.4
根据题意可得,甲乙为等效平衡,且起始时维持反应逆向进行。所以若全部由生成物投料时,c=1 mol,同时c要大于平衡时的量,故有0.4Ⅲ>Ⅰ。