- 906.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
仿真模拟冲刺标准练(三)
本试题卷满分100分,考试时间90分钟。
可能用到的相对原子质量:H—1,C—12,O—16,Mg—24,Al—27,Cr—52
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.化学与生活、生产密切相关。下列物质的性质和应用均正确且有对应关系的是( )
选项
物质的性质
应用
A
苏打无毒且溶液显碱性
作食用碱
B
二氧化硫具有漂白性
作葡萄酒的防腐剂
C
FeCl3具有氧化性
作自来水的杀菌消毒剂
D
单晶硅能传导光信号
制太阳能电池
2.NA为阿伏加德罗常数的值。下列说法正确的是( )
A.0.2 g H218O与D216O的混合物中所含中子数为0.1NA
B.标准状况下,11.2 L臭氧所含质子数为8NA
C.20 mL 0.1 mol·L-1AlCl3溶液中,水解形成的Al(OH)3胶体粒子数为0.002NA
D.0.5 mol H2和0.5 mol I2在加热条件下充分反应,生成HI的分子数为NA
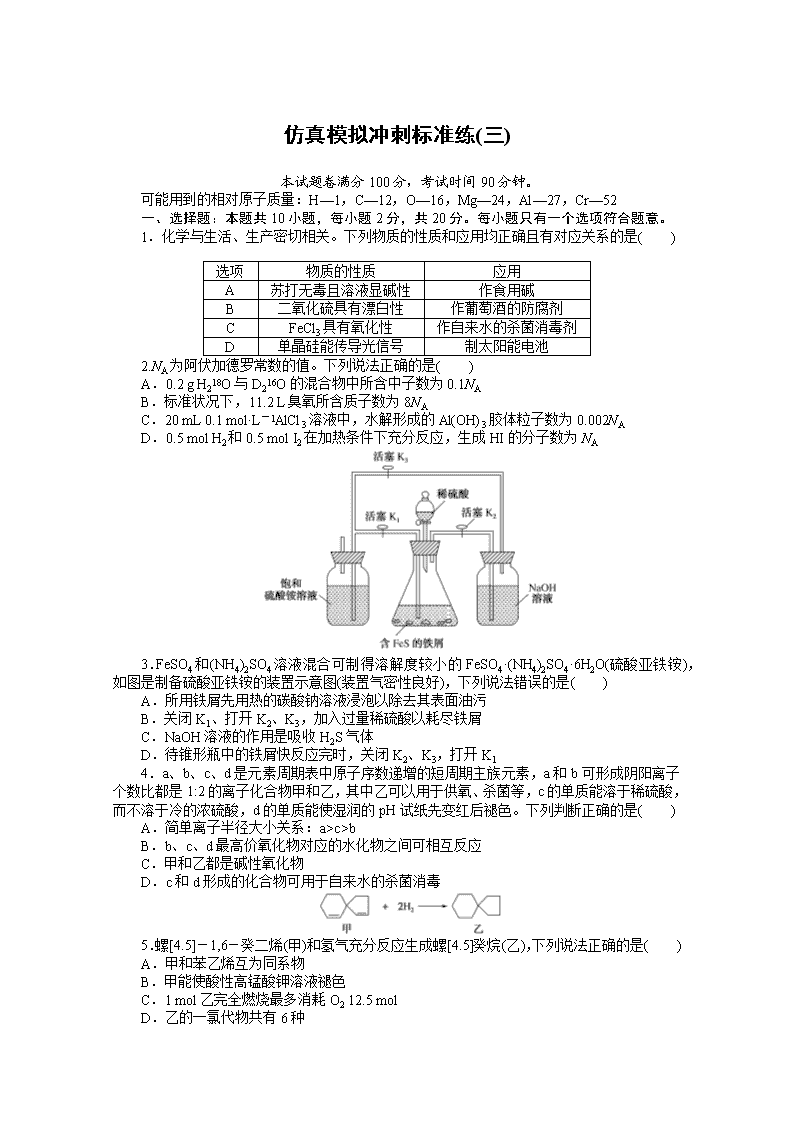
3.FeSO4和(NH4)2SO4溶液混合可制得溶解度较小的FeSO4·(NH4)2SO4·6H2O(硫酸亚铁铵),如图是制备硫酸亚铁铵的装置示意图(装置气密性良好),下列说法错误的是( )
A.所用铁屑先用热的碳酸钠溶液浸泡以除去其表面油污
B.关闭K1、打开K2、K3,加入过量稀硫酸以耗尽铁屑
C.NaOH溶液的作用是吸收H2S气体
D.待锥形瓶中的铁屑快反应完时,关闭K2、K3,打开K1
4.a、b、c、d是元素周期表中原子序数递增的短周期主族元素,a和b可形成阴阳离子个数比都是1:2的离子化合物甲和乙,其中乙可以用于供氧、杀菌等,c的单质能溶于稀硫酸,而不溶于冷的浓硫酸,d的单质能使湿润的pH试纸先变红后褪色。下列判断正确的是( )
A.简单离子半径大小关系:a>c>b
B.b、c、d最高价氧化物对应的水化物之间可相互反应
C.甲和乙都是碱性氧化物
D.c和d形成的化合物可用于自来水的杀菌消毒
5.螺[4.5]-1,6-癸二烯(甲)和氢气充分反应生成螺[4.5]癸烷(乙),下列说法正确的是( )
A.甲和苯乙烯互为同系物
B.甲能使酸性高锰酸钾溶液褪色
C.1 mol乙完全燃烧最多消耗O2 12.5 mol
D.乙的一氯代物共有6种
6.装置(Ⅰ)为铁镍可充电电池:Fe+NiO2+2H2OFe(OH)2+Ni(OH)2;装置(Ⅱ)为电解池的装置示意图。当闭合开关K时,Fe电极附近溶液先变红。下列说法错误的是( )
A.打开K,用导线连接Fe和石墨,装置(Ⅱ)的总反应为2Fe+O2+2H2O===2Fe(OH)2
B.闭合K时,OH-通过阴离子交换膜移向电极A
C.闭合K时,若Fe和石墨互换,装置(Ⅰ)中有0.1 mol OH-通过阴离子交换膜,则装置(Ⅱ)中Fe电极质量减轻5.6 g
D.给装置(Ⅰ)充电时,电极A的电极反应式为Fe(OH)2+2e-===Fe+2OH-
7.常温下,向溶有0.1 mol Cl2的氯水中滴加2 mol·L-1的NaOH溶液,得到溶液的pH随所加NaOH溶液体积的变化图像如下。下列说法正确的是( )
A.若a点对应溶液pH=4,且c(Cl-)=mc(ClO-),则Ka(HClO)=
B.向a点对应溶液中通入SO2,溶液的酸性和漂白能力均增强
C.若x=100,b点对应溶液中:c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+)
D.若y=200,c点对应溶液中:c(Na+)=4c(ClO-)+4c(Cl-)
8.常温下,用AgNO3溶液分别滴定等物质的量浓度的KCl、K2CrO4溶液,所得的沉淀溶解平衡图像如下(Ag2CrO4是砖红色沉淀,Xm-表示对应的阴离子)。下列叙述不正确的是( )
A.该温度下AgCl的溶度积等于10-9.75
B.该温度下Ag2CrO4(s)+2Cl-(aq)2AgCl(s)+CrO(aq)的平衡常数为107.55
C.可用AgNO3溶液和K2CrO4溶液测定废水中Cl-浓度
D.n点对应的Ag2CrO4溶液中可能有砖红色沉淀出现
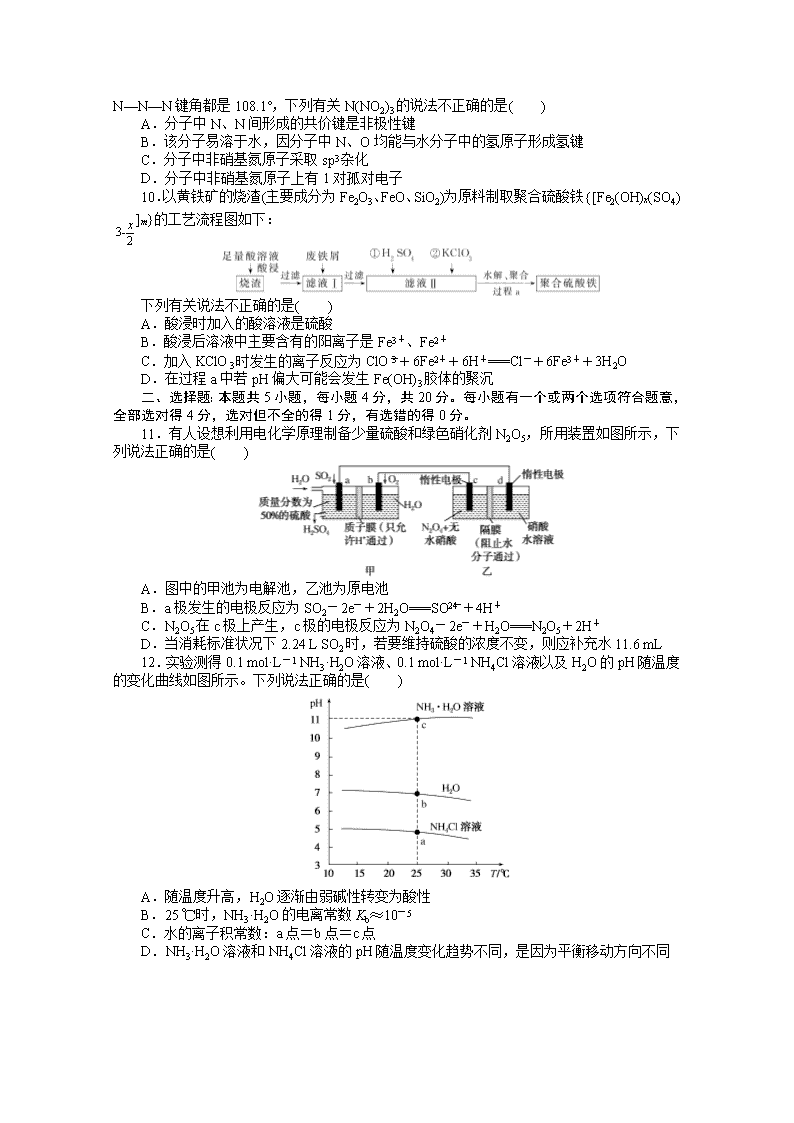
9.科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示)。已知该分子中N—N—N键角都是108.1°,下列有关N(NO2)3的说法不正确的是( )
A.分子中N、N间形成的共价键是非极性键
B.该分子易溶于水,因分子中N、O均能与水分子中的氢原子形成氢键
C.分子中非硝基氮原子采取sp3杂化
D.分子中非硝基氮原子上有1对孤对电子
10.以黄铁矿的烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制取聚合硫酸铁{[Fe2(OH)x(SO4)]m}的工艺流程图如下:
下列有关说法不正确的是( )
A.酸浸时加入的酸溶液是硫酸
B.酸浸后溶液中主要含有的阳离子是Fe3+、Fe2+
C.加入KClO3时发生的离子反应为ClO+6Fe2++6H+===Cl-+6Fe3++3H2O
D.在过程a中若pH偏大可能会发生Fe(OH)3胶体的聚沉
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得1分,有选错的得0分。
11.有人设想利用电化学原理制备少量硫酸和绿色硝化剂N2O5,所用装置如图所示,下列说法正确的是( )
A.图中的甲池为电解池,乙池为原电池
B.a极发生的电极反应为SO2-2e-+2H2O===SO+4H+
C.N2O5在c极上产生,c极的电极反应为N2O4-2e-+H2O===N2O5+2H+
D.当消耗标准状况下2.24 L SO2时,若要维持硫酸的浓度不变,则应补充水11.6 mL
12.实验测得0.1 mol·L-1 NH3·H2O溶液、0.1 mol·L-1 NH4Cl溶液以及H2O的pH随温度的变化曲线如图所示。下列说法正确的是( )
A.随温度升高,H2O逐渐由弱碱性转变为酸性
B.25 ℃时,NH3·H2O的电离常数Kb≈10-5
C.水的离子积常数:a点=b点=c点
D.NH3·H2O溶液和NH4Cl溶液的pH随温度变化趋势不同,是因为平衡移动方向不同
13.室温下,向20 mL含0.10 mol·L-1 Cr2+和0.10 mol·L-1 Fe2+的混合溶液中滴加0.10 mol·L-1 NaOH溶液,金属阳离子浓度与滴入NaOH溶液体积的关系曲线如图所示。若溶液中金属阳离子浓度小于10-5 mol·L-1视为完全沉淀,则下列说法错误的是[已知Cr(OH)2的Ksp为2×10-16,Fe(OH)2的Ksp为8×10-16]( )
A.曲线A表示c(Fe2+)
B.当V(NaOH)=30 mL时,Fe2+开始沉淀
C.当pH=7时,溶液中Fe2+、Cr2+均完全沉淀
D.V(NaOH)>30 mL时,溶液中c(Fe2+)/c(Cr2+)=4.0
14.十氢萘(C10H18)是一种优秀的液体储氢材料,其高压催化脱氢得到四氢萘(C10H12),可用于燃料电池汽车。已知:①C10H18(l)C10H12(l)+3H2(g) ΔH1,②C10H12(l)C10H8(l)+2H2(g) ΔH2。一定温度下,在1 L恒容密闭容器中进行C10H18(1.000 mol)高压催化脱氢实验,测得C10H12和C10H8的物质的量随反应时间的变化曲线如图1所示,上述反应的“能量—反应过程”图像如图2所示。
下列有关说法正确的是( )
A.反应至7 h时,C10H18的转化率为2.1%
B.反应至7 h时,反应体系中氢气的物质的量为0.849 mol
C.反应①的活化能高于反应②的活化能
D.ΔH1>ΔH2>0
15.钠离子电池成本低、安全性好,有望在未来取代锂离子电池,某新型可充电钠离子电池放电的工作原理如图所示。下列分析错误的是( )
A.出于环保考虑,应尽量避免使用重金属(如Pb)作为钠的合金化元素
B.放电时,Na+由右室移向左室
C.放电时,正极反应为:Na0.44MnO2+0.56e-+0.56Na+===NaMnO2
D.充电时,阴极质量变化4.6 g时,外电路中通过0.1 mol e-
三、非选择题:本题共5小题,共60分。
16.(14分)间溴苯甲醛常用作医药中间体,实验室以苯甲醛为原料,在无水AlCl3催化下加热制备间溴苯甲醛。
Ⅰ.催化剂的制备
如图1是实验室制取少量无水AlCl3的相关实验装置。已知无水氯化铝易升华,极易潮解。
(1)若气体A是Cl2,且由KMnO4和浓盐酸反应制取,该反应的离子方程式为
________________________________________________________________________。
(2)若固体B是AlCl3·6H2O,则气体A是________,通入气体A的目的是________________________________________________________________________
________________________________________________________________________。
(3)若气体A为Cl2,乙中的药品是碱石灰,则碱石灰的作用是____________________________。
图1 图2
Ⅱ.间溴苯甲醛的制备
实验所用装置如图2(夹持及加热装置已省略):
已知相关物质的沸点如下表所示:
物质
沸点/℃
液溴
58.8
苯甲醛
179
1,2-二氯乙烷
83.5
间溴苯甲醛
229
实验步骤如下:
步骤1:将一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛在三颈烧瓶中充分混合后,升温至60 ℃,缓慢滴加经浓硫酸干燥过的液溴,维持温度不变,反应一段时间后,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
步骤3:往洗涤后的有机相中加入适量无水MgSO4固体,放置一段时间后,进行下一操作。
步骤4:减压蒸馏有机相,收集相应馏分。
(1)仪器a的名称为________,本实验需要控制反应温度为60 ℃,为了更好地控制反应温度,宜采用的加热方式是________。
(2)步骤2分液时有机相处于________(填“上层”或“下层”),NaHCO3可以除去有机相中的Br2,反应中1 mol Br2参与反应,转移1 mol电子且产生无色气体,反应的离子方程式为________________________________________________________________________。
(3)步骤3中将加入无水MgSO4固体的有机相放置一段时间后,进行的下一操作是________________________________________________________________________。
17.(10分)“将少量氯水加入到NaI溶液中”的学生实验产生了大量含碘废液。某研究小组用该含碘废液制备NaI固体,实验流程如下:
已知:反应②为2I-+2Cu2++SO+H2O===2CuI↓+SO+2H+
回答下列问题:
(1)产生含碘废液的离子方程式为________________。
(2)反应①中I2与Na2SO3溶液反应的离子方程式为____________________。
(3)反应③中CuI发生了________(填“氧化”或“还原”)反应。
(4)含铁化合物B中含两种元素,铁元素与另一种元素物质的量之比为38,则含铁化合物B的化学式为______________。
(5)反应⑤中有黑色固体和无色气体生成,黑色固体的俗称为磁性氧化铁,则反应⑤的化学方程式为________________。
18.(12分)CO2资源化利用的方法之一是合成二甲醚(CH3OCH3)。回答下列问题:
(1)CO2催化加氢合成二甲醚的过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)CO(g)+H2O(g) ΔH=+41.2 kJ·mol-1
反应Ⅱ:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) ΔH=-122.5 kJ·mol-1
其中,反应Ⅱ分①、②两步完成,请写出反应①的热化学方程式。
①________________________________________________________________________
②2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH=-23.5 kJ·mol-1
(2)L(L1、L2)、X分别代表压强或温度,图1表示L一定时,反应Ⅱ中二甲醚的平衡产率随X变化的图像,其中X代表的物理量是________。判断L1、L2的大小,并简述理由:________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)恒压时,在CO2和H2起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性(CH3OCH3的选择性=×100%)随温度的变化如图2。
①t ℃时,起始投入a mol CO2、b mol H2,达到平衡时反应Ⅱ消耗的H2的物质的量为________mol。(列出算式即可)
②温度高于300 ℃时,CO2平衡转化率随温度升高而增大的原因是________________________________________________________________________
________________________________________________________________________。
19.(12分)元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子。在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应为2XCl+2CO+2H2O===X2Cl2·2CO·2H2O。回答下列问题:
(1)X基态原子的电子排布式为________________。
(2)C、H、O三种原子的电负性由大到小的顺序为________。
(3)X2Cl2·2CO·2H2O是一种配合物,其结构如图1所示:
①与CO互为等电子体的分子是________。
②该配合物中氯原子的杂化方式为________。
③在X2Cl2·2CO·2H2O中,每个X原子能与其他原子形成3个配位键,在图1中用“→”标出相应的配位键。
(4)阿伏加德罗常数的测定有多种方法,X-射线衍射法就是其中的一种。通过对XCl晶体的X-射线衍射图像的分析,可以得出XCl的晶胞如图2所示,则距离每个X+最近的Cl-的个数为________,若X原子的半径为a pm,晶体的密度为ρ g·cm-3,则阿伏加德罗常数的值NA=________(列计算式表达)。
20.(12分)合成某物质J的路线如下:
已知:①
②
回答下列问题:
(1)B分子中含有的官能团名称是________。
(2)J的结构中有________种不同化学环境的氢原子。
(3)反应④的化学方程式是________________________________________________________________________。
(4)C的结构简式是________。
(5)反应①~⑧中属于取代反应的是________。
(6)写出F和H在一定条件下聚合生成高分子化合物的化学方程式________________________________________________________________________
________________________________________________________________________。
(7)资料显示:反应⑧有一定的限度,在D与I发生反应时加入有机碱三乙胺能提高目标产物的产率,其原因是________________________________________________________________________。
仿真模拟冲刺标准练(三)
1.A 选项A,Na2CO3在水中水解使溶液显碱性且无毒,可用作食用碱,正确;选项B,二氧化硫作葡萄酒的防腐剂是利用其能杀菌和抗氧化的性质,错误;选项C,FeCl3能发生水解,生成氢氧化铁胶体,可作为自来水的净水剂,但不能用于自来水的杀菌消毒,错误;选项D,单晶硅属于半导体材料,不能传导光信号,错误。
2.A H218O与D216O的摩尔质量均为20 g·mol-1,1 mol H218O和1 mol D216O所含中子均为10 mol,0.2 g(即0.01 mol)该混合物所含中子数为0.01×10×NA=0.1NA,A项正确;1个O3含有24个质子,标准状况下11.2 L O3为0.5 mol,所含中子数为0.5×24×NA=12NA,B项错误;由于Al3+水解为可逆反应,且Al(OH)3胶体粒子是许多Al(OH)3微粒的聚合体,故20 mL 0.1 mol·L-1AlCl3溶液中水解形成Al(OH)3胶体的粒子数小于0.002NA,C项错误;H2+I22HI为可逆反应,0.5 mol H2和0.5 mol I2在加热条件下反应不能进行完全,生成HI的分子数小于NA,D项错误。
3.B 铁屑表面上通常含有油污(主要成分为油脂),将铁屑在热的纯碱溶液中浸泡可以有效除去油污,利用了碳酸钠的水解原理及油脂的水解原理,A正确;该实验中先使稀硫酸和铁屑反应,利用产生的H2将装置中的O2排尽,产生的H2S气体用烧碱溶液吸收,但此过程中不能耗尽铁屑,否则后续实验中将无法利用压强差将生成的FeSO4压到饱和硫酸铵溶液中,并且铁屑可防止Fe3+的生成,B错误,C正确;在实验中,待锥形瓶中铁屑快反应完时,关闭K2、K3,打开K1,铁屑和稀硫酸还持续反应,产生的H2将产生的FeSO4溶液压到饱和硫酸铵溶液中,二者混合产生溶解度较小的FeSO4·(NH4)2SO4·6H2O,D正确。
4.B 简单离子半径大小关系:r(O2-)>r(Na+)>r(Al3+),A错误;Na、Al、Cl最高价氧化物对应的水化物分别是NaOH、Al(OH)3、HClO4,它们可相互反应,B正确;Na2O是碱性氧化物,Na2O2不是碱性氧化物,故C错误;c和d形成的化合物为AlCl3,Al3++3H2OAl(OH)3(胶体)+3H+,Al(OH)3胶体具有吸附性,可吸附水中悬浮杂质,但不能用于自来水的杀菌消毒,D错误。
5.B 甲分子中含有两个碳碳双键,分子式为C10H14,苯乙烯的结构简式为,含有一个碳碳双键,分子式为C8H8,甲和苯乙烯结构不相似,不属于同系物,A错误;甲分子中含有两个碳碳双键,故能使酸性KMnO4溶液褪色,B正确;乙的分子式为C10H18,故1 mol乙完全燃烧的耗氧量为14.5 mol,C错误;乙分子中含有5种氢原子,故乙的一氯代物有5种,D错误。
6.C 打开K,用导线连接Fe和石墨,装置(Ⅱ)为原电池,发生Fe的吸氧腐蚀,总反应为2Fe+O2+2H2O===2Fe(OH)2,故A正确;闭合K时,Fe电极附近溶液先变红,
说明此电极附近产生OH-,电极反应式为2H2O+2e-===2OH-+H2↑,因此Fe电极为阴极,电极A为装置(Ⅰ)放电时的负极,电极反应式为Fe-2e-+2OH-===Fe(OH)2,电极B为装置(Ⅰ)放电时的正极,电极反应式为NiO2+2e-+2H2O===Ni(OH)2+2OH-,OH-通过阴离子交换膜移向电极A,故B正确;闭合K时,若Fe和石墨互换,此时Fe电极为阳极,电极反应为Fe-2e-===Fe2+,装置(Ⅰ)中有0.1 mol OH-通过阴离子交换膜,则Fe电极质量减轻2.8 g,故C错误;给装置(Ⅰ)充电时,电极A应接电源负极,其电极反应式为Fe(OH)2+2e-===Fe+2OH-,故D正确。
7.C 若a点对应溶液pH=4,则c(H+)=1.0×10-4 mol·L-1,对应溶液为氯水,由Cl2+H2OHCl+HClO,则c(Cl-)=c(HClO)+c(ClO-),又c(Cl-)=m·c(ClO-),c(HClO)=(m-1)c(ClO-),Ka(HClO)==,A项错误;向a点对应溶液中通入SO2发生反应Cl2+SO2+2H2O===H2SO4+2HCl,Cl2+H2OHCl+HClO平衡向左移动,溶液漂白能力减弱,B项错误;若x=100,加入的n(NaOH)=0.2 mol,发生反应Cl2+2NaOH===NaCl+NaClO+H2O,ClO-水解,使溶液呈碱性,故b点溶液中离子浓度大小关系:c(Na+)>c(Cl-)>c(ClO-)>c(OH-)>c(H+),C项正确;若y=200,加入的n(NaOH)=0.4 mol,则c点溶液中的溶质为0.2 mol NaOH、0.1 mol NaCl、0.1 mol NaClO,由物料守恒知,c(Na+)=2c(Cl-)+2c(ClO-)+2c(HClO),D项错误。
8.D Ksp(AgCl)=c(Ag+)·c(Cl-),-lg Ksp(AgCl)=[-lg c(Ag+)]+[-lg c(Cl-)],Ksp(Ag2CrO4)=c2(Ag+)·c(CrO),-lg Ksp(Ag2CrO4)=2×[-lg c(Ag+)]+[-lg c(CrO)],选取AgCl溶解平衡曲线上的点(4,5.75)进行计算,解得Ksp(AgCl)=10-9.75,同理,选取Ag2CrO4溶解平衡曲线上的点(4,3.975)进行计算,解得Ksp(Ag2CrO4)=10-11.95,A正确;该温度下Ag2CrO4(s)+2Cl-(aq)2AgCl(s)+CrO(aq)的平衡常数K===107.55,故B正确;Ag2CrO4(s)+2Cl-(aq)2AgCl(s)+CrO(aq)的平衡常数(K=107.55)很大,且Ag2CrO4是砖红色沉淀,故可以用K2CrO4溶液作指示剂,用AgNO3标准溶液滴定废水中的Cl-(终点时有砖红色沉淀生成),故C正确;n点对应的Ag2CrO4溶液中Qc(Ag2CrO4)30 mL时,溶液为Cr(OH)2、Fe(OH)2的饱和溶液,==4.0,D项正确。
14.CD 反应至7 h时,反应①中C10H18(l)分解生成的n(C10H12)=0.021 mol+0.393 mol=0.414 mol,故C10H18的转化率为×100%=41.4%,A项错误;反应至7 h时,反应①生成的n(H2)=0.414 mol×3=1.242 mol,反应②生成的n(H2)=0.393 mol×2=0.786 mol,故体系中n(H2)=1.242 mol+0.786 mol=2.028 mol,B项错误;由题图2可知,反应①的活化能高于反应②的活化能,C项正确;由题图2可知,反应①、反应②均为吸热反应,即ΔH1>0,ΔH2>0,且ΔH1>ΔH2,D项正确。
15.D 钠合金若含有重金属,则电池废弃处理时会造成土壤或水体污染,A项正确;根据该电池放电原理图,可知放电时左室发生还原反应Na0.44MnO2+0.56e-+0.56Na+===NaMnO2,则该室层状晶体为正极,Na+由右室移向左室,B项正确,C项正确;充电时阴极反应为Na++e-===Na,因此阴极质量变化4.6 g时,生成0.2 mol Na,外电路中通过0.2 mol电子,D项错误。
16.答案:Ⅰ.(1)2MnO+16H++10Cl-===2Mn2++5Cl2↑+8H2O(2分)
(2)HCl(2分) 抑制AlCl3水解(1分)
(3)吸收未反应完的Cl2,防止空气中的水蒸气进入甲中(2分)
Ⅱ.(1)直形冷凝管(1分) 水浴加热(1分)
(2)下层(1分) Br2+2HCO===Br-+BrO-+2CO2↑+H2O(2分)
(3)过滤(2分)
解析:Ⅰ.(1)KMnO4和浓盐酸反应的离子方程式为2MnO+16H++10Cl-===2Mn2++5Cl2↑+8H2O。
(2)由AlCl3·6H2O制备AlCl3,只需使AlCl3·6H2O受热失去结晶水,通入HCl可防止AlCl3水解。
(3)因Cl2有毒,无水AlCl3极易潮解,所以乙中碱石灰的作用是吸收未反应完的Cl2且防止空气中的水蒸气进入甲中。
Ⅱ.(1)仪器a是直形冷凝管;当反应温度低于100 ℃时,可以采取水浴加热的方式,有利于控制温度,且使反应体系受热均匀。
(2)间溴苯甲醛密度比水大,有机相在下层;HCO水解使溶液呈碱性,Br2在碱性条件下发生歧化反应,反应的离子方程式为Br2+2HCO===Br-+BrO-+2CO2↑+H2O。
(3)无水MgSO4固体的作用是吸收有机相中的水,固液分离的操作是过滤。
17.答案:(1)Cl2+2I-===I2+2Cl-(2分)
(2)I2+SO+H2O===SO+2I-+2H+(2分)
(3)氧化(2分) (4)Fe3I8(2分)
(5)Fe3I8+8NaHCO3===Fe3O4+8NaI+8CO2↑+4H2O(2分)
解析:(1)“将少量氯水加入到NaI溶液中”的实验产生了含碘废液,故离子方程式为Cl2+2I-===I2+2Cl-。(2)反应①中I2与Na2SO3溶液反应,I2被还原为I-,SO被氧化为SO,离子方程式为I2+SO+H2O===SO+2I-+2H+。(3)CuI与浓硝酸反应后,经过一系列操作得到了碘片,可知反应③中CuI发生氧化反应。(4)分析题给流程可知,含铁化合物B是一种含有铁元素和碘元素的化合物,该化合物中铁元素与碘元素物质的量之比为38,则含铁化合物B的化学式为Fe3I8。(5)向含铁化合物B(Fe3I8)中加入碳酸氢钠溶液,生成的黑色固体为四氧化三铁,无色气体为二氧化碳,反应的化学方程式为Fe3I8+8NaHCO3===Fe3O4+8NaI+8CO2↑+4H2O。
18.答案:(1)CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-49.5 kJ·mol-1(2分)
(2)温度(2分) L1>L2,反应Ⅱ是气体分子数减少的反应,当温度一定时,增大压强,平衡正向移动,二甲醚的平衡产率增大(3分)
(3)①3a×40%×76%(2分) ②反应Ⅰ的ΔH>0,反应Ⅱ的ΔH<0,温度升高使CO2转化为CO的平衡转化率上升,使CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅度(3分)
解析:(1)根据盖斯定律,由(反应Ⅱ-反应②)×,可得反应①CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=(-122.5+23.5)kJ·mol-1×=-49.5 kJ·mol-1。(2)根据题图1可知,L一定时,增大X,二甲醚的平衡产率降低,即平衡逆向移动。因反应Ⅱ是气体分子数减少的放热反应,其他条件一定时,增大压强,平衡正向移动,其他条件一定时,升高温度,平衡逆向移动,故X代表温度,L代表压强。温度相同时,L1对应的二甲醚的平衡产率比L2对应的大,根据上述分析可知L1>L2。(3)①根据题图2可知,t ℃时,CO2平衡转化率为40%,CH3OCH3的选择性为76%,故反应Ⅱ消耗的CO2的物质的量为a mol×40%×76%,则消耗H2的物质的量为3a mol×40%×76%。②CO2的平衡转化率是综合反应Ⅰ和反应Ⅱ的平衡转化率,反应Ⅰ的ΔH>0,反应Ⅱ的ΔH<0,温度高于300 ℃,升高温度时,反应Ⅰ平衡正向移动,反应Ⅱ平衡逆向移动,即温度升高使CO2转化为CO的平衡转化率上升,使CO2转化为CH3OCH3的平衡转化率下降,且上升幅度超过下降幅度。
19.答案:(除标明外,每空2分)(1)1s22s22p63s23p63d104s1(1分)
(2)O>C>H
(3)①N2(1分) ②sp3 ③或
(4)4
解析:(1)根据元素X的基态原子中的电子共有7个能级,且最外层电子数为1,内层轨道全部排满电子,结合构造原理,可推知X为Cu,电子排布式为1s22s22p63s23p63d104s1。(2)根据同周期主族元素从左到右,电负性逐渐增大以及CH4、H2O中H均显+1价,可知电负性:O>C>H。(3)①与CO互为等电子体的分子为N2。②根据题图1知,每个Cl和Cu形成了1个共价键、1个配位键,其还存在2对孤对电子,即每个Cl形成了4个杂化轨道,故其杂化方式为sp3。③每个Cu与周围的CO、H2O、Cl形成三个配位键,Cu提供空轨道,CO、H2O、Cl提供孤对电子,据此作图。(4)该晶胞中,Cl-位于体内,个数为4,Cu+位于8个顶点和6个面心,个数为8×+6×=4,根据1个Cl-周围距离最近的Cu+有4个,可知1个Cu+周围距离最近的Cl-有4个。设晶胞的边长为x pm,则x=4a,x=2a,该晶胞的质量为 g=ρ g·cm-3×(2a×10-10 cm)3,解得NA=。
20.答案:(1)羟基(1分) (2)3(1分)
(3)CH2===CH2+Br2―→BrCH2—CH2Br(2分)
(4) (2分)
(5)②③⑤⑧(2分)
(6) (2分)
(7)有机碱三乙胺能与反应⑧的生成物HCl发生反应,使合成J的平衡右移(2分)