- 352.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学实验基础知识
1.下列实验操作能达到实验目的的是( )
A.配制稀硫酸时,用10 mL量筒量取5.45 mL浓硫酸
B.用稀硝酸清洗H2还原CuO后内壁附有Cu和Cu2O的试管
C.将C与浓H2SO4反应产生的气体通入澄清石灰水检验CO2
D.配制FeCl3溶液时,将FeCl3溶于热水中,冷却后加水稀释
解析:A.10 mL量筒只能精确到0.1 mL, A错误;B.Cu和Cu2O都能被稀硝酸氧化而溶解,可用稀硝酸清洗, B正确;C.反应产生的气体中含有SO2,也能使澄清石灰水变浑浊,会干扰CO2的检验,C错误;D.热水会促进FeCl3水解,不能用热水来配制FeCl3溶液,D错误。
答案:B
2.下列说法或做法错误的是( )
A.不能将Fe(NO3)2溶液和稀硫酸同时倒入废液缸中
B.用汽油洗涤衣服上的油渍,其理论依据是萃取原理
C.做一次完整的中和热测定实验,温度计至少需使用3次
D.实验中用到的酸性高锰酸钾溶液一般用盐酸酸化
解析:A.不能将Fe(NO3)2溶液和稀硫酸同时倒入废液缸中,否则会发生氧化还原反应生成铁离子、水和NO, NO会污染大气,A正确;B.用汽油洗涤衣服上的油渍,其理论依据是萃取原理,B正确;C.中和热测定实验中需要温度计测量酸、碱和反应后的最高温度三次,C正确;D.实验中用到的酸性高锰酸钾溶液一般用稀硫酸酸化,酸性高锰酸钾溶液能氧化盐酸生成氯气,D错误。
答案:D
3.下列有关物质分离和除杂的叙述正确的是( )
A.用萃取分液的方法除去酒精中的水
B.由于KNO3的溶解度大,故可用重结晶法除去KNO3中混有的NaCl
C.用分液漏斗、烧杯、蒸馏水,可完成分离Br2和CCl4混合物的实验
D.通入足量饱和NaHCO3溶液中可除去CO2气体中SO2杂质
解析:A.由于酒精和水是互溶的,所以萃取分液不能除去酒精中的水,可加入CaO后进行蒸馏来除去酒精中的水,故A错误;B.用重结晶法除去KNO3
中混有的NaCl,是因为KNO3的溶解度随温度升高而增大的快,而NaCl的溶解度随温度升高而变化不大,故B错误;C.由于Br2在CCl4中溶解度大,而在水中溶解度小,所以用分液漏斗、烧杯、蒸馏水,不能分离Br2和CCl4混合物,故C错误;D.由于亚硫酸的酸性强于碳酸,所以SO2可与NaHCO3溶液反应,而CO2则不能反应,故可用饱和NaHCO3溶液除去CO2气体中的SO2杂质,即D正确。
答案:D
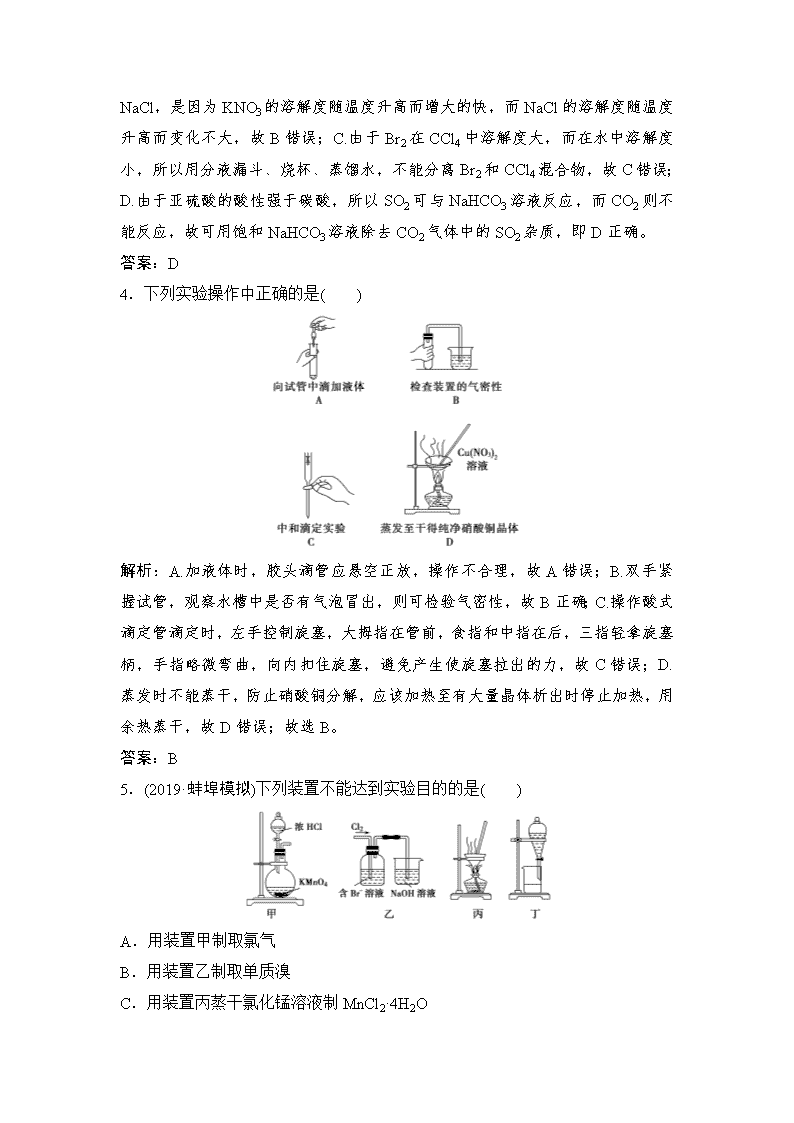
4.下列实验操作中正确的是( )
解析:A.加液体时,胶头滴管应悬空正放,操作不合理,故A错误;B.双手紧握试管,观察水槽中是否有气泡冒出,则可检验气密性,故B正确;C.操作酸式滴定管滴定时,左手控制旋塞,大拇指在管前,食指和中指在后,三指轻拿旋塞柄,手指略微弯曲,向内扣住旋塞,避免产生使旋塞拉出的力,故C错误;D.蒸发时不能蒸干,防止硝酸铜分解,应该加热至有大量晶体析出时停止加热,用余热蒸干,故D错误;故选B。
答案:B
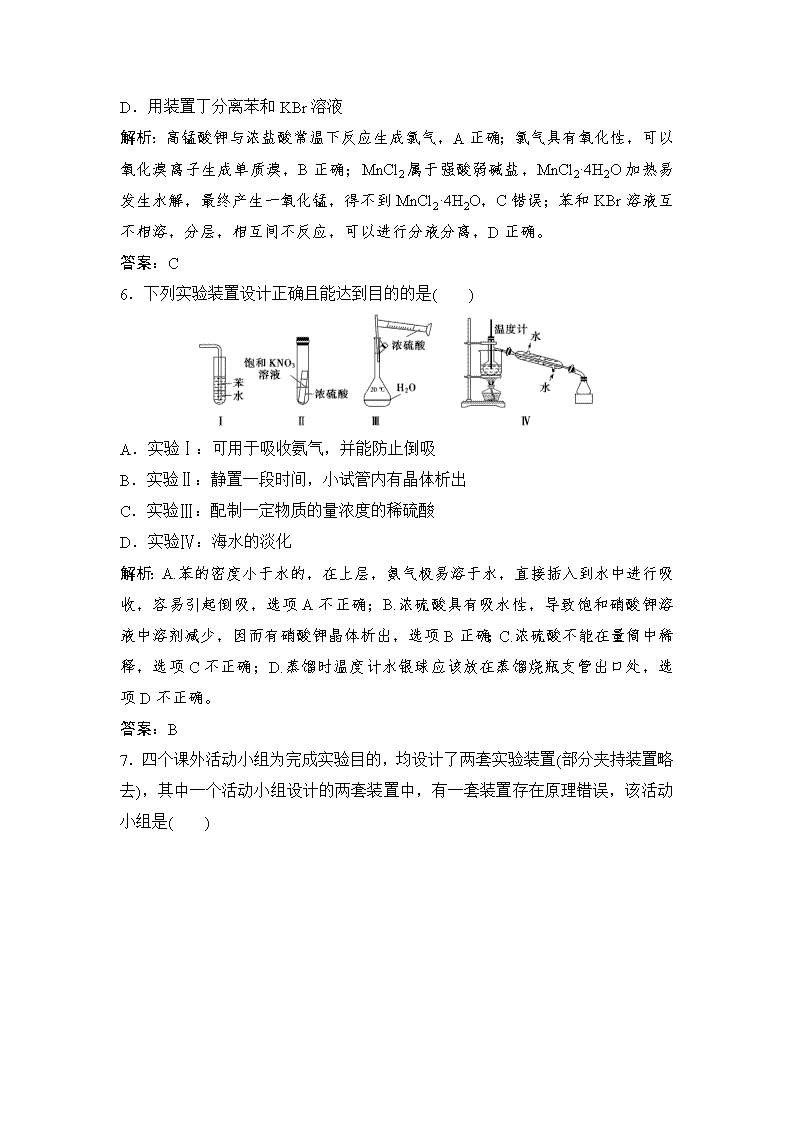
5.(2019·蚌埠模拟)下列装置不能达到实验目的的是( )
A.用装置甲制取氯气
B.用装置乙制取单质溴
C.用装置丙蒸干氯化锰溶液制MnCl2·4H2O
D.用装置丁分离苯和KBr溶液
解析:高锰酸钾与浓盐酸常温下反应生成氯气,A正确;氯气具有氧化性,可以氧化溴离子生成单质溴,B正确;MnCl2属于强酸弱碱盐,MnCl2·4H2O加热易发生水解,最终产生一氧化锰,得不到MnCl2·4H2O,C错误;苯和KBr溶液互不相溶,分层,相互间不反应,可以进行分液分离,D正确。
答案:C
6.下列实验装置设计正确且能达到目的的是( )
A.实验Ⅰ:可用于吸收氨气,并能防止倒吸
B.实验Ⅱ:静置一段时间,小试管内有晶体析出
C.实验Ⅲ:配制一定物质的量浓度的稀硫酸
D.实验Ⅳ:海水的淡化
解析:A.苯的密度小于水的,在上层,氨气极易溶于水,直接插入到水中进行吸收,容易引起倒吸,选项A不正确;B.浓硫酸具有吸水性,导致饱和硝酸钾溶液中溶剂减少,因而有硝酸钾晶体析出,选项B正确;C.浓硫酸不能在量筒中稀释,选项C不正确;D.蒸馏时温度计水银球应该放在蒸馏烧瓶支管出口处,选项D不正确。
答案:B
7.四个课外活动小组为完成实验目的,均设计了两套实验装置(部分夹持装置略去),其中一个活动小组设计的两套装置中,有一套装置存在原理错误,该活动小组是( )
解析:A.Zn与稀硫酸反应的化学方程式为Zn+H2SO4===ZnSO4+H2↑,属于固体+液体―→气体。H2难溶于水,可用排水法收集H2,两套装置都可以;B.CH4的密度比空气小,可用向下排空气法收集CH4,两套装置都可以;C.CaO与浓氨水作用可产生NH3,属于固体+液体―→气体,前一套装置可以,NH4Cl受热分解成NH3和HCl,NH3和HCl在试管口会重新化合成NH4Cl,NH4Cl直接受热分解不能制得NH3,后一套装置原理错误,不能制得NH3;D.HCl极易溶于水,HCl与H2O可形成喷泉,前一套装置引发喷泉的操作:打开止水夹,用热毛巾焐热圆底烧瓶,后一套装置引发喷泉的操作:打开止水夹,将胶头滴管中的水挤入圆底烧瓶中,两套装置都可以。
答案:C
8.利用下列实验装置进行相应的实验,不能达到实验目的的是( )
A.利用图甲装置,可快速制取氨气
B.利用图乙装置,用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液
C.利用图丙,可验证增加反应物浓度对化学平衡的影响
D.利用图丁装置,可说明浓H2SO4具有脱水性、强氧化性,SO2
具有漂白性、还原性
解析:浓氨水与生石灰混合可制备氨气,则图中固液装置可制备氨气,A正确;饱和碳酸钠溶液与乙醇互溶,与乙酸乙酯分层,则图中分液装置可分离,B正确;硫氰化钾溶液与氯化铁反应的本质:Fe3++3SCN-Fe(SCN)3,所以加入氯化钾饱和溶液,对该平衡无影响,C错误;浓硫酸使蔗糖脱水后,C与浓硫酸反应生成二氧化碳、二氧化硫,二氧化硫使品红褪色,与高锰酸钾发生氧化还原反应,则图中装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性,D正确。
答案:C
9.(2019·济南模拟)下列实验操作或现象正确且能达到实验目的的是( )
选项
实验目的
实验操作或现象
A
证明AgI的Ksp小于AgCl的Ksp
向两份相同的银氨溶液中分别滴加2滴等浓度的NaCl和NaI溶液,一份中产生黄色沉淀,另一份无明显现象
B
除去CO2中少量的SO2
将混合气体通过饱和Na2CO3溶液
C
证明溶液中含有Fe2+
向某溶液中先滴加氯水,再滴加少量KSCN溶液,溶液变成红色
D
清洗用KMnO4制备O2的试管中残留的MnO2
用稀盐酸清洗并用酒精灯加热试管
解析:A.向两份相同的银氨溶液中分别滴加2滴等浓度的NaCl和NaI溶液,一份中产生黄色沉淀,另一份无明显现象,证明AgI的Ksp小于AgCl的Ksp,A正确;B.Na2CO3溶液也能吸收CO2,B不正确;C.向某溶液中先滴加氯水,再滴加少量KSCN溶液,溶液变成红色,不能证明原溶液中含有Fe2+,也可能本来就有Fe3+,C不正确;D.清洗用KMnO4制备O2的试管中残留的MnO2,用浓盐酸清洗并用酒精灯加热试管,D不正确。
答案:A
10.除去下列物质中的杂质(括号内为杂质),所选用的除杂试剂及分离方法或操作均正确的是( )
选项
物质
除杂试剂
分离方法或操作
A
BaCO3(BaSO4)
饱和Na2CO3溶液
搅拌、过滤
B
CO (CO2)
CuO粉末
通过灼热的CuO粉末
C
SO2[SO3(g) ]
饱和Na2SO3溶液
洗气
D
苯(Br2)
水
分液
解析:加入饱和Na2CO3溶液后,Qc (BaCO3)>Ksp (BaCO3),BaSO4转化成BaCO3沉淀,然后过滤,从而除去BaSO4,A正确;CO与CuO加热反应生成二氧化碳,没有除去杂质CO2,主要成分CO变为CO2,应该用氢氧化钠溶液进行洗气,B错误;SO2能够与饱和Na2SO3溶液反应生成亚硫酸氢钠,主要成分减少了,应该用浓硫酸或饱和亚硫酸氢钠溶液进行洗气除杂,C错误;溴在水中溶解度较小,不能达到除去溴的目的,应该用氢氧化钠溶液除去溴,然后分液,D错误。
答案:A
11.下列根据实验操作和现象所得出的结论正确的是( )
选项
实验操作及实验现象
结论
A
室温下,用pH试纸分别测定浓度为0.1 mol·L-1 NaClO溶液和0.1 mol·L-1 CH3COONa溶液的pH
比较HClO和CH3COOH的酸性强弱
B
向某溶液中滴加KSCN溶液,无明显现象,再滴加少量酸性高锰酸钾溶液,紫色褪去
溶液中含有Fe2+,不含Fe3+
C
取久置的Na2O2粉末,向其中滴加过量的盐酸,产生无色气体,此气体能使澄清石灰水变浑浊
Na2O2已经变质
D
向浓度均为0.1 mol·L-1 NaCl和Na2CrO4混合溶液中滴加0.1 mol·L-1 AgNO3溶液,先生成白色的AgCl沉淀
Ksp(AgCl)Ksp (Ag2CO3)
D
向KI溶液中加入少量苯,然后加入FeCl3溶液
有机层呈橙红色
还原性:Fe2+>I-
解析:A.氨气能使湿润的红色石蕊试纸变蓝色,由实验操作和现象可说明NO被还原为NH3,故A正确;B.将Fe(NO3)2样品溶于稀H2SO4后,酸性条件下,NO能把Fe2+氧化为Fe3+,滴加KSCN溶液变红,证明样品发生反应后的溶液中含有Fe3+,不能说明含有Fe2+,故B错误;C.溶度积常数小的物质先生成沉淀,浓度均为0.1 mol·L-1的Na2CO3和Na2S混合溶液中,滴入少量AgNO3溶液,产生黑色沉淀,说明Ksp(Ag2S)小于Ksp(Ag2CO3),故C错误;D.向KI溶液中加入少量苯,然后加入FeCl3溶液,使得有机层呈橙红色,说明氯化铁溶液将碘离子氧化生成了碘单质,也说明还原性:Fe2+H3BO3
B
向蔗糖溶液中加入稀硫酸并水浴加热,一段时间后再向混合液中加入新制备的Cu (OH)2悬浊液并加热
无红色沉淀
蔗糖未水解
C
将浸透了石蜡油的石棉放置在硬质试管底部,加入少量碎瓷片,并加强热,将生成的气体通入酸性高锰酸钾溶液
溶液褪色
石蜡油分解产物中含有不饱和烃
D
向1 mL 2 mol/L的NaOH溶液中,滴加1~2滴1 mol/L MgCl2溶液,再滴加2滴1 mol/L FeCl3溶液
先有白色沉淀,后有红褐色沉淀
Ksp:Mg(OH)2>Fe(OH)3
解析:A.将少量的饱和硼酸溶液滴加到碳酸钠溶液中,没有气体生成,但不是用足量的硼酸,无法证明H2CO3>H3BO3,选项A错误;B.蔗糖溶液加稀硫酸,水浴加热一段时间后,加入NaOH溶液来中和催化剂,再加新制备的Cu(OH)2悬法液,加热煮沸,来证明蔗糖水解后产生葡萄糖,选项B错误;C.将浸透了石蜡油的石棉放置在硬质试管底部,加入少量碎瓷片,并加强热,将生成的气体通入酸性高锰酸钾溶液,溶液褪色,证明石蜡油分解产物中含有不饱和烃,选项C正确;D.氢氧化钠过量,与氯化铁继续反应产生沉淀而不一定是氢氧化镁转化为氢氧化铁,无法证明一定是Ksp:Mg(OH)2>Fe(OH)3,选项D错误。
答案:C