- 288.81 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
仿真模拟冲刺标准练 (三 )
本试题卷满分 100 分,考试时间 90 分钟。
可能用到的相对原子质量: H—1, C—12,O—16,Mg —24,Al —27, Cr—52
一、选择题:本题共 10 小题,每小题 2 分,共 20 分。每小题只有一个选项符合题意。
1.化学与生活、生产密切相关。下列物质的性质和应用均正确且有对应关系的是 ( )
选项 物质的性质 应用
A 苏打无毒且溶液显碱性 作食用碱
B 二氧化硫具有漂白性 作葡萄酒的防腐剂
C FeCl3 具有氧化性 作自来水的杀菌消毒剂
D 单晶硅能传导光信号 制太阳能电池
2.NA 为阿伏加德罗常数的值。下列说法正确的是 ( )
A.0.2 g H 218O 与 D 216O 的混合物中所含中子数为 0.1NA
B.标准状况下, 11.2 L 臭氧所含质子数为 8NA
C.20 mL 0.1 mol ·L -1AlCl 3 溶液中,水解形成的 Al(OH) 3 胶体粒子数为 0.002NA
D.0.5 mol H 2 和 0.5 mol I 2 在加热条件下充分反应,生成 HI 的分子数为 NA
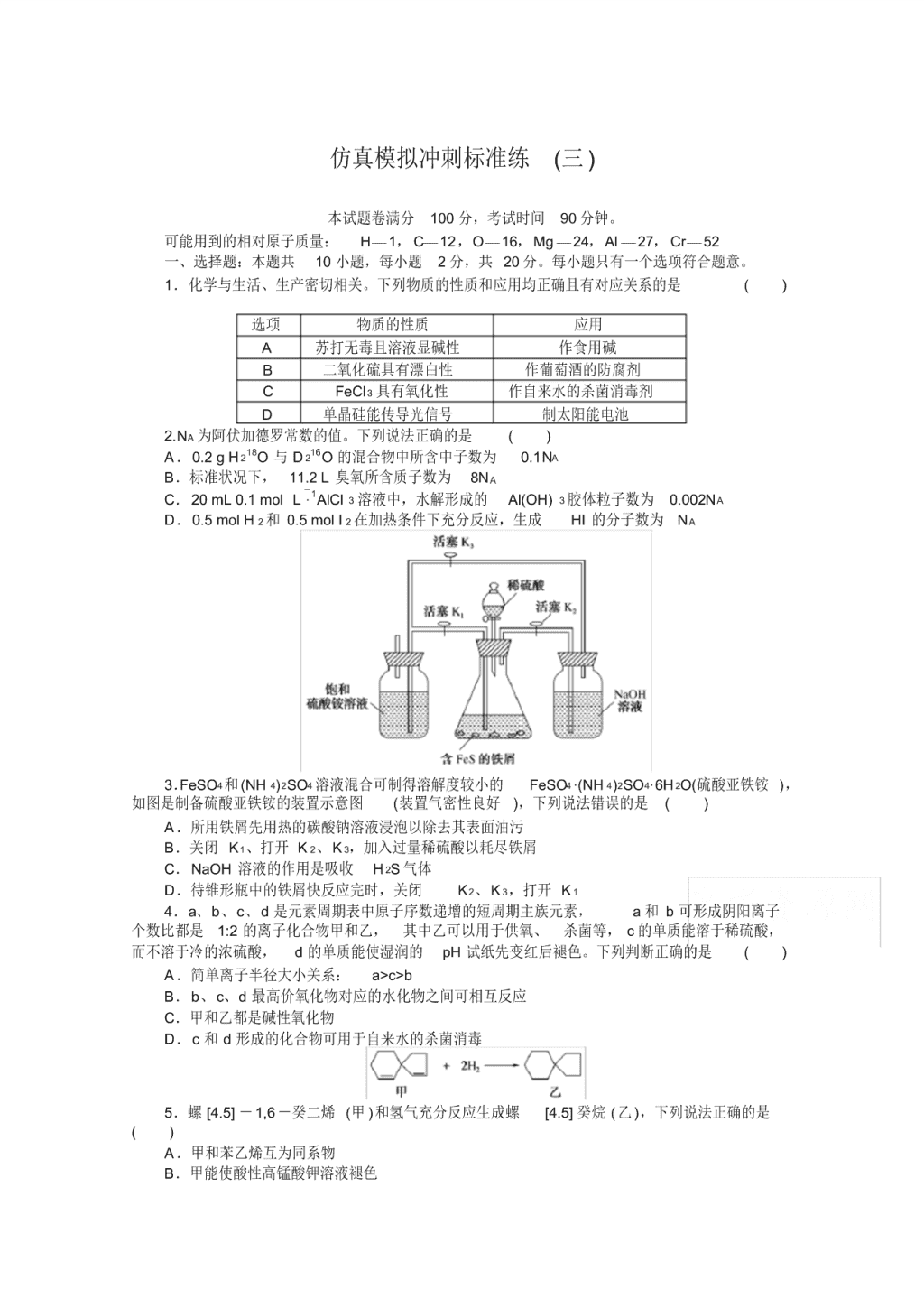
3.FeSO4和 (NH 4)2SO4 溶液混合可制得溶解度较小的 FeSO4·(NH 4)2SO4·6H 2O(硫酸亚铁铵 ),
如图是制备硫酸亚铁铵的装置示意图 (装置气密性良好 ),下列说法错误的是 ( )
A.所用铁屑先用热的碳酸钠溶液浸泡以除去其表面油污
B.关闭 K1、打开 K 2、K 3,加入过量稀硫酸以耗尽铁屑
C.NaOH 溶液的作用是吸收 H 2S 气体
D.待锥形瓶中的铁屑快反应完时,关闭 K2、K 3,打开 K 1
4.a、b、c、d 是元素周期表中原子序数递增的短周期主族元素, a 和 b 可形成阴阳离子
个数比都是 1:2 的离子化合物甲和乙, 其中乙可以用于供氧、 杀菌等, c 的单质能溶于稀硫酸,
而不溶于冷的浓硫酸, d 的单质能使湿润的 pH 试纸先变红后褪色。下列判断正确的是 ( )
A.简单离子半径大小关系: a>c>b
B.b、c、d 最高价氧化物对应的水化物之间可相互反应
C.甲和乙都是碱性氧化物
D.c 和 d 形成的化合物可用于自来水的杀菌消毒
5.螺 [4.5] -1,6-癸二烯 (甲 )和氢气充分反应生成螺 [4.5] 癸烷 (乙),下列说法正确的是
( )
A.甲和苯乙烯互为同系物
B.甲能使酸性高锰酸钾溶液褪色
C.1 mol 乙完全燃烧最多消耗 O2 12.5 mol
D.乙的一氯代物共有 6 种
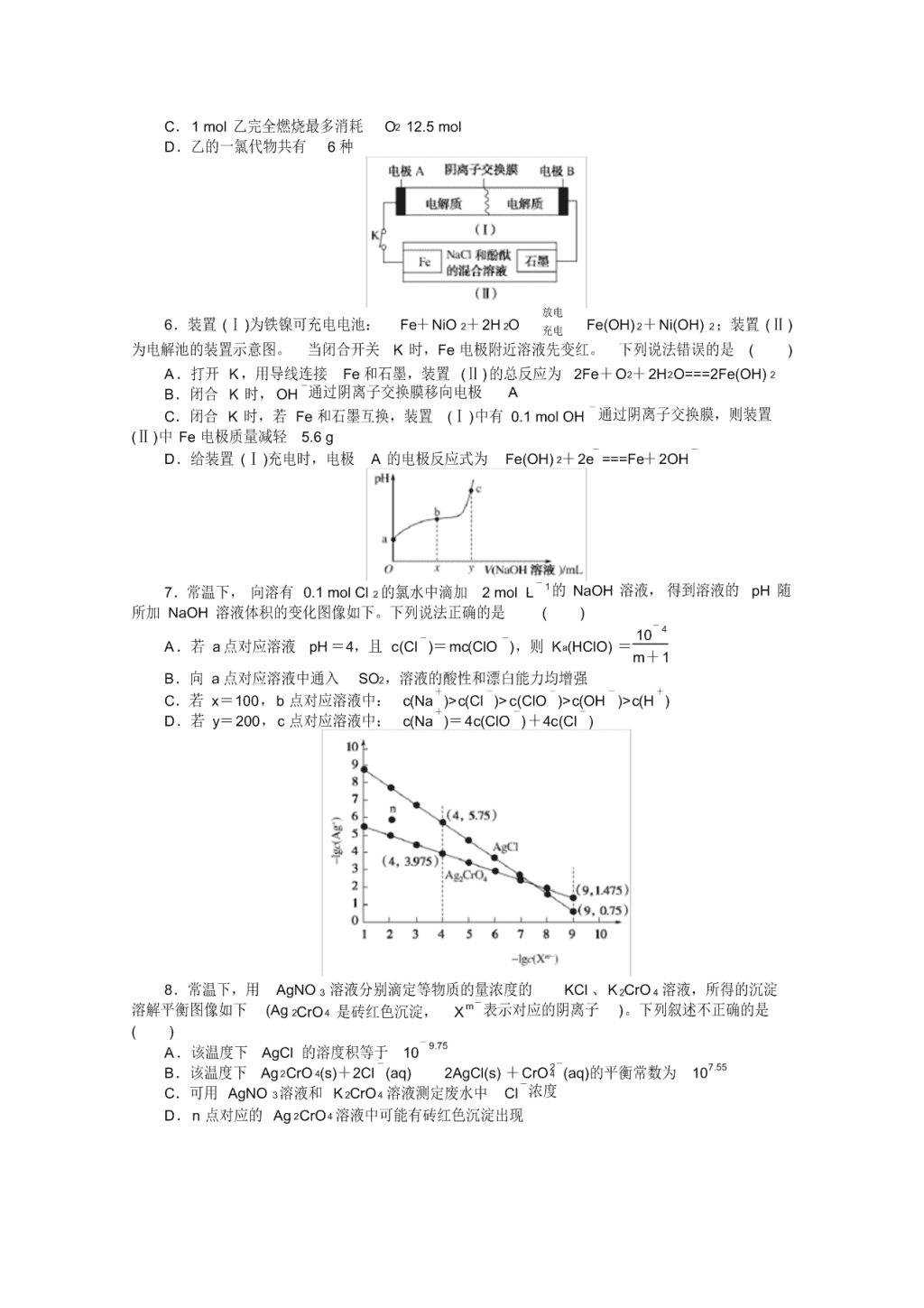
6.装置 (Ⅰ)为铁镍可充电电池: Fe+NiO 2+2H 2O
放电
充电 Fe(OH) 2+Ni(OH) 2;装置 (Ⅱ)
为电解池的装置示意图。 当闭合开关 K 时, Fe 电极附近溶液先变红。 下列说法错误的是 ( )
A.打开 K,用导线连接 Fe 和石墨,装置 (Ⅱ)的总反应为 2Fe+O2+2H2O===2Fe(OH) 2
B.闭合 K 时, OH -通过阴离子交换膜移向电极 A
C.闭合 K 时,若 Fe 和石墨互换,装置 (Ⅰ)中有 0.1 mol OH - 通过阴离子交换膜,则装置
(Ⅱ)中 Fe 电极质量减轻 5.6 g
D.给装置 (Ⅰ)充电时,电极 A 的电极反应式为 Fe(OH) 2+2e-
===Fe+2OH -
7.常温下, 向溶有 0.1 mol Cl 2 的氯水中滴加 2 mol ·L - 1的 NaOH 溶液, 得到溶液的 pH 随
所加 NaOH 溶液体积的变化图像如下。下列说法正确的是 ( )
A.若 a 点对应溶液 pH =4,且 c(Cl -)=mc(ClO -),则 Ka(HClO) =
10- 4
m+1
B.向 a 点对应溶液中通入 SO2,溶液的酸性和漂白能力均增强
C.若 x=100,b 点对应溶液中: c(Na +
)>c(Cl -
)>c(ClO -
)>c(OH -
)>c(H +
)
D.若 y=200,c 点对应溶液中: c(Na +
)=4c(ClO -
)+4c(Cl -
)
8.常温下,用 AgNO 3 溶液分别滴定等物质的量浓度的 KCl 、K 2CrO 4 溶液,所得的沉淀
溶解平衡图像如下 (Ag 2CrO 4 是砖红色沉淀, X m-表示对应的阴离子 )。下列叙述不正确的是
( )
A.该温度下 AgCl 的溶度积等于 10
- 9.75
B.该温度下 Ag 2CrO 4(s)+2Cl -
(aq) 2AgCl(s) +CrO 2-
4 (aq)的平衡常数为 107.55
C.可用 AgNO 3溶液和 K 2CrO 4 溶液测定废水中 Cl -浓度
D.n 点对应的 Ag 2CrO 4 溶液中可能有砖红色沉淀出现
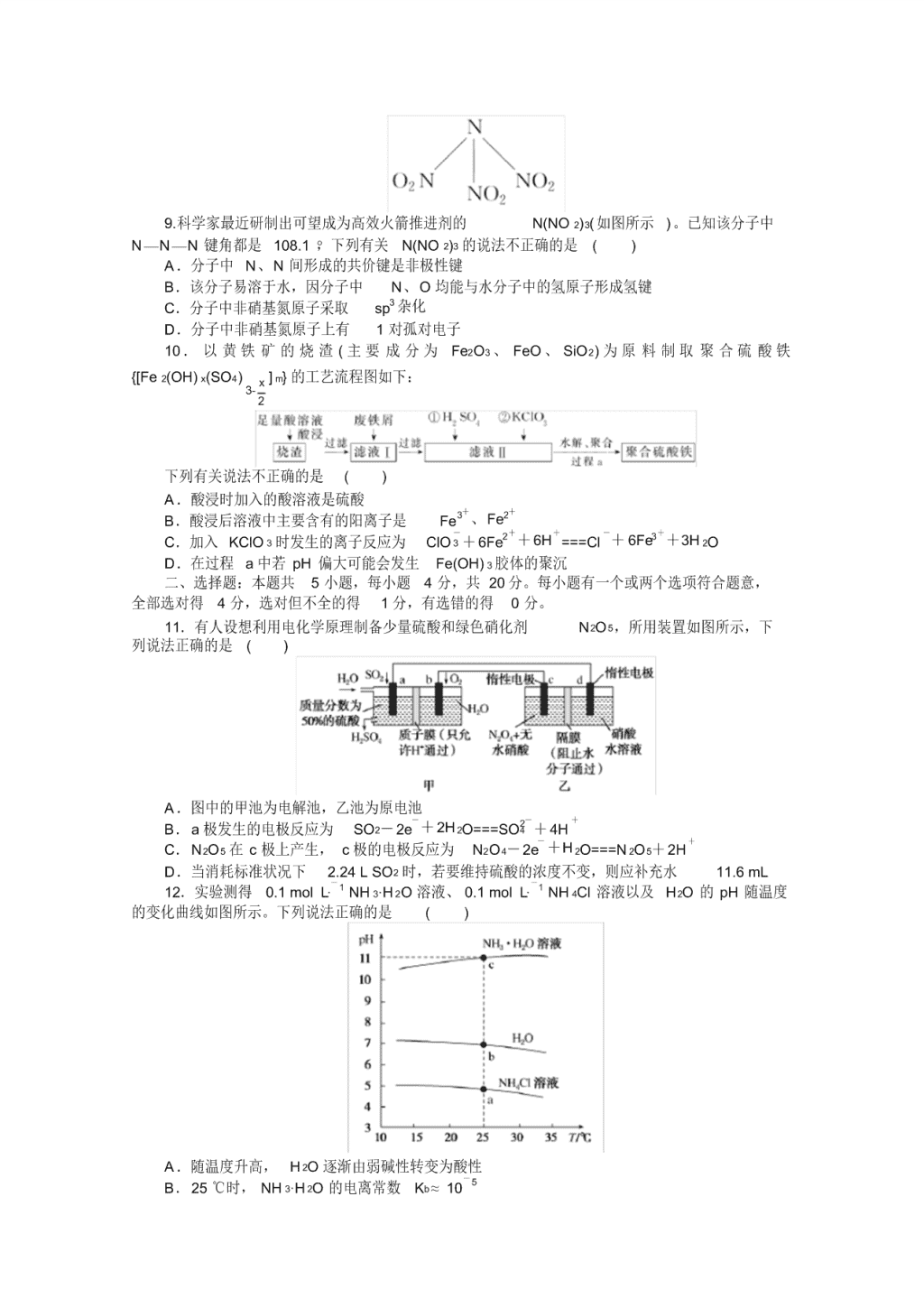
9.科学家最近研制出可望成为高效火箭推进剂的 N(NO 2)3(如图所示 )。已知该分子中
N—N—N 键角都是 108.1 °,下列有关 N(NO 2)3 的说法不正确的是 ( )
A.分子中 N、N 间形成的共价键是非极性键
B.该分子易溶于水,因分子中 N、O 均能与水分子中的氢原子形成氢键
C.分子中非硝基氮原子采取 sp3 杂化
D.分子中非硝基氮原子上有 1 对孤对电子
10 . 以 黄 铁 矿 的 烧 渣 ( 主 要 成 分 为 Fe2O3 、 FeO 、 SiO2) 为 原 料 制 取 聚 合 硫 酸 铁
{[Fe 2(OH) x(SO4)
3-
2
x ] m} 的工艺流程图如下:
下列有关说法不正确的是 ( )
A.酸浸时加入的酸溶液是硫酸
B.酸浸后溶液中主要含有的阳离子是 Fe3+、Fe2+
C.加入 KClO 3 时发生的离子反应为 ClO -
3 +6Fe2++6H+
===Cl -+ 6Fe3++3H 2O
D.在过程 a 中若 pH 偏大可能会发生 Fe(OH) 3 胶体的聚沉
二、选择题:本题共 5 小题,每小题 4 分,共 20 分。每小题有一个或两个选项符合题意,
全部选对得 4 分,选对但不全的得 1 分,有选错的得 0 分。
11.有人设想利用电化学原理制备少量硫酸和绿色硝化剂 N2O5,所用装置如图所示,下
列说法正确的是 ( )
A.图中的甲池为电解池,乙池为原电池
B.a 极发生的电极反应为 SO2-2e-+2H 2O===SO2-
4 +4H +
C.N2O5 在 c 极上产生, c 极的电极反应为 N2O4-2e- +H 2O===N 2O5+2H +
D.当消耗标准状况下 2.24 L SO2 时,若要维持硫酸的浓度不变,则应补充水 11.6 mL
12.实验测得 0.1 mol ·L -1 NH 3·H 2O 溶液、 0.1 mol ·L -1 NH 4Cl 溶液以及 H2O 的 pH 随温度
的变化曲线如图所示。下列说法正确的是 ( )
A.随温度升高, H 2O 逐渐由弱碱性转变为酸性
B.25 ℃时, NH 3·H 2O 的电离常数 Kb≈10-5
C.水的离子积常数: a 点= b 点= c 点
D.NH 3·H 2O 溶液和 NH 4Cl 溶液的 pH 随温度变化趋势不同,是因为平衡移动方向不同
13.室温下,向 20 mL 含 0.10 mol ·L -1 Cr2+和 0.10 mol·L -1 Fe2+的混合溶液中滴加 0.10
mol ·L -1 NaOH 溶液,金属阳离子浓度与滴入 NaOH 溶液体积的关系曲线如图所示。若溶液中
金属阳离子浓度小于 10-5 mol ·L -1 视为完全沉淀,则下列说法错误的是 [已知 Cr(OH) 2 的 K sp
为 2×10- 16, Fe(OH) 2 的 K sp 为 8×10-16]( )
A.曲线 A 表示 c(Fe2+
)
B.当 V(NaOH) =30 mL 时, Fe2+ 开始沉淀
C.当 pH=7 时,溶液中 Fe2+、Cr2+均完全沉淀
D.V(NaOH)>30 mL 时,溶液中 c(Fe2+
)/c(Cr2+
)=4.0
14.十氢萘 (C10H18)是一种优秀的液体储氢材料,其高压催化脱氢得到四氢萘 (C10H12),可
用于燃料电池汽车。已知:① C10H18(l) C10H12(l) + 3H 2(g) ΔH1,② C10H 12(l) C10H8(l)
+2H2(g) ΔH2。一定温度下, 在 1 L 恒容密闭容器中进行 C10H18(1.000 mol) 高压催化脱氢实验,
测得 C10H12 和 C10H8 的物质的量随反应时间的变化曲线如图 1 所示, 上述反应的“能量 —反应
过程”图像如图 2 所示。
下列有关说法正确的是 ( )
A.反应至 7 h 时, C10H 18 的转化率为 2.1%
B.反应至 7 h 时,反应体系中氢气的物质的量为 0.849 mol
C.反应①的活化能高于反应②的活化能
D.ΔH1>ΔH2>0
15.钠离子电池成本低、安全性好,有望在未来取代锂离子电池,某新型可充电钠离子
电池放电的工作原理如图所示。下列分析错误的是 ( )
A.出于环保考虑,应尽量避免使用重金属 (如 Pb)作为钠的合金化元素
B.放电时, Na+ 由右室移向左室
C.放电时,正极反应为: Na 0.44MnO 2+0.56e
-
+0.56Na +
===NaMnO 2
D.充电时,阴极质量变化 4.6 g 时,外电路中通过 0.1 mol e -
三、非选择题:本题共 5 小题,共 60 分。
16.(14 分)间溴苯甲醛常用作医药中间体,实验室以苯甲醛为原料,在无水 AlCl 3 催化下
加热制备间溴苯甲醛。
Ⅰ.催化剂的制备
如图 1 是实验室制取少量无水 AlCl 3 的相关实验装置。 已知无水氯化铝易升华, 极易潮解。
(1)若气体 A 是 Cl 2,且由 KMnO 4 和浓盐酸反应制取,该反应的离子方程式为
________________________________________________________________________ 。
(2) 若 固 体 B 是 AlCl 3·6H 2O , 则 气 体 A 是 ________ , 通 入 气 体 A 的 目 的 是
________________________________________________________________________
________________________________________________________________________ 。
(3) 若 气 体 A 为 Cl 2 , 乙 中 的 药 品 是 碱 石 灰 , 则 碱 石 灰 的 作 用 是
____________________________ 。
图 1 图 2
Ⅱ.间溴苯甲醛的制备
实验所用装置如图 2(夹持及加热装置已省略 ):
已知相关物质的沸点如下表所示:
物质 沸点 /℃
液溴 58.8
苯甲醛 179
1,2-二氯乙烷 83.5
间溴苯甲醛 229
实验步骤如下:
步骤 1:将一定配比的无水 AlCl 3、1,2-二氯乙烷和苯甲醛在三颈烧瓶中充分混合后,升
温至 60 ℃,缓慢滴加经浓硫酸干燥过的液溴,维持温度不变,反应一段时间后,冷却。
步骤 2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用
10%NaHCO 3 溶液洗涤。
步骤 3:往洗涤后的有机相中加入适量无水 MgSO 4 固体,放置一段时间后,进行下一操
作。
步骤 4:减压蒸馏有机相,收集相应馏分。
(1)仪器 a 的名称为 ________,本实验需要控制反应温度为 60 ℃,为了更好地控制反应温
度,宜采用的加热方式是 ________。
(2)步骤 2 分液时有机相处于 ________( 填“上层”或“下层” ),NaHCO 3 可以除去有机相
中的 Br2,反应中 1 mol Br 2参与反应,转移 1 mol 电子且产生无色气体,反应的离子方程式为
________________________________________________________________________ 。
(3)步骤 3 中将加入无水 MgSO 4 固体的有机相放置一段时间后,进行的下一操作是
________________________________________________________________________ 。
17.(10 分)“将少量氯水加入到 NaI 溶液中”的学生实验产生了大量含碘废液。 某研究小
组用该含碘废液制备 NaI 固体,实验流程如下: