- 421.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
吉林省长春市实验中学2019-2020高二下学期期中考试化学试卷
可能用到的相对原子质量:B-11 N -14 O-16 Na-23
第I卷 选择题(共60分)
一、选择题(每小题只有一个正确答案,本题包括30小题,每小题2分,共60分。)
1.中科院国家纳米科学中心科研员在国际上首次“拍”到氢键的“照片”,实现了氢键的实空间成像,为“氢键的本质”这一化学界争论了80多年的问题提供了直观证据。下列有关氢键说法中不正确的是( )
A.由于氢键的存在,冰能浮在水面上
B.由于氢键的存在,乙醇比甲醚更易溶于水
C.由于氢键的存在,沸点:HF>HCl>HBr>HI
D.由于氢键的存在,影响了蛋白质分子独特的结构
2.下列晶体中属于原子晶体的是( )
A.氖 B.食盐 C.干冰 D.金刚石
3.在多电子原子里,把电子运动的能量不同的区域简化为不连续的壳层称作为电子层。电子层模型被称为洋葱式结构,如图所示:
根据电子层模型,判断下列说法不正确的是( )
A.多电子原子的核外电子是分层运动的
B.所有电子在同一区域里运动
C.排在K、L、M层上的电子的能量依次增大
D.多电子原子里电子的能量不同
4.下列各组表述中,两个微粒一定不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子排布为1s22s22p63s23p2的原子
B.M层全充满而N层为4s2的原子和核外电子排布为1s22s22p63s23p63d64s2的原子
C.最外层电子数是核外电子总数的的原子和价电子排布为4s24p5的原子
D.2p能级有一个未成对电子的基态原子和价电子排布为2s22p5的原子
5. 电子总数或价电子总数相等、原子数也相同的分子或离子的空间构型是相同的,下列各组微粒空间构型不相同的是( )
A.CO2和NO2 B.CO2和N2O C.SO3和NO3- D.SO42-和ClO4-
6.已知X+、Y2+、Z–、W2–四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,不正确的是( )
A.离子半径﹕W2–>Z–>X+>Y2+
B.原子序数﹕Y>X>Z>W
C.原子最外层电子数﹕Y>X>Z>W
D.还原性﹕W2–>Z–
7.S2Cl2少量泄漏会产生窒息性气体,喷水雾可减慢其挥发,并产生酸性悬浊液,其分子结构与H2O2类似如图所示。下列关于S2Cl2的说法中错误的是( )
A.S2Cl2为极性分子
B.分子中既含有σ键又含有π键
C.与S2Br2结构相似,熔、沸点S2Br2>S2Cl2
D.与水反应的化学方程式为2S2Cl2+2H2O=SO2↑+3S↓+4HCl
8.下列叙述错误的是( )
A.C2H4分子中有键
B.CH4的中心原子是sp3杂化
C.HCl和HI化学键的类型和分子的极性都相同
D.价电子构型为3s23p4的粒子其基态原子在第三周期第ⅣA族
9.用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
A.直线形;三角锥形 B.V形;平面三角形
C.直线形;平面三角形 D.V形;三角锥形
10.Co3+的八面体配合物中配离子的空间构型如图所示,其中数字处的小圆圈表示NH3分子或Cl–,Co3+位于八面体的中心。若1 mol配合物与AgNO3作用生成2 mol AgCl沉淀,则的值是( )
A.2 B.3 C.4 D.5
11.有机物CH3CH==CH—C≡CH中标有“·”的碳原子的杂化方式依次为( )
A.sp、sp2、sp3 B.sp3、sp、sp2 C.sp2、sp、sp3 D.sp3、sp2、sp
12.关于化学式[TiCl(H2O)5]Cl2•H2O的配合物的下列说法中正确的是( )
A.配位体是Cl–和H2O,配位数是9
B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+
C.内界和外界中的Cl–的数目比是1:2
D.H2O的中心原子是sp2杂化
13.下列说法不正确的是( )
A.沸点:H2O>HF
B.NCl3、SiCl4分子中每个原子最外层均满足8电子结构
C.热稳定性:HF>H2O
D.仅由N、H、O三种元素形成的化合物中不可能含离子键
14.通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似,下列对NCl3和NH3的有关叙述正确的是( )
A.分子中N—Cl键键长与CCl4分子中C—Cl键键长相等
B.NCl3分子是非极性分子
C.NBr3比NCl3易挥发
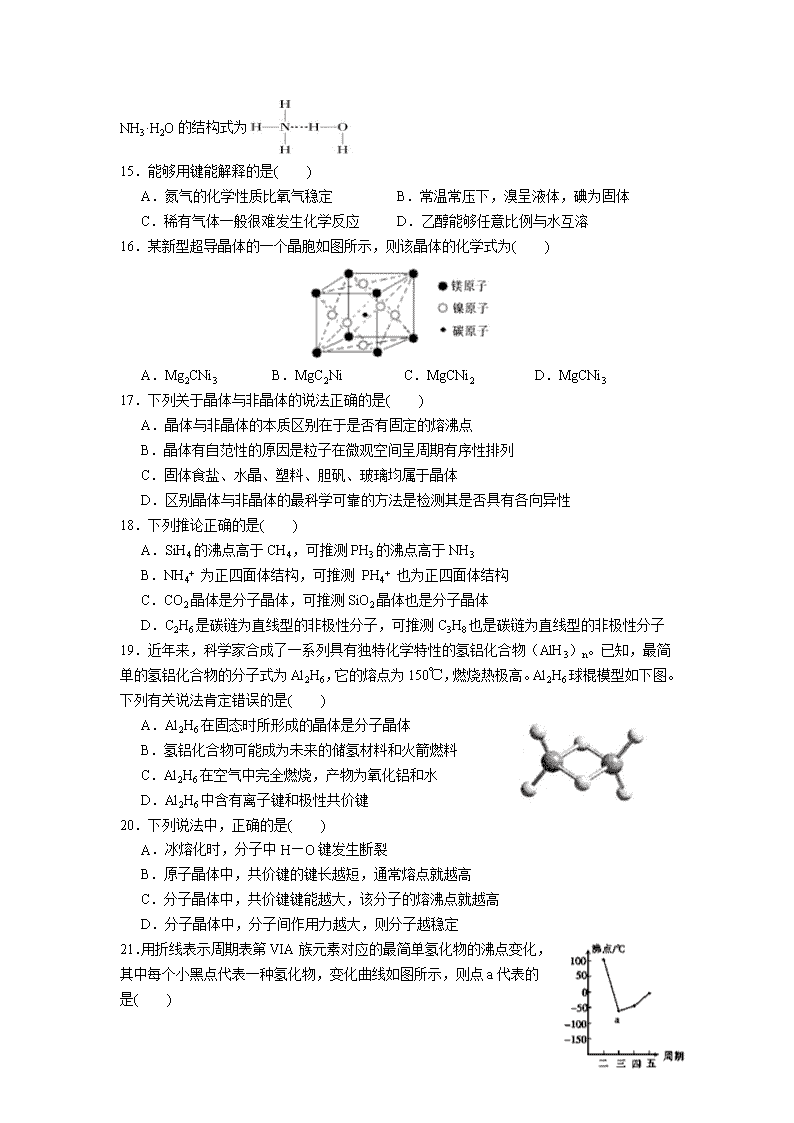
D.在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3·H2
O分子,则NH3·H2O的结构式为
15.能够用键能解释的是( )
A.氮气的化学性质比氧气稳定 B.常温常压下,溴呈液体,碘为固体
C.稀有气体一般很难发生化学反应 D.乙醇能够任意比例与水互溶
16.某新型超导晶体的一个晶胞如图所示,则该晶体的化学式为( )
A.Mg2CNi3 B.MgC2Ni C.MgCNi2 D.MgCNi3
17.下列关于晶体与非晶体的说法正确的是( )
A.晶体与非晶体的本质区别在于是否有固定的熔沸点
B.晶体有自范性的原因是粒子在微观空间呈周期有序性排列
C.固体食盐、水晶、塑料、胆矾、玻璃均属于晶体
D.区别晶体与非晶体的最科学可靠的方法是检测其是否具有各向异性
18.下列推论正确的是( )
A.SiH4的沸点高于CH4,可推测PH3的沸点高于NH3
B.NH4+ 为正四面体结构,可推测 PH4+ 也为正四面体结构
C.CO2晶体是分子晶体,可推测SiO2晶体也是分子晶体
D.C2H6是碳链为直线型的非极性分子,可推测C3H8也是碳链为直线型的非极性分子
19.近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n。已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高。Al2H6球棍模型如下图。下列有关说法肯定错误的是( )
A.Al2H6在固态时所形成的晶体是分子晶体
B.氢铝化合物可能成为未来的储氢材料和火箭燃料
C.Al2H6在空气中完全燃烧,产物为氧化铝和水
D.Al2H6中含有离子键和极性共价键
20.下列说法中,正确的是( )
A.冰熔化时,分子中H—O键发生断裂
B.原子晶体中,共价键的键长越短,通常熔点就越高
C.分子晶体中,共价键键能越大,该分子的熔沸点就越高
D.分子晶体中,分子间作用力越大,则分子越稳定
21.用折线表示周期表第VIA族元素对应的最简单氢化物的沸点变化,其中每个小黑点代表一种氢化物,变化曲线如图所示,则点a代表的是( )
A.H2O B.H2S
C.H2Se D.H2Te
22.下列叙述错误的是( )
A.晶体熔点的高低: B.硬度的大小:Mg>Ca>K
C.熔点的高低:Na>Mg>Al D.晶格能的大小:NaF>NaCl>NaBr>NaI
23.有四种不同堆积方式的金属晶体的晶胞如图所示,下列有关说法正确的是( )
A.①为简单立方堆积,②为六方最密堆积,③为体心立方堆积,④为面心立方最密堆积
B.每个晶胞含有的原子数分别为①1,②2,③2,④4
C.晶胞中原子的配位数分别为①6,②8,③8,④12
D.空间利用率的大小关系为①<②<③<④
24.下列数据是对应物质的熔点,据此做出的下列判断中错误的是( )
物质
Na2O
NaCl
AlF3
AlCl3
熔点℃
920
801
1291
190
物质
BCl3
Al2O3
CO2
SiO2
熔点℃
-107
2073
-57
1723
A.铝的化合物的晶体中不完全是离子晶体
B.同族元素的氧化物可形成不同类型的晶体
C.表中只有BCl3和干冰是分子晶体
D.不同族元素的氧化物可形成相同类型的晶体
25.右下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是( )
A.X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C.YX2晶体熔化、液态WX3气化均需克服分子间作用力
D.根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
26.下列叙述正确的是( )
A.N、O、F的电负性逐渐增大
B.Na、Mg、Al的第一电离能逐渐增大
C.碳原子的电子排布图:
D.铬原子的电子排布式:ls22s22p63s23p63d44s2
27.有关晶体的结构如图所示,下列说法中不正确的是( )
A.在NaCl晶体中,距Na+最近的Cl–形成正八面体
B.在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D.CaF2晶体在熔融状态不导电
28.第三周期,基态原子的第一电离能处于Al、P之间的元素有( )
A.1种 B.2种 C.3种 D.4种
29.卤化钠(NaX)和四卤化钛(TiX4)的熔点如图所示。下列判断不正确的是( )
A.TiCl4为共价化合物
B.NaX随 X– 半径增大,离子键减弱
C.NaX均为离子化合物
D.TiF4的熔点反常升高是由于氢键的作用
30.短周期W、X、Y、Z、Q五种元素的原子序数依次递增,W和Z位于同一主族。已知W的氢化物可与Q单质在光照条件下反应生成多种化合物,Y的氧化物是一种比较好的耐火材料,也是工业上冶炼Y的原料,短周期主族元素中X是原子半径最大的元素,下列说法不正确的是( )
A.X、Z的最高价氧化物相互化合,生成的产物可用作防火剂
B.电解X、Q元素组成的化合物的饱和溶液常被用于工业上制备X单质
C.W、X、Q三种元素都能形成多种氧化物
D.Y、Q形成的化合物是强电解质
第II卷 非选择题(共40分)
二、非选择题(本题包括3小题,共40分。)
31.(10分,每空1分)下面是C60、金刚石、二氧化碳和S8分子的模型。
S8
请回答下列问题:
(1)硅与碳同主族,写出硅原子基态时的核外电子排布式:_________________。
(2)从晶体类型来看,C60属于_________晶体。
(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上有________个原子;晶体硅中硅原子与共价键的个数比为__________。
(4)图丙是二氧化碳的晶胞模型,图中显示出的二氧化碳分子数为14个。实际上一个二氧化碳晶胞中含有________个二氧化碳分子,二氧化碳分子中键与键的个数比为 _______。
(5)S单质的常见形式为S8,其环状结构如上图所示,S原子采用的轨道杂化方式是______;
(6)Se和S同主族,H2Se的热稳定性比H2S_________(填“强”或“弱”)。气态SeO3分子的立体构型为_________________。
(7) H2SO4比 H2SO3酸性强的原因是_______________________________________________________________________________
32.(10分,每空1分,5、6、7空各2分)微量元素硼对植物的生长和人体骨骼的健康有着十分重要的作用。请回答下列问題:
(1)区分晶体硼和无定形硼最科学的方法为_________________________________。
(2)下列B原子基态的价层电子排布图中正确的是___________
A. B.
C. D.
(3)NaBH4是重要的储氢载体,阴离子的立体构型为___________。
(4)三硫化四磷分子(结构如下图1所示)是___________分子(填极性”或非极性)。
(5)图2表示多硼酸根离子的一种无限长的链式结构,其化学式可表示为___________。
(6)硼酸晶体是片层结构,其中一层的结构如图3所示。硼酸在冷水中溶解度很小,但在热水中较大,原因是_________________________________。
(7)立方氮化硼(BN)是新型高强度耐磨材料,可作为金属表面的保护层,其晶胞结构(如右图)与金刚石类似。已知该晶体密度为a g/cm3,则晶体中两个N原子间的最小距离为___________pm。(用含a的代数式表示,NA表示阿伏加德罗常数)
33.(20分,每空2分)
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6] (NO3)3 [三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
①基态Fe3+的M层电子排布式为_____________________________。
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_____。 Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于_________(填晶体类型);
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如右图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为___________。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长 a =_________cm。 (用含ρ、NA的计算式表示)
(3)下列有关的说法正确的是___________。
A.第一电离能大小:S>P>Si
B.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
C.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
D.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
(4)原子序数小于36的X、Y、Z、W四种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。回答下列问题:
① Y2X2分子中Y原子轨道的杂化类型为_______,1mol Y2X2含有σ键的数目为__________。
② 化合物ZX3的沸点比化合物YX4的高,其主要原因是____________。
③ 元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是______________________。
高二化学试卷答案
一、选择题(每个2分,共60分)
题号
1
2
3
4
5
6
7
8
9
10
答案
C
D
B
B
A
C
B
D
B
D
题号
11
12
13
14
15
16
17
18
19
20
答案
D
C
D
D
A
D
B
B
D
B
题号
21
22
23
24
25
26
27
28
29
30
答案
B
C
B
C
D
A
D
C
D
B
二、非选择题(共40分)
31. (10分,每空1分)
(1)1s22s22p63s23p2 (2)分子
(3) 12 ; 1:2 (4) 4 ; 1:1
(5)sp3 (6) 弱 ; 平面三角形
(7)中心元素S的正电性越高,对S-O-H中O原子的电子吸引越强,越易电离出H+
32. (10分,每空1分,5、6、7空各2分)
(1)X-射线衍射实验
(2)A
(3)正四面体
(4)极性
(5)BO2- 或 (BO2)nn- 或 BnO2nn-
(6)中硼酸分子间以氢键缔合在一起,难以溶解;加热时,晶体中部分氢键被破坏,硼酸分子与水分子形成氢键,溶解度增大
(7)
33.(20分,每空2分)
(1)①3s23p63d5 ② 5 分子晶体 (2) 立方体
(3)B (4)① sp杂化 3 NA或3×6.02×1023个 ②NH3分子间存在氢键 ③N2O