- 254.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高考非选择题五大题型突破
题型1 化学反应原理综合应用
(对应学生用书第98页)
■题型特点解读·
1.试题一般以新信息为载体,围绕某种元素的化合物展开,结合图形、图表信息,综合考查化学原理的知识,涉及化学反应中的能量变化、化学反应速率和平衡、溶液中的离子平衡、电化学、化学计算等。
2.试题篇幅较长,文字较多,题干特征是图像和表格交替出现,以图像为主;题给信息一般是较新颖的工业合成,信息量大,难度大;充分考查学生的接受信息能力、知识迁移运用能力、解决实际问题的能力及计算能力。
3.题目设问一般为4~5个小题,7~9个填空,出题风格相对稳定。
■解题策略指导·
1.审题“三读”
——明确有几个条件及求解的问题
↓
——把握关键字、词和数量关系等
↓
——要深入思考,挖掘隐含信息等
注意:“向细心要分、向整洁规范要分”。
2.审题要点
(1)准确分析题给信息,抓取有效信息。虽然题目在背景材料上呈现新(或陌生)内容,但对内在的要求或核心知识的考查不变,注意联系生产实际中的各类反应原理,融会贯通,就能解决所有问题。
(2)熟练掌握相关的思想、知识细节、生产原理、工艺设计原理,还有新时期对化学工业原理的新要求(如循环经济、原子经济、节能环保等方面的要求),在工业中的运用。
(3)总结思维的技巧和方法,答题时注意规范细致。该类题的问题设计一般没有递进性,故答题时可跳跃式解答,千万不能放弃。
■典例剖析示范·
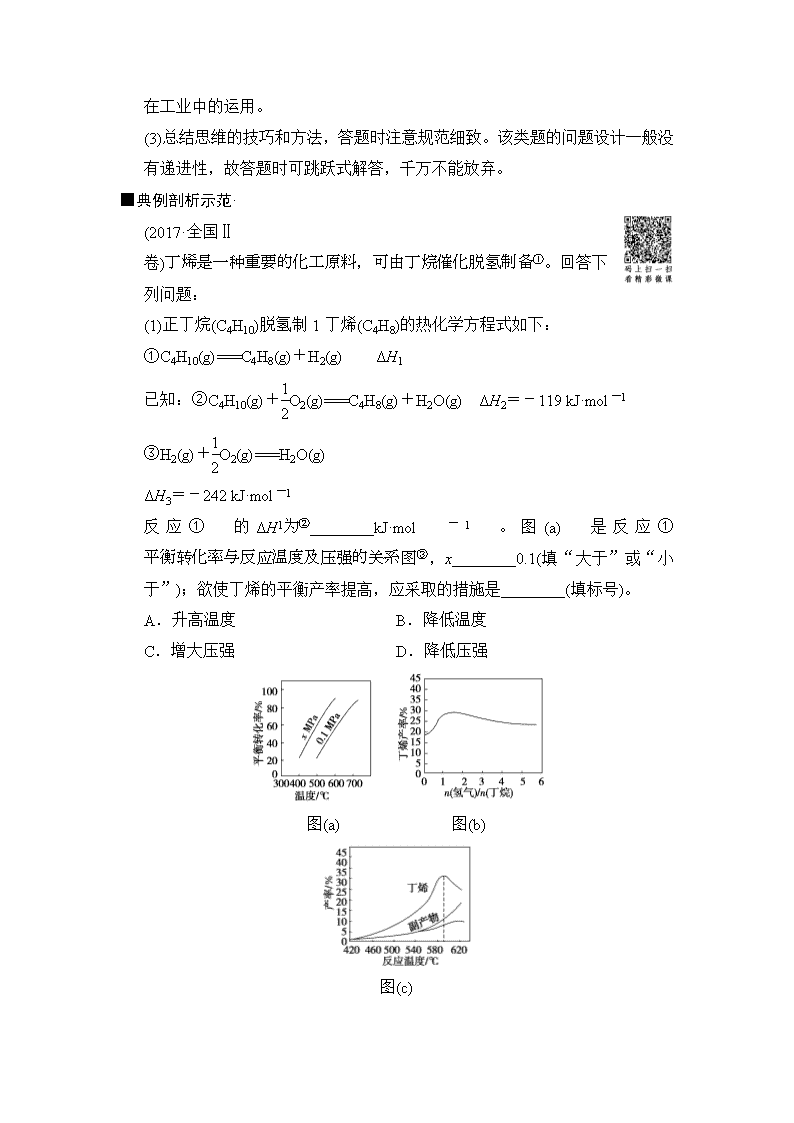
(2017·全国Ⅱ卷)①。回答下列问题:
(1)正丁烷(C4H10)脱氢制1丁烯(C4H8)的热化学方程式如下:
①C4H10(g)===C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+O2(g)===C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+O2(g)===H2O(g)
ΔH3=-242 kJ·mol-1
反应①的②________kJ·mol-1。图(a)是反应①③,x________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是________(填标号)。
A.升高温度 B.降低温度
C.增大压强 D.降低压强
图(a) 图(b)
图(c)
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。
④,其降低的原因是 ______________________________________________________。
(3)图(c)为反应产率和反应温度的关系曲线,⑤主要是高温裂解生成的短碳链烃类化合物。丁烯产率在⑤随温度升高而增大的原因可能是______________________________、________________________________;⑤,丁烯产率快速降低的主要原因可能是
________________________________________________________________。
①新情景、新信息:丁烯的制备原理。
②信息解读与理解:已知热化学方程式,可以利用盖斯定律解题。
③识图像:产率、温度、压强图像,温度升高,转化率增大;想规律:增大压强,平衡向气体体积减小的方向移动;得结论:减小压强,转化率升高。
④考应用能力:结合图像解决实际问题,n(氢气)/n(丁烷)的含义,图像中的最大值。
⑤新情景:副产物的产生原因;关键点:温度值。
【解析】 (1)由盖斯定律可知,①式=②式-③式,即ΔH1=ΔH2-ΔH3=-119 kJ/mol-(-242 kJ/mol)=123 kJ/mol。由图(a)可知,同温下,x MPa时丁烯的平衡产率高于0.1 MPa时的,根据压强减小平衡向右移动可知,x小于0.1。欲提高丁烯的平衡产率,应使平衡向右移动,该反应的正反应为吸热反应,因此可以通过升高温度的方法使平衡向右移动;该反应为气体体积增大的反应,因此可以通过降低压强的方法使平衡向右移动,所以A、D选项正确。
(2)由于氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速率增大,所以丁烯产率降低。
(3)该反应的正反应为吸热反应,因此升高温度可以使平衡向右移动,使丁烯的产率增大,另外,反应速率也随温度的升高而增大。由题意知,丁烯在高温条件下能够发生裂解,因此当温度超过590 ℃时,参与裂解反应的丁烯增多,而使产率降低。
【答案】 (1)123 小于 AD
(2)氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速率增大
(3)升高温度有利于反应向吸热方向进行 温度升高反应速率加快 丁烯高温裂解生成短链烃类
■即时应用体验·
1.乙硼烷(B2H6)、甲烷(CH4)、甲醇(CH3OH)、二甲醚(CH3OCH3)在化学工业上有广泛的用途。
请回答下列问题: 【导学号:97184289】
(1)乙硼烷与氧气反应的热化学方程式为B2H6(g)+3O2(g)===B2O3(s)+3H2O(g) ΔH=-2 033.8 kJ·mol-1。
乙硼烷有望成为导弹和火箭燃料的主要原因是________________________
_______________________________________________________________。
(2)我国科学家以甲烷为原料,在催化剂作用下一步高效生产重要化工原料苯,反应过程中碳原子的利用率为100%,写出该反应的化学方程式:________________________________________________________________,
该反应的原子利用率为________。
(3)甲醇合成反应:CO(g)+2H2(g)CH3OH(g) ΔH1=-90.1 kJ·mol-1,一定温度时,该反应的平衡常数Kp=4.80×10-2,向容器中充入2 mol H2和1 mol CO,反应达到平衡状态时,甲醇的分压p(CH3OH)=24.0 kPa,则平衡时,混合气体中CH3OH的物质的量分数约为________(Kp是用平衡分压代替平衡浓度所得的平衡常数,分压=总压×物质的量分数)。
(4)二甲醚合成反应:
Ⅰ.2CH3OH(g) CH3OCH3(g)+H2O(g)
ΔH2=-23.9 kJ·mol-1
Ⅱ.2CH3OH(g) C2H4(g)+2H2O(g)
ΔH3=-29.1 kJ·mol-1
二甲醚合成反应过程中两反应的能量变化如图所示。
①反应速率较大的是________(填“Ⅰ”或“Ⅱ”),原因是
_______________________________________________________________。
②若在容器中加入催化剂,则E2-E1将________(填“变大”“不变”或“变小”)。
(5)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为_______________________________________________________________。
根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响:_______________________________________________________________。
【解析】 (1)分析题给热化学方程式可知,乙硼烷的摩尔质量较小
(28 g·mol-1),且燃烧时放出大量的热[1 mol B2H6(g)完全反应时放出2 033.8 kJ热量],因此乙硼烷有望成为导弹和火箭的燃料。
(2)利用甲烷(CH4)为原料,在催化剂作用下生产苯,反应过程中碳原子的利用率为100%,结合原子守恒推知,反应中还产生H2,化学方程式为6CH4C6H6+9H2,该反应的原子利用率为×100%=81.25%。
(3)起始时充入2 mol H2和1 mol CO,设开始时H2的压强为2p kPa,CO的压强为p kPa,则有
CO(g)+ 2H2(g) CH3OH(g)
起始量/kPa p 2p 0
转化量/kPa 24.0 48.0 24.0
平衡量/kPa p-24.0 2p-48.0 24.0
该温度下平衡常数Kp===4.80×10-2,解得p=29.0,则平衡时,混合气体中CH3OH的物质的量分数为×
100%=×100%≈61.5%。
(4)①由二甲醚合成反应的能量变化图可知,反应Ⅰ的活化能低于反应Ⅱ的活化能,而在其他条件相同时,反应的活化能越低,反应速率越大,故反应Ⅰ的速率较大。
②使用催化剂能降低反应的活化能,从而加快反应速率,但不能改变化学反应的反应热,故加入催化剂,E2-E1的值不变。
(5)将热化学方程式CO(g)+2H2(g) CH3OH(g) ΔH1=-90.1 kJ·mol-1编号为Ⅲ,根据盖斯定律,由Ⅲ×2+Ⅰ可得:2CO(g)+4H2(g) CH3OCH3(g)+H2O(g),则有ΔH=2×(-90.1 kJ·mol-1)+
(-23.9 kJ·mol-1)=-204.1 kJ·mol-1。该反应的正反应为气体总分子数减小的放热反应,增大压强,平衡正向移动,H2和CO的转化率升高,二甲醚的产率增加。
【答案】 (1)乙硼烷的摩尔质量较小且燃烧放出大量的热
(2)6CH4C6H6+9H2 81.25%
(3)61.5%
(4)①Ⅰ 反应Ⅰ的活化能低,在相同条件下反应速率较大 ②不变
(5)2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) ΔH=-204.1 kJ·mol-1 该反应的正反应为气体总分子数减小的反应,压强升高使平衡右移,CO和H2的转化率升高,CH3OCH3的产率增加;压强升高使CO和H2的浓度增加,反应速率增大
2.煤的气化可生产水煤气,液化可生产CH3OH。已知制备甲醇的有关化学反应以及化学平衡常数如下表所示:
化学反应
平衡常数
(850 ℃)
反应热
(25 ℃、101 kPa)
Ⅰ.CO(g)+2H2(g) CH3OH(g)
K1=160
ΔH1=-90.8 kJ·mol-1
Ⅱ.H2(g)+CO2(g) H2O(g)+CO(g)
K2
ΔH2=-41.2 kJ·mol-1
Ⅲ.3H2(g)+CO2(g) CH3OH(g)+H2O(g)
K3=160
ΔH3
请回答下列问题: 【导学号:97184290】
(1)ΔH3=________,K2=________。
(2)850 ℃时,在密闭容器中进行反应Ⅲ,开始时只加入CO2、H2,反应10 min后测得各组分的浓度如下:
物质
H2
CO2
CH3OH
H2O
浓度/(mol·L-1)
0.2
0.2
0.4
0.4
①该时间段内的平均反应速率v(H2)=________。
②比较此时正、逆反应速率的大小:v正________v逆(填“>”“<”或“=”)。
③反应达到平衡后,保持其他条件不变,若只把容器的容积缩小一半,平衡________(填“逆向”“正向”或“不”)移动,平衡常数K3________(填“增大”“减小”或“不变”)。
(3)将CO与H2等物质的量投料进行反应Ⅰ,测得CO在不同温度下的平衡转化率与压强的关系如图所示。
下列说法正确的是________(填字母序号)。
A.平均摩尔质量:M(a)>M(c)、M(b)>M(d)
B.正反应速率:v(a)>v(c)、v(b)>v(d)
C.平衡常数:K(a)>K(c)、K(b)=K(d)
D.温度:T1>T2>T3
(4)850 ℃时,在容积为2 L的密闭容器中进行反应Ⅱ,同时充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2和n mol H2,若要使上述反应开始时向正反应方向进行,则n应满足的条件是________。
【解析】 (1)根据盖斯定律,由Ⅰ+Ⅱ可得反应Ⅲ:3H2(g)+CO2(g) CH3OH(g)+H2O(g),则有ΔH3=ΔH1+ΔH2=(-90.8 kJ·mol-1)+(-41.2 kJ·mol-1)=-132.0 kJ·mol-1。由于反应Ⅰ+Ⅱ=Ⅲ,则有K3=
K1·K2,从而可得K2==1。
(2)①反应Ⅲ为3H2(g)+CO2(g) CH3OH(g)+H2O(g),开始时,只加入CO2、H2,10 min时c(CH3OH)=0.4 mol·L-1,则有v(CH3OH)=
0.04 mol·L-1·min-1,v(H2)=3v(CH3OH)=0.12 mol·L-1·min-1。
②10 min时反应的浓度商Qc===100<K3=160,此时反应正向移动,则有v正>v逆。
③反应3H2(g)+CO2(g) CH3OH(g)+H2O(g)的正反应为气体总分子数减小的放热反应,将容器的容积缩小一半,压强增大,平衡正向移动;由于温度不变,则平衡常数K3不变。
(3)反应Ⅰ的正反应为气体总分子数减小的放热反应,压强一定时,升高温度,平衡逆向移动,CO的平衡转化率降低,由题图可知,温度:T1<T2<T3,D错误;温度升高,平衡逆向移动,平衡常数减小,则有平衡常数:K(a)>K(c)、K(b)=K(d),C正确;温度升高,反应速率加快,则有v(a)<v(c),B错误;平衡正向移动时,气体总物质的量减小,由于气体的总质量不变,则混合气体的平均摩尔质量增大,则有平均摩尔质量:M(a)>M(c)、M(b)>M(d),A正确。
(4)反应Ⅱ在2 L的密闭容器中进行,充入1.0 mol CO、3.0 mol H2O、1.0 mol CO2和n mol H2,此时c(H2O)=
1.5 mol·L-1、c(CO)=c(CO2)=0.5 mol·L-1、c(H2)=0.5n mol·L-1,此时浓度商为Qc===;若要使反应开始时向正反应方向进行,应满足条件:K2>Qc,即<1,从而可得n>3。
【答案】 (1)-132.0 kJ·mol-1 1
(2)①0.12 mol·L-1·min-1
②>
③正向 不变
(3)AC (4)n>3