- 1.90 MB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
物质结构 元素周期律
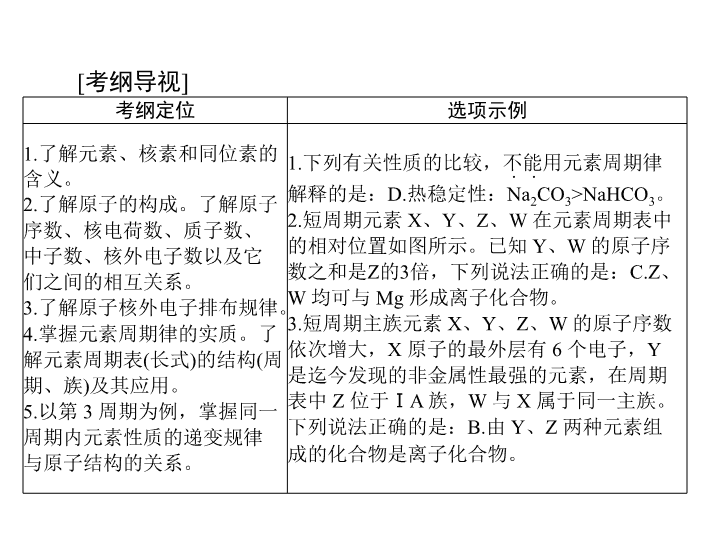
考纲定位
选项示例
1.
了解元素、核素和同位素的
含义。
2.
了解原子的构成。了解原子
序数、核
电荷数、质子数、
中子数、核外电子数以及它
们之间的相互关系。
3.
了解原子核外电子排布规律。
4.
掌握元素周期律的实质。了
解元素周期表
(
长式
)
的结构
(
周期、族
)
及其应用。
5.
以第
3
周期为例,掌握同一
周
期内元素性质的递变规律
与原子结构的关系。
1.
下列有关性质的比较,不能用元素周期律
. .
解释的是:
D.
热稳定性:
Na
2
CO
3
>NaHCO
3
。
2
.
短周期元素
X
、
Y
、
Z
、
W
在元素周期表中
的相对位置如图所示。已知
Y
、
W
的原子序
数之和是
Z
的
3
倍,下列说法正确的是:
C.Z
、
W
均可与
Mg
形成离子化合物。
3
.
短周期主族元素
X
、
Y
、
Z
、
W
的原子序数
依次增大,
X
原子的最外层有
6
个电子,
Y
是迄今发现的非金属性最强的元素,在周期
表中
Z
位于
ⅠA
族,
W
与
X
属于同一主族。
下列说法正确的是:
B.
由
Y
、
Z
两种元素组
成的化合物是离子化合物。
[
考纲导视
]
(
续表
)
考纲定位
选项示例
6.
以
Ⅰ
A
族和
Ⅶ
A
族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
7.
了解金属、非金属在元素周期表中的位置及其性质递变规律。
8.
了解化学键的定义。了解离子键、共价键的形成。
4.a
、
b
、
c
、
d
为短周期元素,
a
的原子中只有
1
个电子,
b
2
-
和
c
+
离子的电子层结构相同,
d
与
b
同族。下列叙述错误的是:
A.a
与其他三种元素形成的二元化合物中其化合价均为+
1
。
5
.
四种短周期主族元素
W
、
X
、
Y
、
Z
的原子序数依次增大,
W
、
X
的简单离子具有相同电子层结构,
X
的原子半径是短周期主族元素原子中最大的,
W
与
Y
同族,
Z
与
X
形成的离子化合物的水溶液呈中性。下列说法正确的是:
B.W
与
X
形成的化合物溶于水后溶液呈碱性。
[
基础反馈
]
1
.判断正误,正确的画“√”,错误的画“
×”
。
(1)
1
H
2
18
O
的摩尔质量为
20
g·mol
-
1
(
(2)
13
C
和
15
N
核内中子数相差
1(
)
。
)
。
(3)
不同的核素可能具有相同的质子数,也可能具有相同的
中子数,也可能具有相同的质量数,还可能质子数、中子数、
质量数均不相同
(
)
。
(5)
核外电子排布相同的微粒化学性质也相同
(
)
。
(6)
元素的氧化物对应的水化物酸性越强,非金属性越强;
碱性越强,金属性越强
(
)
。
(7)
最外层电子数等于或大于
3(
小于
8)
的一定是主族元素
(
)
。
(8)
在水溶液中能导电的化合物一定是离子化合物
(
)
。
答案:
(1)√
(2)√
(3) √
(4)×
(5)× (6)×
(7)√
(8)×
2.(1)
甲、乙是元素周期表中同一主族相邻周期的两种元素
(
其中甲在上一周期
)
,若甲的原子序数为
x
,则乙的原子序数可
能是
____________________________________
。
(2)
若甲、乙分别是同一周期的
ⅡA
族和
ⅦA
族元素,原子
序数分别为
m
和
n
,则
m
和
n
的关系为
___________________
。
答案:
(1)
x
+
2
、
x
+
8
、
x
+
18
、
x
+
32
(2)
n
=
m
+
5
、
n
=
m
+
15
、
n
=
m
+
29
考点一 原子结构
【
知识梳理
】
1.
原子的组成和结构。
(1)
原子的微粒构成。
原子
元素
化学
(2)
原子构成的表示。
质量
电荷
原子
2.
原子结构中的微粒关系。
(1)
原子。
中子
质子
质子数-电荷数
(2)
离子的核外电子数。
质子数+电荷数
3.
核外电子排布。
较低
K
L
M
电子层的表示方法及能量变化:
核外电子排布规律:
(1)
核外电子总是最先排在能量
______
的电子层里,分层运
动。各电子层符号及能量由低到高的顺序是:
____
<
____
<
____
<
____
<
____
<
____
<
____
。
N
O
P
Q
(2)
每层最多排
________
个电子。
2
n
2
8
(3)
电子数最外层不能超过
____(K
层为最外层时不超过
____)
,次外层不超过
____
,倒数第三层不超过
____
。
(4)
常见的“
10
电子”“
18
电子”微粒。
①
常见的“
10
电子”微粒
。
2
18
32
②
常见的“
18
电子”微粒
。
4.
同位素、核素。
质子数
中子数
(1)
同位素:具有相同
________
而不同
________
的同一种元
素的不同原子互称同位素。
质子数
中子数
(2)
核素:具有一定
________
和一定
________
的一种原子。
(3)
同位素的“六同三不
同
”
。
【
考点集训
】
[
例
1](2016—201
7
学年河北保定定州中学月考
)
科学家最近
发现了一种只由四个中子构成的粒子
R
,这标志着人类对化学
的是
(
)
。
A.R
与其他原子一样呈电中性
B.R
的质量数与
4
He
相同
C.
与氢元素的质子数相同
D.R
中不含质子可称为“零号元素”
解析:
粒子
R
只由四个中子构成,中子不带电,故
R
不显
电性,故
A
正确;质量数=质子数+中子数=
0
+
4
=
4
,故
B
正确;氢元素的质子数为
1
,该粒子只含有中子,不含有质子,
故
C
错误;该粒子只由四个中子构成,质子数为
0
,可称为
“零
号元素”
,故
D
正确。
答案:
C
[
例
2
](2016—2017
学年度河南郸城一中月考
)2011
年
3
月
11
日,日本福岛核电站因为
9.0
级大地震引发的海啸受损,产
生严重
的核泄漏。核泄漏物中含放射性元素碘
-131
,则有关碘
的质子数相同,所以核外电子数相同,核外电子排布方式相同,
C
项错误;同位素的化学性质相同,
D
项错误。
答案:
B
●
归纳总结
元素、核素、同位素之间的关系如下图:
=
A
-
Z
)
。
A.
原子序数为
94
B.
质子数为
94
C.
质量数为
239
D.
中子数为
94
答案:
D
考点二
元素周期表和元素周期律
【
知识梳理
】
1
.元素周期表。
(1)
形成:
1869
年,由俄国化学家
____________
初步绘制完
成。
门捷列夫
递增
电子层数
最外层电子数
(2)
编排原则:
①按原子序数
______
的顺序从左到右排列。
②把
___________
相同的元素从左到右排成横行。
③把
_____________
相同的元素按电子层数递增的顺序从上
到下排成纵行。
周期序数
分类
元素种数
0
族元素原子序数
1
短周期
2
3
4
长周期
5
6
7
(3)
结构。
①
周期
(7
个横行,
7
个周期
)
。
2
2
8
10
8
18
18
36
18
54
32
86
32
118
②
族
(18
个纵行,
16
个族
)
,填写下列各族序数。
(4)
相关关系:周期数=原子电子层数;
主族族序数=原子最外层电子数=元素最高正化合价;
最高价+
|
最低价
|
=
8
。
ⅠA
ⅡA
ⅢB
ⅣB
ⅤB
ⅥB
ⅦB
Ⅷ
ⅠB
ⅡB
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
2
.元素周期律:元素的性质随
__________
递增,而呈
核电荷数
周期性
________
变化的规律。
例如:
第三周期元素
11
Na
12
Mg
13
Al
14
Si
15
P
16
S
17
Cl
(1)
电子排布
电子层数均为
____
层,最外层电子数由
____
逐渐增到
____
(2)
原子半径
(3)
主要化合价
+
1
+
2
+
3
+
4
-
4
+
5
-
3
+
6
-
2
+
7
-
1
(4)
金属性、非金属性
3
1
7
递减
递减
递增
(续表)
第三周期元素
11
Na
12
Mg
13
Al
14
Si
15
P
16
S
17
Cl
(5)
单质与水或酸置换的难易程度
冷水
剧烈
与酸
反应快
与酸
反应慢
—
(6)
氢化物的化学式
—
SiH
4
PH
3
H
2
S
HCl
(7)
与
H
2
化合的难易程度
—
(8)
氢化物的稳定性强弱
—
难
易
增强
(续表)
第三周期元素
11
Na
12
Mg
13
Al
14
Si
15
P
16
S
17
Cl
(9)
最高价氧化物的化学式
最高价氧化物对应的水化物
(10)
化学式
(11)
酸碱性
强碱
中强碱
两性氢
氧化物
弱酸
中强酸
强酸
最强
的酸
(12)
变化规律
Na
2
O
MgO
Al
2
O
3
SiO
2
P
2
O
5
SO
3
Cl
2
O
7
H
2
SiO
3
NaOH
Mg(OH)
2
Al(OH)
3
减弱
增强
H
3
PO
4
H
2
SO
4
HClO
4
3.
同主族元素的性质与原子结构。
项 目
同主族
(
从上到下
)
(1)
最外层电子数
______________
(2)
主要化合价
(O
、
F
无正价除外
)
最高正价
______
(3)
原子半径
(0
族除外
)
逐渐
______
(4)
得失电子能力
(
副族和
0
族除外
)
得电子能力由
____
→
____
失电子能力由
____
→
____
(5)
金属性与非金属性
金属性
______
,非金属性
______
(6)
最高价氧化物对应水化物的酸碱性
碱性
______
,酸性
______
(7)
非金属的气态氢化物
生成由
______
到
______
,稳定性由
______
到
______
相同
相同
增大
减弱
强
弱
弱
强
增强
增强
易
减弱
难
强
弱
4.
元素周期表和元素周期律的应用。
(1)
根据周期表中的位置寻找元素。
半导体
①
位于分界线附近的元素既能表现出一定的金属性,又能
表现出一定的非金属性
——
可找到
________
材料;
②过渡元素区域
——
可找到
_______
和耐高温、耐腐蚀的
______
材料;
催化剂
合金
农药
③
非金属元素区域
——
可制造
______
。
(2)
预测元素的性质
(
由递变规律推测
)
。
①比较不同周期、不同主族元素的性质。
例如,金属性:
Mg>Al
,
Ca>Mg
,则碱性:
Mg(OH)
2
>Al(OH)
3
,
Ca(OH)
2
____Mg(OH)
2
(
填“
>
”“
<
”
或“=”
)
;
>
②
推测未知元素的某些性质。
难
黑
难
酸
不
如已知
Ca(OH)
2
微溶,
Mg(OH)
2
难溶,可推知
Be(OH)
2
_____
溶。
再如,已知卤族元素性质的递变规律,可推知未学元素砹
(At)
应为
______
色固体,与氢气
______
化合,
HAt
不稳定,水溶
液呈
______
性,
AgAt______
溶于水等。
【
考点集训
】
期律解释的是
(
)
。
A.
酸性:
H
2
SO
4
>H
3
PO
4
B.
非金属性:
Cl>Br
C.
碱性:
NaOH>Mg(OH)
2
D.
热稳定性:
Na
2
CO
3
>NaHCO
3
解析:
A
项利用的是元素非金属性强弱来比较最高价氧化
物对应水化物的酸性强弱,正确;
B
项根据周期表的位置关系
来判断同主族元素的非金属性强弱,正确;
C
项利用的是元素
金属性强弱来比较元素最高价氧化物对应水化物的碱性强弱,
正确;
D
项,盐的热稳定性无法应用元素周期律判断,因此错
误。
答案:
D
●
方法技巧
1.
元素的
“位
—
构
—
性”关系。
(1)
同周期从左到右,同主族从下到上,元素的非金属性逐
渐增强,体现在:
①
原子半径逐渐减小,得电子能力逐渐增强;
②
单质与氢气反应越容易,生成的氢化物越稳定;
③
最高价氧化物对应的水化物
(
即最高价含氧酸
)
的酸性越
强;
④
置换规律:氧化性强的非金属单质能置换出氧化性弱的
非金属单质。
(2)
同周期从右到左,同主族从上到下,元素的金属性逐渐
增强,体现在:
①
原子半径逐渐增大,失电子能力逐渐增强;
②
单质与酸或水反应置换出氢气越容易;
③
最高价氧化物对应的水化物
(
碱
)
的碱性越强;
④
置换规律:活泼的
(
还原性强
)
金属能置换出不活泼的
(
还
原性弱
)
金属。
2.
元素
“位”“构”“
性
”之间的互推。
Y
Z
X
W
[
例
5
]
短周期元素
X
、
Y
、
Z
、
W
在元素周期表中的相对位置如图所示。已知
Y
、
W
的原子序数之和是
Z
的
3
倍,下列说法正确的是
( )
A.
原子半径:
X
<
Y
<
Z
B.
气态氢化物的稳定性:
X
>
Z
C.Z
、
W
均可与
Mg
形成离子化合物
D.
最高价氧化物对应水化物的酸性:
Y
>
W
解析:
Y
、
W
的原子序数之和是
Z
的
3
倍,设
Y
的原子序
数为
x
,则
Z
的原子序数为
x
+
1
,
W
的原子序数为
x
+
10
,则
x
+
x
+
10
=
3×(
x
+
1)
,解得
x
=
7
,即
Y
为
N
,结合位置关系可
知,
Z
为
O
,
X
为
Si
,
W
为
Cl
。电子层数越多,原子半径越大,
则原子半径为
X
>
Y
>
Z
,
A
错误;非金属性越强,气态氢化物
越稳定,则气态氢化物的稳定性为
X
<
Z
,
B
错误;
Cl
的最高
价氧化物对应水化物的酸性为含氧酸中酸性最强的酸,则最高
价氧化物对应水
化物的酸性:
Y
<
W
,
D
错误。
答案:
C
●
方法技巧
元素周期表结构中隐含的两条规律
1.
同周期主族元素原子序数差的关系。
(1)
短周期元素原子序数差=族序数差。
(2)
两元素分布在过渡元素同侧时,原子序数差=族序数
差。两元素分布在过渡元素两侧时,四或五周期元素原子序数
差=族序数差+
10
,六、七周期元素原子序数差=族序数差+
24
。
(3)
四、五周期的
ⅡA
与
ⅢA
族原子序数之差都为
11
,六、
七周期为
25
。
2.
同主族、邻周期元素的原子序数差的关系。
(1)ⅠA
族元素,随电子层数的增加,原子序数依次相差
2
、
8
、
8
、
18
、
18
、
32
。
(2)ⅡA
族元素,随电子层数的增加,原子序数依次相差
8
、
8
、
1
8
、
18
、
32
。
(3)ⅢA
~
ⅦA
族元素,随电子
层数的增加,原子序数依次
相差
8
、
18
、
18
、
32
。
(3)0
族元素,随电子层数的增加,原子序数依次相差
8
、
8
、
18
、
18
、
32
、
32
。
[
例
6
]
短周期元素
X
、
Y
、
Z
、
W
在元素周期表中的相对位置如图所示,其中
W
原子的质子数是其最外层
A.
原子半径:
W
>
Z
>
Y
>
X
B.
最高价氧化物对应水化物的酸性:
X
>
W
>
Z
C.
最简单气态氢化物的热稳定性:
Y
>
X
>
W
>
Z
D.
元素
X
、
Z
、
W
的最高化合价分别与其主族序
数相等
解析:
同一周期的元素,原子序数越大,原子半径越小,
不同周期的元素,原子核外电子层数越多,原子半径就越大,
所以原子半径大小关系是
Z
>
W
>
X
>
Y
,
A
错误;元素的非金
属性越强,其最高价氧化物对应的水化物的酸性越强,元素的
非金属性:
X
>
W
>
Z
,所以它们的最高价氧化物对应水化物的
酸性:
X
>
W
>
Z
,
B
正确;元素的非金属性越强,其相应的氢
化物的稳定性就越强
,元素的非金属性:
Y
>
X
>
W
>
Z
,所以
元素的氢化物的稳定性:
Y
>
X
>
W
>
Z
,
C
正确;主族元素除
了
O
和
F
之外,最高化合价等于主族序数,所以
X
、
Z
、
W
的
最高化合价分别与其主族序数相等,
D
正确。
答案:
A
●
方法技巧
微粒半径大小的判断方法
[
例
7
](2016
年新课标卷
Ⅱ)a
、
b
、
c
、
d
为
短周期元素,
a
的
原子中只有
1
个电子,
b
2
-
和
c
+
离子的电子层结构相同,
d
与
b
A.a
与其他三种元素形成的二元化合物中其化合价均为+
1
B.b
与其他三种元素均可形成至少两种二元化合物
C.c
的原子半径是这些元素中最大的
D.d
和
a
形成的化合物的溶液呈弱酸性
答案:
A
解析:
a
的原子中只有
1
个电子,则
a
为氢元素,
a
、
b
、
c
、
d
为短周期元素,
b
2
-
和
c
+
离子的电子层结构相同,则
b
为氧元素,
c
为钠元素,
d
与
b
同族,则
d
为硫元素。
H
与
O
、
S
形成的化合物为
H
2
O
和
H
2
S
,氢元素的化合价为+
1
,而
NaH
中氢元素的化合价为-
1
价,
A
项错误;氧元素与其他三种元素能形成
H
2
O
、
H
2
O
2
、
SO
2
、
SO
3
、
Na
2
O
、
Na
2
O
2
,
B
项正确;同周期元素,从左到右原子半径逐渐减小,电子层数越多,原子半径越大,原子半径:
Na>S>O>H
,
C
项正确;
d
和
a
形成的化合物为
H
2
S
,
H
2
S
的溶液呈弱酸性,
D
项正确。
[
例
8
](2016
年新课标卷
Ⅰ)
短周期元素
W
、
X
、
Y
、
Z
的原
子序数依次增加。
m
、
p
、
r
是由这些元素组成的二元化合物,
n
是元素
Z
的单质,通常为黄绿色气体,
q
的水溶液具有漂白性,
0.01 mol·L
-
1
r
溶液的
pH
为
2
,
s
通常是难溶于水的混合物。上
)
。
述物质的转化关系如图所示。下列说法正确的是
(
A.
原子半径的大小:
W
<
X
<
Y
B.
元素的非金属性:
Z>X>Y
C.Y
的氢化物常温常压下为液态
D.X
的最高价氧化物的水化物为强酸
解析:
短周期元素
W
、
X
、
Y
、
Z
的原子序数依次增加。
m
、
p
、
r
是由这些元素组成的二元化合物,
n
是元素
Z
的单质,通
常为黄绿色气体,则
Z
是氯元素;
0.01 mol·L
-
1
r
溶液的
pH
为
2
,
说明
r
是强酸,因此
W
是氢元素;
q
的水溶液具有漂白性,
s
通常是难溶于水的混合物,根据转化关系图可知
m
是水,
r
是
氯化氢,
q
是次氯酸,
p
是甲烷,因此
X
是碳元素,
Y
是氧元
素。同周期自左向右原子半径逐渐减小,同主族自上而下原子
半径逐渐增大,则原子半径的大小:
W
<
Y
<
X
,
A
错误;同周
期元素,随着原子序数的增大,自左向右元素的非金属性逐渐
增强,同主族元素自上而下,随着原子序数的增大,元素的非
金属性逐渐减弱,则元素的非金属性
Y>Z>X
,
B
错误;
Y
的氢
化物是
H
2
O
或
H
2
O
2
,
二者在常温常压下都为液态,
C
正确;
X
的最高价氧化物的水化物碳酸为弱酸,
D
错误。
答案:
C
性强弱的依据的是
(
)
。
A.
单质氧化性的强弱
B.
单质沸点的高低
C.
单质与氢气化合的难易
D.
最高价氧化物对应水化物的酸
性强弱
解析:
元素的非金属性越强,其单质获得电子的能力就越
强,单质氧化性就越强,故
A
正确;
S
单质、
Cl
2
都是分子晶体,
分子之间通过分子间作用力结合,分子间作用力越大,物质的
熔沸点就越高,这与元素的非金属性强弱无关,故
B
错误;元
素的非金属性越强,其单质与氢气化合形成氢化物就越容易,
形成的氢化物的稳定性就越强。故
C
正确;元素的非金属性越
强,其最高价氧化物对应的水化物的酸性就越强,故
D
正确。
答案:
B
三
表
元素周
期表
金属性
“
右弱左
强,上弱下强,右上弱左下强
”
非金属性
“左弱右强,下弱
上强,左下弱右上强
”
金属活
动性顺
序表
按
K Ca Na Mg Al Zn Fe Sn Pb
Cu Hg Ag Pt Au
的顺
序,金属性逐渐减
弱
非金属
活动性
顺序表
按
F O Cl Br I S
的顺
序,非金属性逐
渐减弱
●
方法技巧
金属性和非金属性强弱的判断方法
三
反
应
置换
反应
强的置换弱的,适用于金属和非金属
与水或
酸反应
反应越剧烈,或最高价氧化物对应水化物的碱
性越强,则金属性越强
与氢气
反应
反应越容易发生,生成的气态氢化物的稳定性
越强,或最高价氧化物对应的水化物的酸性越
强,则非金属性越强
(
续表
)
两
池
原电池
负极材料的金属性强于正极
电解池
在阳极首先放电的阴离子,其对应元素的非金
属性弱;在阴极首先放电的阳离子,其对应元
素的金属性弱
(
续表
)
考点三
化学键
【
知识梳理
】
1.
定义:相邻原子间强烈的
____________
。
相互作用
2.
分类。
离子
偏向
阴、
阳离子间的静电作用
类型
作用方式
成键微粒
存在
(1)
离子键
_____________________
活泼金属与活泼非金属的原子
______
化合物
(2)
共
价键
①
极性键
共用
电子对
共用电子对
____
吸引电子能力强的原子
______
的非金属元素的原子
______
化合物
②
非极
性键
共用电子对
________
同一非金属元素的原子
非金属
单质
不同
共价
不偏移
3.
离子化合物与共价化合物。
离子键
共价键
离子化合物:含
________
的化合物。
共价化合物:只由
________
构成的化合物。
4
.分子间作用力和氢键
。
(1)
分子间作用力。
①定义:
把分子聚集在一起的作用力,又称范德华力。
②
特点。
熔点
沸点
a
.分子间作用力比化学键
______
得多,它主要影响物质的
_____
、
______
等物理性质,而化学键主要影响物质的化学性
质。
弱
b
.分子间作用力存在于由共价键形成的多数共价化合物和
绝大多数气态、液态、固态非金属单质分子之间。但如二氧化
硅、金刚石等由共价键形成的物质,微粒之间不存在分子间作
用力。
③
变化规律。
越大
越高
>
>
>
一般来说,对于组成和结构相似的物质,相对分子质量越
大,分子间作用力
______
,物质的熔、沸点也
______
。例如,
熔、沸点:
I
2
_____Br
2
_____Cl
2
_____F
2
(
填“
>
”“
<
”
或“=”
)
。
(2)
氢键。
①定义:分子间存在着一种比分子间作用力
______
的相互
作用。
②形成条件:除
H
外,形成氢键的原子通常是
______
、
______
、
______
。
稍强
N
升高
③
存在:氢键存在广泛,如蛋白质分子、
H
2
O
、
NH
3
、
HF
等分子之间。分子间氢键会使物质的熔点和沸点
______
。
O
F
【
考点集训
】
[
例
1
0]
下列各组化合物中,化学键类型完全相同的是
(
)
。
A.C
2
H
6
、
H
2
O
2
、
C
2
H
5
OH B.HCl
、
NaCl
、
MgCl
2
C.H
2
O
、
CO
2
、
Na
2
O
2
D.NaOH
、
NaClO
、
Na
2
O
解析:
A
项各物质只存在共价键,正确;
B
项
HCl
中只存在共价键,而
NaCl
、
MgCl
2
中存在离子键,错误;
C
项
Na
2
O
2
中存在共价键和离子键,而
H
2
O
、
CO
2
中只存在共价键,错误;
D
项
Na
2
O
中只存在离子键,而
NaOH
、
NaClO
中既存在离子键又存在共价键,错误。
答案:
A
●
归纳总结
化学键与化合物类型的关系
说明:
(1)
离子化
合物一定含有离子键,离子键只能存在
于离子化合物中;
(2)
共价键可存在于离子化合物、共价化合物和共价单质分
子中。
[
例
1
1]
下列说法中正确的是
(
)
。
A.
含有共价键的化合物一定是共价化合物
B.
分子中只有共价键的化合物一定是共价化合物
C.
由共价键形成的分子一定是共价化合物
D.
只有非金属原子间才能形成共价键
解析
:
化合物中含有共价键,还可能含有离子键,若含离
子键则为离子化合物,若不含离子键,则为共价化合物,
A
错
误,
B
正确;共价分子可以为单质,也可以为化合物,
C
错误;
通常情况下非金属原子间形成共价键,但有些金属原子与非金
属原子间也可以形成共价键,如
AlCl
3
属于共价化合物,
D
错误。
答案:
B
判
断
依
据
化学键
类型
含离子键,一定是离子化合物
只含共价键,一定是共价化合物
化合物
类型
大多数金属氧化物、强碱、盐为离子化合物
一般非金属氢化物、非金属氧化物、有机物
为共价化合物
化合物
性质
熔融状态下能导电的为离子化合物
熔融状态下不能导电的为共价化合物
●
方法技巧
离子化合物和共价化合物的判断方法
[
例
1
2](2017
届甘肃平凉庄浪紫荆中学一模
)
下列关于化学
键的叙述,正确的一项是
(
)
。
A.
离子化合物中一定含有离子键
B.
单质分子中均不存在化学键
C.
含有极性键的分子一定是极性分子
D.
含有共价键的化合物一定是共价化合物
解析:
离子化合物中一定含有离子键,可能含有共价键,
如
KOH
中含有离子键和共价键,故
A
正确;单质分子中有的
含有化学键,如
H
2
,有的不含化学键,如稀有气体分子,故
B
错误;含有极性键的分子不一定是极性分子,如果分子正负电
荷重心重合,则就是非极性分子,如
CCl
4
,故
C
错误;含有共
价键的化合物不一定是共价化合物,可能是离子化合物,如
NH
4
Cl
,故
D
错误。
答案:
A